- Реакции твердое — жидкость в системе соединения висмута — салициловая кислота , страница 8
- Большая Энциклопедия Нефти и Газа
- Получение — салициловая кислота
- Салициловая кислота. Получение и применение.
- Использование салициловой кислоты
- Применение в медицине
- Использование в косметологии
- Другие области использования
- Получение салициловой кислоты
Реакции твердое — жидкость в системе соединения висмута — салициловая кислота , страница 8
Длины связей С-С и С-О не отличаются от найденных для других ассоциированных карбоновых кислот. Длины связей С-Н 0.86±0.05 и О-Н 0.97±0.06А значительно меньше обычных (1.07 и 1.04-1.12А). Максимумы атомов Н, связанных с О, содержат значительно меньше электронов, чем максимумы остальных атомов Н, что авторами [53] истолковано как переход электронов 0.67 э от атома Н к атому О (дипольный момент нормальной связи О-Н указывает на переход 0.2 э ; больший переход в данном случае объясняется внутримолекулярной водородной связью, которая является также более сильной кислотой в сравнении с п- и м-изомерами).
2.2. Получение салициловой кислоты
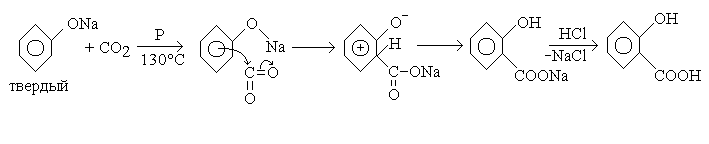
В промышленном масштабе салициловую кислоту получают по способу Кольбе, усовершенствованному Шмидтом, нагреванием фенолята натрия с углекислотой в автоклаве (способ Кольбе-Шмитта) при давлении 0.6 Мпа , температуре 185 О С в течение 8¸10 часов [51]:
Рис. 2. 4. Схема получения салициловой кислоты способом Кольбе — Шмитта.
В работе [54] для решения вопроса о том, происходит ли карбоксилирование фенолятов через стадию образования угольных солей, авторами был применен метод меченного углерода 14 С (действием 14 СО2 на натрий фенолят). Полученные кислоты имели радиоактивность ниже или равную рассчитанной для полного обмена. Оставшиеся арилугольные соли теряли значительную часть активности вследствие обмена с газовой фазой. Контрольными опытами было показано, что соли салициловой кислоты не обмениваются углеродом с СО2 в условиях опыта. Таким образом, авторами был сделан вывод, что феноляты карбоксилируются непосредственно углекислотой, минуя стадию образования арилугольных солей.
Также механизм синтеза салициловой кислоты был рассмотрен в работе [55], где авторы рассматривали вопрос о причинах альтернативного образования монозамещенных или дизамещенных солей при карбоксилировании фенолятов. В результате работы было установлено, что синтез салициловой кислоты протекает через образование динатриевой соли салициловой кислоты непосредственно из фенолята натрия и СО2. Образовавшийся в закрытом сосуде фенол, действующий как протон-акцептор, реагирует с динатриевой солью, образуя моносоль салициловой кислоты, благодаря чему ее выход приближается к теоретическому. Этот вывод авторы подтверждают наблюдением, что мононатриевая соль салициловой кислоты устойчива в присутствии фенолята натрия при 140 О С, а фенол реагирует с динатриевой солью, образуя натрий салицилат.
При осторожном нагревании салициловая кислота возгоняется, при более сильном нагревании расщепляется на фенол и угольную кислоту, причем фенол вступает в реакцию с салициловой кислотой, образуя сложный эфир НО-С6Н5-СО-ОС6Н5 (салол) [50].
При более высоких температурах (250-300 О С), особенно с фенолятом калия, образуется пара-изомер салициловой кислоты [52] (рис. 2. 5):
Рис. 2.5. Образование пара-изомера салициловой кислоты.
2.3. Строение салициловой кислоты
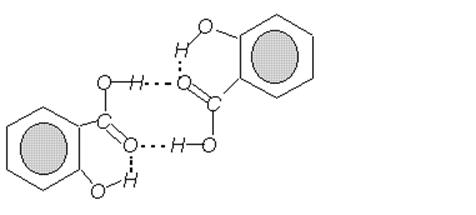
Более детально влияние внутримолекулярной связи на свойства салициловой кислоты было рассмотрено в работе Паулинга [56]. В данной работе исследовались димерные молекулы, образованные салициловой кислотой, в таких растворителях, как бензол и четыреххлористый углерод. Используя спектроскопический метод, в работе показано, что димерные молекулы не содержат групп ОН, которые не участвовали бы в образовании водородных связей.
По мнению автора это приводит к следующей структуре молекулы (рис. 2.6.):
Рис. 2.6. Структура межмолекулярных и внутримолекулярных водородных связей салициловой кислоты.
Аналогичные структуры, наблюдаемые в кристаллическом состоянии и в не очень разбавленных растворах, определяют химические и биологические свойства этого соединения [57].
В данной структуре две карбоксильные группы соединены межмолекулярными водородными связями (МВС) и, кроме того, каждая гидроксильная группа связана с атомом кислорода соседней карбоксильной группы посредством внутримолекулярной водородной связи (ВВС).
- АлтГТУ 419
- АлтГУ 113
- АмПГУ 296
- АГТУ 267
- БИТТУ 794
- БГТУ «Военмех» 1191
- БГМУ 172
- БГТУ 603
- БГУ 155
- БГУИР 391
- БелГУТ 4908
- БГЭУ 963
- БНТУ 1070
- БТЭУ ПК 689
- БрГУ 179
- ВНТУ 120
- ВГУЭС 426
- ВлГУ 645
- ВМедА 611
- ВолгГТУ 235
- ВНУ им. Даля 166
- ВЗФЭИ 245
- ВятГСХА 101
- ВятГГУ 139
- ВятГУ 559
- ГГДСК 171
- ГомГМК 501
- ГГМУ 1966
- ГГТУ им. Сухого 4467
- ГГУ им. Скорины 1590
- ГМА им. Макарова 299
- ДГПУ 159
- ДальГАУ 279
- ДВГГУ 134
- ДВГМУ 408
- ДВГТУ 936
- ДВГУПС 305
- ДВФУ 949
- ДонГТУ 498
- ДИТМ МНТУ 109
- ИвГМА 488
- ИГХТУ 131
- ИжГТУ 145
- КемГППК 171
- КемГУ 508
- КГМТУ 270
- КировАТ 147
- КГКСЭП 407
- КГТА им. Дегтярева 174
- КнАГТУ 2910
- КрасГАУ 345
- КрасГМУ 629
- КГПУ им. Астафьева 133
- КГТУ (СФУ) 567
- КГТЭИ (СФУ) 112
- КПК №2 177
- КубГТУ 138
- КубГУ 109
- КузГПА 182
- КузГТУ 789
- МГТУ им. Носова 369
- МГЭУ им. Сахарова 232
- МГЭК 249
- МГПУ 165
- МАИ 144
- МАДИ 151
- МГИУ 1179
- МГОУ 121
- МГСУ 331
- МГУ 273
- МГУКИ 101
- МГУПИ 225
- МГУПС (МИИТ) 637
- МГУТУ 122
- МТУСИ 179
- ХАИ 656
- ТПУ 455
- НИУ МЭИ 640
- НМСУ «Горный» 1701
- ХПИ 1534
- НТУУ «КПИ» 213
- НУК им. Макарова 543
- НВ 1001
- НГАВТ 362
- НГАУ 411
- НГАСУ 817
- НГМУ 665
- НГПУ 214
- НГТУ 4610
- НГУ 1993
- НГУЭУ 499
- НИИ 201
- ОмГТУ 302
- ОмГУПС 230
- СПбПК №4 115
- ПГУПС 2489
- ПГПУ им. Короленко 296
- ПНТУ им. Кондратюка 120
- РАНХиГС 190
- РОАТ МИИТ 608
- РТА 245
- РГГМУ 117
- РГПУ им. Герцена 123
- РГППУ 142
- РГСУ 162
- «МАТИ» — РГТУ 121
- РГУНиГ 260
- РЭУ им. Плеханова 123
- РГАТУ им. Соловьёва 219
- РязГМУ 125
- РГРТУ 666
- СамГТУ 131
- СПбГАСУ 315
- ИНЖЭКОН 328
- СПбГИПСР 136
- СПбГЛТУ им. Кирова 227
- СПбГМТУ 143
- СПбГПМУ 146
- СПбГПУ 1599
- СПбГТИ (ТУ) 293
- СПбГТУРП 236
- СПбГУ 578
- ГУАП 524
- СПбГУНиПТ 291
- СПбГУПТД 438
- СПбГУСЭ 226
- СПбГУТ 194
- СПГУТД 151
- СПбГУЭФ 145
- СПбГЭТУ «ЛЭТИ» 379
- ПИМаш 247
- НИУ ИТМО 531
- СГТУ им. Гагарина 114
- СахГУ 278
- СЗТУ 484
- СибАГС 249
- СибГАУ 462
- СибГИУ 1654
- СибГТУ 946
- СГУПС 1473
- СибГУТИ 2083
- СибУПК 377
- СФУ 2424
- СНАУ 567
- СумГУ 768
- ТРТУ 149
- ТОГУ 551
- ТГЭУ 325
- ТГУ (Томск) 276
- ТГПУ 181
- ТулГУ 553
- УкрГАЖТ 234
- УлГТУ 536
- УИПКПРО 123
- УрГПУ 195
- УГТУ-УПИ 758
- УГНТУ 570
- УГТУ 134
- ХГАЭП 138
- ХГАФК 110
- ХНАГХ 407
- ХНУВД 512
- ХНУ им. Каразина 305
- ХНУРЭ 325
- ХНЭУ 495
- ЦПУ 157
- ЧитГУ 220
- ЮУрГУ 309
Полный список ВУЗов
Чтобы распечатать файл, скачайте его (в формате Word).
Источник
Большая Энциклопедия Нефти и Газа
Получение — салициловая кислота
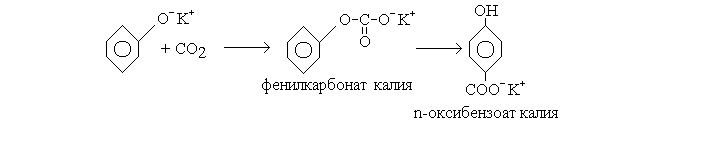
Получение салициловой кислоты производится по синтезу, открытому Кольбе и Шмиттом. [1]
При получении салициловой кислоты в производстве необходимо соблюдать определенные условия. [2]
Основным способом получения салициловой кислоты является карбок-силирование феноксида натрия диоксидом углерода под давлением при 120 — 130 С. [3]
Сообщается о получении салициловой кислоты путем перегонки. Относительно у — и 8-лактоно-кислот — см. предыдущую главу. [4]
Например, для получения салициловой кислоты безводный фенолят натрия нагревают в автоклаве ( рис. 18) при 180 С и вводят туда под давлением углекислый газ. При этом с хорошим выходом образуется натриевая соль салициловой ( о-гидроксибензойной) кислоты. [6]
Например, для получения салициловой кислоты безводный фенолят натрия нагревают в автоклаве ( рис. 18) при 180 С и вводят туда под давлением углекислый газ. При этом с хорошим выходом образуется натриевая соль салициловой ( о-гидроксибензойной) кислоты. В аналогичных условиях из фенолятов калия, рубидия или цезия получаются соответствующие соли — гидроксибензойной кислоты. [8]
Известно, что для получения салициловой кислоты надо действовать углекислотой на фенолят натрия. В подобных же условиях фенолят дает лора-изомер. Чистая натриевая соль 85 салициловой кислоты при нагревании до 300 вовсе не дает яара-изомера, тогда как калиевая ( или рубидиевая) соль салициловой кислоты при 210 — 220 полностью превращается в двуметаллическую соль р-оксибензойной кислоты. С другой стороны, нейтральная натриевая еоль р-окси-бецзойной кислоты при 290 8S дает хорошие выходы двуметал-лической соли салициловой кислоты. [9]
Способ, найденный Кольбе для получения салициловой кислоты , с успехом может применяться и в ряду пиридина. [10]
Процесс этот отличается от процесса получения салициловой кислоты по способу Кольбе только гем, что вместо фенолята натрия применяют фенолят калня. [11]
На рис. 97 приведена схема получения салициловой кислоты . [13]
Процесс во многом схож с процессом получения салициловой кислоты : 2-нафтол действием щелочи Переводят в нафтолят, который упаривают, высушивают и измельчают. Карбонизация протекает при более высокой температуре, чем при получении салициловой кислоты, — 220 — 260 С. Ее ведут в три стадии, отгоняя 2-нафтол, образующийся в результате побочных реакций. [14]
Процесс во многом схож с процессом получения салициловой кислоты : 2-нафтол действием щелочи переводят в нафтолят, который упаривают, высушивают и измельчают. Карбонизация протекает при более высокой температуре, чем при получении салициловой кислоты, — 220 — 260 С. Ее ведут в три стадии, отгоняя 2-нафтол, образующийся в результате побочных реакций. Реакционную массу растворяют в воде и отделяют от нее смолистые примеси Затем раствор подкисляют и выпавшую в осадок 2 3-оксинафтойную кислоту отфильтровывают, промывают и высушивают. [15]
Источник
Салициловая кислота. Получение и применение.
Автор: Tyorkin · Опубликовано 30 января, 2013 · Обновлено 7 июля, 2018
Салициловая кислота — это фенольная или гидроксибензойная кислота. Она представляет собой кристаллы прозрачного цвета. Они отлично растворяются в этаноле, диэтиловом эфире и прочих полярных растворителях органического происхождения. Но, сразу стоит отметить, что данное вещество не очень хорошо растворяется в простой воде. Известно, что соединение было получено из коры ивы химиком Рафаэлем Пириа. После этого кислота была синтезирована этим же ученым.
Нужно отметить, что на данный момент в природных условиях рассматриваемое вещество встречается в растениях в виде производных. Как правило, кислота прослеживается в виде гликозида метилового эфира. Известно, что она в незначительных количествах найдена в эфирном масле такого растения, как спирея.
Это вещество представляет собой двухосновную кислоту. Благодаря присутствию в составе соединения двух заместителей с совершенно противоположными мезомерным и индуктивным эффектами определяется реакционная способность салициловой кислоты.
Использование салициловой кислоты
На данный момент известно о том, что данное вещество активно используется в разных областях промышленности и производства.
Применение в медицине
Как уже отмечалось ранее, салициловая кислота — активная составляющая коры такого дерева, как ива. Ее применяли для лечения многих заболеваний еще в 19 веке. В частности, к ним можно причислить ревматизм и мочекислый диатез. На сегодняшний день данный компонент синтезируют в огромных объемах, поскольку он является незаменимой составляющей множества лекарственных средств.
Нужно обратить внимание, что кислота имеет слабовыраженные противомикробные, раздражающие и кератолитические свойства. Она используется в медицинских целях для изготовления различных мазей и растворов для наружного применения. Данными составами лечат внушительное количество заболеваний кожных покровов. Салициловая кислота является неотъемлемым ингредиентом таких медикаментозных средств, как паста Лассара, присыпка Гальманин, лекарство под названием Мозольная жидкость, а также пластырь для мозолей. Во многих аптеках можно приобрести раствор на спирту на основе данного компонента. Он предназначен исключительно для наружного использования. В нем концентрация самой кислоты может достигать 1 или даже 2%. Еще фармацевтическими фабриками выпускаются специальные мази 2, 3, 5 и 10%.
Следует заметить, что производные данного вещества активно используются в медицинской области. К ним можно причислить салицилат натрия, салициламид, а также ацетилсалициловую кислоту (всем известный Аспирин). Эти вещества славятся своими полезными жаропонижающими, противоревматическими, противовоспалительными и обезболивающими свойствами. Еще один из производных данной кислоты под названием фенилсалицилат известен как популярный антисептический компонент.
Использование в косметологии
Данное вещество имеет внушительное количество полезных свойств. Именно это делает кислоту прекрасным препаратом для борьбы с прыщами. Важно отметить, что салициловая кислота обладает прекрасным подсушивающим эффектом.
Еще данное соединение помогает справиться с пятнами, которые остаются на коже после исчезновения прыщей. Они называются — постакне. Это объясняется тем, что при лечении высыпаний на коже эта кислота крайне глубоко проникает в нее, провоцируя приток крови к месту, где она была нанесена, что, впоследствии, способствует обновлению клеточных структур. Именно в ходе процесса регенерации тканей полностью исчезают пятна от прыщей. Именно это и является главным плюсом данного лекарственного средства. Важно не забывать о том, что раствор следует применять очень осторожно. Если переусердствовать, то можно сильно пересушить кожные покровы. А это, как известно, самым негативным образом сказывается на их состоянии.
Рассматриваемый раствор борется с различными вредными микроорганизмами. Когда поры начинают забиваться, кожное сало не в состоянии попасть наружу и вследствие этого появляется комедон. Если в эту структуру попадает бактерия, то в ней начинается сильный воспалительный процесс. При своевременном использовании салициловой кислоты можно уничтожить данные микроорганизмы.
Еще это вещество помогает регулировать выделение кожного сала. Иными словами, оно дает возможность свести к минимуму продуцирование кожного сала. Кислота минимизирует жирность кожи, следовательно, поры менее забиваются излишками жира. Еще раствор помогает избавиться от черных точек на жирной коже. Он полностью растворяет их, обесцвечивает, что также считается существенным плюсом.
Другие области использования
Важно обратить внимание, что благодаря мощному антисептическому действию эта кислота используется для консервации некоторых продуктов питания. Ее задействуют для осуществления процесса производства азокрасителей, душистых соединений (эфиров рассматриваемой кислоты), а также для колориметрического определения железа.
Получение салициловой кислоты
Ранее данную незаменимую кислоту получали из вытяжек листьев ивы, а также из коры этого дерева. Некоторые ученые открыли получение данного вещества из американского барвинка. В конце 19 века немецкий химик Кольбе изобрел метод, позволяющий синтезировать кислоту в крупных объемах. Причем этот способ до сих пор активно используется в промышленности. По нему кислоту получают их фенола, натриевую соль которого обрабатывают специальным диоксидом углерода. На данный момент рассматриваемое соединение является родоначальником первой основной группы искусственных медикаментозных препаратов. Примечательно, но именно с него и началось последующее развитие фармацевтики.
Данное вещество получают карбоксилированием фенолята натрия по реакции Кольбе-Шмидта. Принцип реакции состоит в электрофильной атаке диоксидом углерода бензольного ядра. Нужно обратить внимание, что данная уникальная кислота в концентрированном виде очень токсична, поэтому с ней работать следует крайне осторожно. Женщинам, находящимся в интересном положении, желательно избегать употребления пищи, в составе которой имеются салицилаты. Это обусловлено вероятностью появления у плода синдрома Рея.
Источник