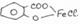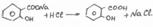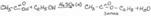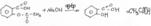Способ получения салициловой кислоты
Изобретение относится к электрохимии и аналитической химии, а точнее к технологии производства химических веществ. Изобретение наиболее эффективно может быть использовано при изготовлении красителей, при консервировании продуктов, вин, при качественном анализе, в аналитической химии, в медицинской, фармацевтической, текстильной промышленностях. Описывается способ получения салициловой кислоты, включающий нагревание фенолята натрия под давлением 0,5-0,7 МПа и температуре 120-190 o C и обработку серной кислотой. Салицилат натрия подвергают электролизу в трехкамерном электролизере с двумя катионитовыми мембранами. При этом процесс проводят при плотности тока 0,05 A/см 2 , силе тока 0,08 А и напряжении 12 В. Технический результат — повышение чистоты целевого продукта и экономичности процесса.
Изобретение относится к области электрохимии и аналитической химии, а точнее к технологии производства химических веществ.
Изобретение наиболее эффективно может быть использовано при изготовлении красителей, при консервировании пищевых продуктов, при качественном анализе химических веществ в аналитической химии, в фармацевтической, медицинской, текстильной и пищевой промышленностях.
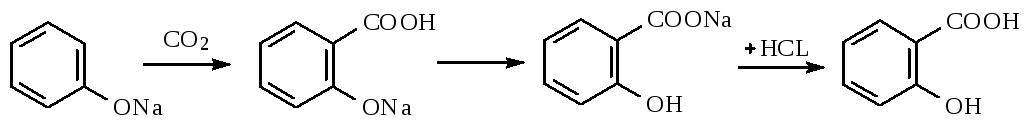
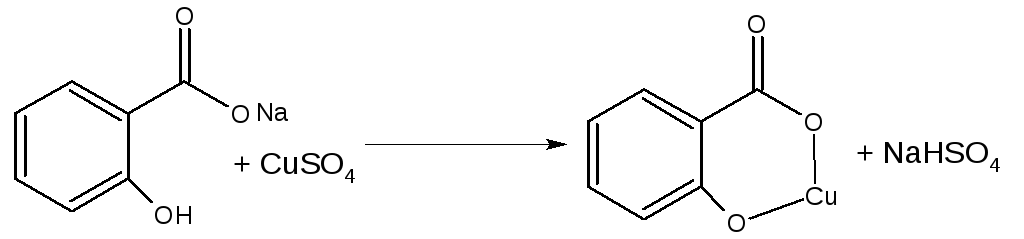
Известен промышленный химический способ выделения салициловой кислоты, согласно которому салицилат натрия, образующийся карбоксилированием фенолята натрия двуокисью углерода при повышенных температуре и давлении, обрабатывают серной кислотой. В результате реакции между растворами салицилата натрия и серной кислоты осаждается салициловая кислота, а в растворе накапливается сульфат натрия. (Эйдус Я.Т. «Синтезы органических соединений на основе окиси углерода». — М. : Наука, 1984 и Журнал «Успехи химии», Т. 64, N 9, 1995, с. 935-958).
К причинам, препятствующим достижению указанного технического результата, относится то, что в известном способе для осаждения салициловой кислоты используется ценное химическое соединение — серная кислота, а в качестве побочного продукта образуется сульфат натрия, являющийся многотоннажным отходом химических производств.
Ближайшим аналогом предлагаемого изобретения является способ выделения салициловой кислоты, согласно которому исходный раствор предварительно подкисляют минеральной кислотой до pH 6,5-7,5, отделяют от осадка и обрабатывают сульфокатионитом в аммиачной среде (а.с. СССР N 559917, кл. C 07 C 65/10, 1977).
Недостатками способа являются использование серной кислоты для осаждения салициловой кислоты, применение сульфокатионита для удаления ионов натрия и получения раствора серной кислоты для повторного использования.
Недостатком указанного способа является также необходимость регенерации сульфокатионита с использованием химического реагента.
Проведенный заявителем анализ уровня техники, включающий поиск по патентным и научно-техническим источникам информации и выявление источников, содержащих сведения об аналогах выявленного изобретения, позволил установить, что заявитель не обнаружил источник, характеризующийся признаками, тождественными признаками заявленного изобретения.
Задача предлагаемого изобретения — повышение эффективности процесса. Технический результат — получение чистой салициловой кислоты за счет отсутствия отходов сульфата натрия.
При этом надо отметить экономичность процесса за счет исключения из технологического процесса — серной кислоты и регенерации сульфокатионита.
Сущность процесса в том, что вместо серной кислоты, которая используется для разложения салицилата натрия, используется электрический ток. Салицилат натрия подвергают электролизу в трехкамерном электролизере с двумя катионитовыми мембранами. При этом процесс проводят при плотности тока 0,05 А/см 2 .
Надо отметить, что экономичность способа заключается и в концентрировании щелочи натрия в ходе электролиза. Она может быть использована для получения фенолята натрия — исходного получения салициловокислого натрия.
Повышение эффективности способа достигается путем осуществления безотходного производства, сокращения времени проведения процесса, уменьшения количества реактивов и энергозатрат.
В среднюю камеру заливают 200 мм 1 н раствора салицилата натрия. В анодную камеру заливают 200 мм 1 н раствора серной кислоты. В катодную камеру заливают 200 мл 1 н раствора едкого натра. Электролиз проводят при разной плотности тока: от 0,05 до 0,25 А/см 2 .
Салицилат натрия гидролизуется с образованием салициловой кислоты, ионов натрия и гидрoкcид-иoнoв.
Ионы натрия под действием электрического тока проходят через катионитовую мембрану в катодную камеру, где соединяются со свободной гидроксогруппой, образуя щелочь натрия. Таким образом, NaOH концентрируется в катодной камере.
В анодной камере происходит окисление воды с образованием свободных катионов водорода, которые проникают в среднюю камеру электролизера через катионитовую мембрану. И кислота в анодной камере тоже концентрируется за счет выделения O2.
В средней камере салициловая кислота, как малорастворимое вещество, выпадает в осадок и подвергается фильтрации.
После окончания электролиза растворы сливают в специальную посуду, проверяют титрованием концентрацию растворов.
В результате эксперимента было выяснено, что при плотностях тока меньше чем 0,05 А/см 2 интенсивность процесса низкая. При более высокой плотности тока, выше 0,25 А/см 2 , салициловая кислота выделяется на мембране в анодной камере, загрязняя этим самым поверхность мембраны, что приводит к увеличению силы тока, повышению напряжения, и на самом электроде тоже выделяется салициловая кислота, что крайне нежелательно.
Таким образом, изложенные сведения свидетельствуют о том, что предложенный способ: 1) экономичен за счет исключения отдельных приемов; 2) экологически чист за счет исключения из процесса серной кислоты; 3) в процессе электролиза образуется едкий натр, который используется для получения фенолята натрия (исходное сырье).
Для заявленного способа в том виде, как он охарактеризован, подтверждена возможность его осуществления с помощью описанной методики.
Способ получения салициловой кислоты из раствора салицилата натрия, отличающийся тем, что салицилат натрия подвергают электролизу в трехкамерном электролизере с двумя катионитовыми мембранами при плотности тока 0,05 А/см 2 .
Источник
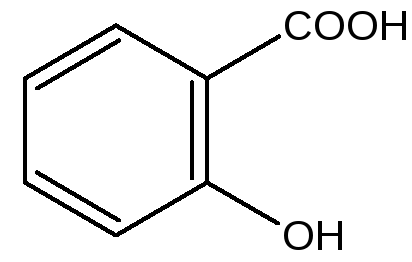
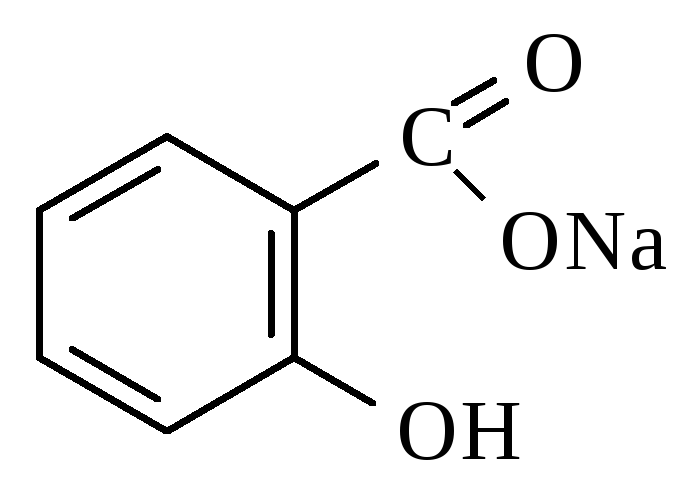
Кислота салициловая Натрия салицилат
Структура. Химическое название
МНН, латинское название. Формы выпуска. Фармакологическое действие
Антисептическое, кератолитическое средство
Субстанция, таблетки 0,25; 0,5
1 0% раствор для инъекций.
Противоревматическое,противовоспалительное, болеутоляющее, жаропонижающее средство
Получение
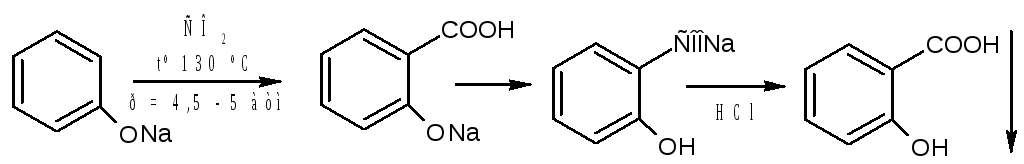
Салициловую кислоту карбоксилированием фенолята натрия по реакции Кольбе-Шмидта:
Механизм реакции Кольбе-Шмидта заключается в электрофильной атаке диоксидом углерода бензольного ядра. Фенольный гидроксил ориентирует заместитель в орто- и пара- положение. Но присутствие катиона натрия Na + позволяет получать преимущественно орто- оксибензойную (салициловую) кислоту, с ионом К + получается смесь о- и п- оксибензойных кислот. Внутримолекулярная перегруппировка основана на том, что СООН – вытесняет фенолы из их солей, как более сильная кислота. Образовавшийся салицилат натрия подкисляют НCl и выделившуюся салициловую кислоту перекристаллизовывают.
Как побочный продукт может образовываться оксидифенил – примесь способа получения
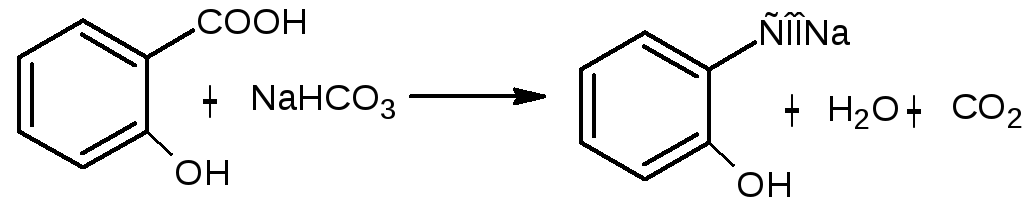
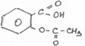
Натрия салицилат получают, нейтрализуя салициловую кислоту натрия гидрокарбонатом:
Описанне
Кислота салициловая – белые мелкие игольчатые кристаллы или легкий кристаллический порошок без запаха. При осторожном нагревании возгоняется, летуч с водяным паром.
Натрия салицилат – белый кристаллический или аморфный порошок без запаха.
Растворимость
Кислота мало растворима в воде, растворима в кипящей воде, легко растворяется в этаноле, эфире.
Натриевая соль очень легко растворима в воде, растворима в спирте, не растворима в эфире.
Подлинность
1. ИК-спектр поглощения натрия салицилата в области 4000-400 см-1 . (спреcсованный в таблетках с калия бромидом) должен полностью совпадать с прилагаемым к ФС рисункам спектра.
2. УФ-спектр раствора кислоты салициловой в растворе кислоты серной имеет два максимума поглощения при 235±2 и 300±2 нм.
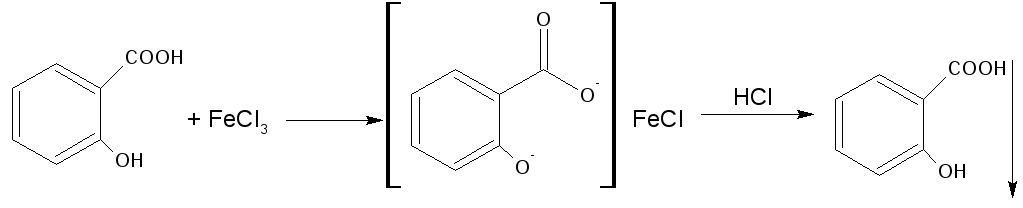
3.Реакция солеобразования с хлоридом железа (III) на салицилат-ион. (общая ФС реакция)
Эффект реакции — образование сине-фиолетового(салициловая кислота) или красно-фиолетового (салицилат натрия) окрашивания. Окрашивание исчезает при добавлении минеральной кислоты и выпадает осадок кислоты. При добавлении СН3СООН окраска сохраняется.
Реакция обусловлена кислотными свойствами карбоксильной группы и фенольного гидроксила. Состав и цвет комплекса зависят от соотношения реактива и препарата, и от рН среды:
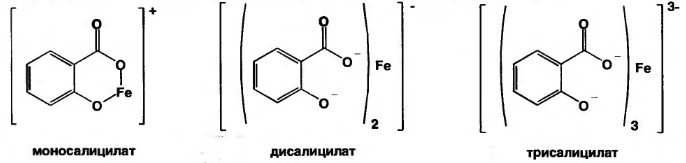
А) при рН=2,0-3,0 образуется моносалицилат, окрашенный в сине-фиолетовый цвет. Этот комплекс разрушается при рН=1,0 и ниже (минеральная кислота) и выпадает осадок белого цвета.
ГФ кислоты салициловой
Сине -фиолетовое окраш. белый
или
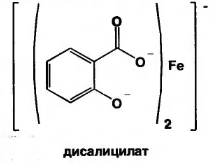
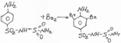
Б) при рН=3,0-8,0 образуется дисалицилат красно-фиолетового цвета. Реакция идет между натрия салицилатом и FeCl3, т.е. кислоту предварительно переводят в натриевую соль.
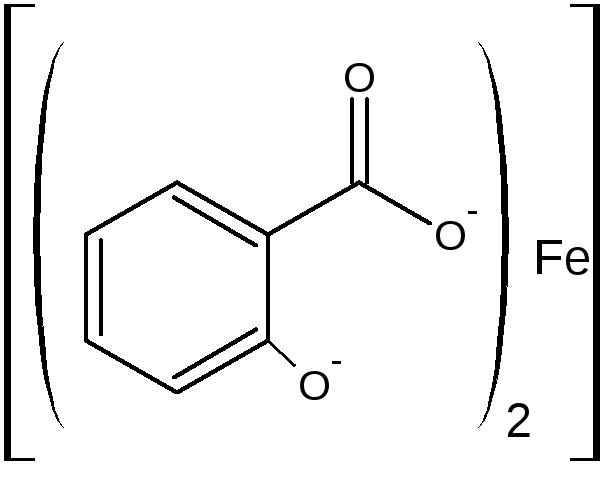
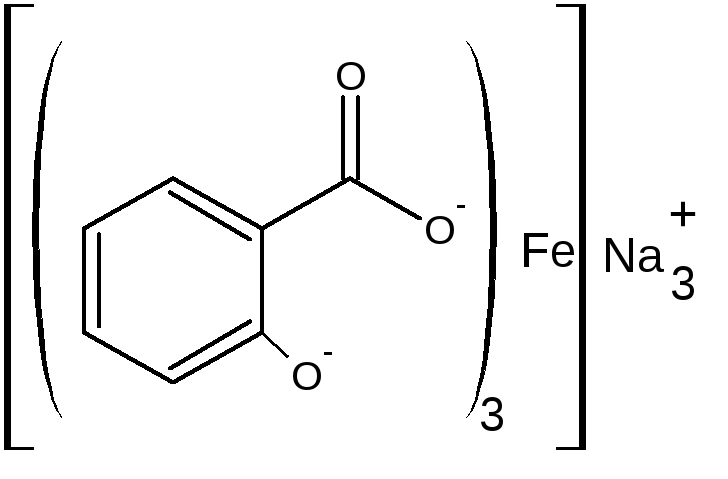
В) при рН=8,0-10,0 (одна капля раствора аммиака) образуется трисалицилат желтого цвета.
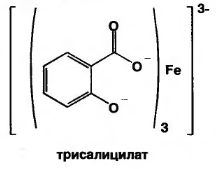
Фармакопейная реакция подлинности на препараты группы
Реакцией открывают примесь салициловой кислоты в препаратах, являющихся производными салициловой кислоты.
синий красный желтый
Не фармакопейные реакции солеобразования:
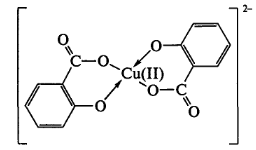
Салицилат – ион образует комплексную соль с CuSО4.Раствор окрашивается в зеленый цвет и при добавлении хлороформа окраска водного слоя сохраняется. У бензоат-иона слой хлороформа окрашивается в голубой цвет, водный – обесцвечивается (экстракция неполярного соединения). Салицилатный комплекс несет отрицательный заряд, поэтому в хлороформ не экстрагируется (реакция отличия)
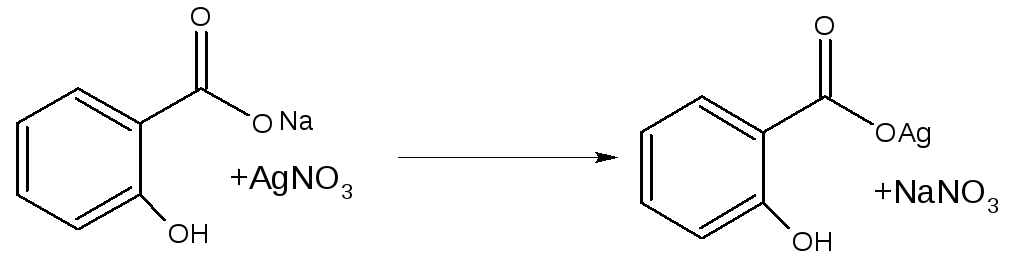
В нейтральной среде с АgNO3 образуется белый осадок серебряной соли.
4. Реакции декарбоксилирования (на карбоксильную группу)
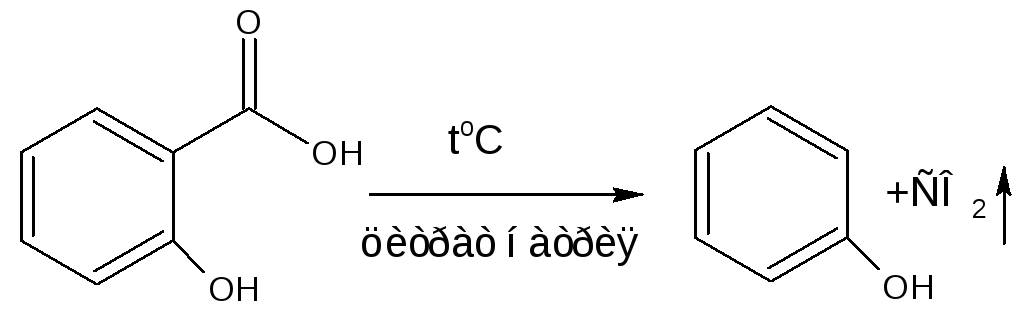
А) ФС кислоты салициловой. При нагревании с натрия цитратом появляется запах фенола.
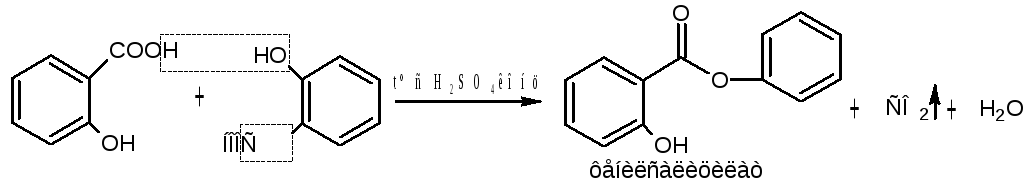
Б) ФС кислоты салициловой. При нагревании с концентрированной серной кислотой идет декарбоксилирование и реакция этерификации с образованием фенилового эфира салициловой кислоты, выделяющийся оксид углерода (IV) определяется по помутнению известковой воды (кальция гидроксид).
5.ФС на натрия салицилат.
1) При действии разв. HNО3 на натриевую соль, выделяется салициловая кислота, у которой, определяют температуру плавления (156-161°С).
2) Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет (катион натрия).
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
Салицилат натрия – Natrii salicylas
Получают при нейтрализации кислоты раствором Na2CO3. Полученный раствор выпаривают. Сухой остаток очищают многократной перекристаллизацией воды.
Свойства. Белый кристаллический порошок или мелкие чешуйки, без запаха, сладковато-соленого вкуса.
Очень легко растворим в воде, легко растворим в спирте, практически нерастворим в эфире. Реакция водных растворов щелочная.
А) Крупинка соли внесенная в бесцветное пламя окрашивает его в желтый цвет.
Б) С цинк-уранил-ацетатом
Получается кристаллический светло-желтый осадок.
2 На кислотную часть
К раствору препарата прибавляют FeCl3, появляется сине-фиолетовое окрашивание устойчивое в CH3COOH, исчезает при добавлении HCl.
Б) К раствору препарата прибавляют соляную кислоту и образуется осадок кислоты, который отделяют, сушат и определяют температуру плавления = 156-161 0 С.
ТНП растворяют в воде и добавляют эфир, добавляют смешанный индикатор метиловый синий и метиловый оранжевый (1:1). Раствор титруют раствором HCl с 0,5 моль/л и титруют до фиолетовой окраски водного слоя.
Эфир добавляют для извлечения кислоты, выделяющийся в процессе титрования.
Возможен метод броматометрия
Применение.Как болеутоляющее, противовоспалительное и жаропонижающее средство.
Хранение. В плотноукупоренной таре,предохраняющей от действия света.
Acidum acetylsalicylicum (Aspirinum)
Салициловый эфир уксусной кислоты
Получают ацетилированием салициловой кислоты
Свойства.Бесцветные кристаллы или белый кристаллический порошок со слабым запахом и слабо-кислого вкуса. Мало растворим в воде, легко — в спирте, растворим в хлороформе, эфире, в растворах щелочей и карбонатах щелочных металлов.
1 Реактив FeCl3 ( отличие от салициловой кислоты)
Эффект отсутствует, т.к. фенольный гидроксил образовывает сложную эфирную группу.
2 Щелочной гидролиз и доказательство продуктов гидролиза.
К препарату прибавляют раствор щелочи и нагревают. Затем к полученному раствору добавляют HCl, ощущается запах уксусной кислоты и образуется осадок (салициловой кислоты). Раствор с осадком фильтруют. К раствору (фильтрату) добавляют этиловый спирт и несколько капель конц H2SO4 и нагревают. Ощущается характерный запах этилацетата. К осадку добавляют FeCl3 появляется сине-фиолетовое окрашивание.
3 Кислотный гидролиз и доказательство составных частей
Препарат и конц H2SO4 помещают в выпарительную чашку. Добавляют несколько капель воды. Ощущается запах уксусной кислоты. Затем прибавляют раствор формальдегида, появляется малиновое окрашивание (ауриновый краситель).
Метод нейтрализации в спиртовой среде
ТНП растворяют в спирте. Охлаждают до температуры 10-12 0 С и титруют раствором щелочи , моль/л до розовой окраски. Индикатор – фенолфталеин.
Для растворения препарата, для предотвращение гидролиза препарата и продуктов реакции. Низкая температура нужна для предотвращения гидролиза препарата.
Ацетилсалициловую кислоту можно определить количественными методами:
1 Метод нейтрализации (обратное титрование)
Препарат подвергается гидролизу в избытке щелочи. Не вступившая щелочь титруют кислотой.
Применение. В желудке не изменяется,а в щелочной среде кишечника распадается с образованием салицилата натрия ( частично препарат всасывается неизмененным). Применяется как противоревматическое, противовоспалительное, жаропонижающее и болеутоляющее средство при невралгии, головных болях, гриппе в смеси с другими препаратами (н-р, фенацетином, кофекином идр.)
С некоторыми веществами основного характера дает отсыревающие смеси.
Хранение. В сухом месте, плотно укупоренной таре.
Аминопроизводные ароматического ряда.
Стрептоцид – Streptocidum
Свойства.Кристаллический порошок белого цвета (иногда с желтоватым оттенком), без запаха, горького вкуса. Плохо растворим в воде, растворим в спирте, ацетоне.
I На ароматическую аминогруппу
Реакция диазотирования с последующим азосочетанием.
Препарат растворяют в HCl и добавляют NaNO2. Полученный раствор выливают в щелочной раствор B-нафтола, появляется вишневое окрашивание или осадок красно-оранжевого цвета (азокраситель).
2 Лигниновая проба – ВАК
На бумагу низкого качества (газета) добавляют несколько крупинок препарата и HCl появляется оранжевое пятно.
II Доказательство сульфогруппы
Сначала препарат минерализуют действием конц HNO3
Выделившаяся H2SO4 доказывают с BaCl2
3 Доказательство ароматического кольца
Если к раствору сульфаниламидов прибавить раствор брома (желтый), то он обесцвечивается.
ТНП взбалтывают с водой прибавляют соляную кислоту, добавляют кристаллический KBr (катализатор) и титруют раствором NaNO2 0,1 моль/л до красно-фиолетового в голубой. Индикатор – тропиолин ОО + метиловый синий.
Применение. антимикробное средство.
Хранение сп.Б Во флаконах тьемного стекла в плотно укупоренной таре.
Дата добавления: 2018-02-18 ; просмотров: 2732 ; Мы поможем в написании вашей работы!
Источник