Производство нитрата калия
Нитрат калия KNO3 (калийная селитра) используется в производстве порохов, в пиротехнике, в пищевой и стекольной промышленности и как удобрение.
KNO3 можно производить несколькими методами. Самые простые методы: нейтрализация КОН или К2CO3 азотной кислотой или абсорбция калиевыми щелочами нитрозных газов широко не распространены, вследствие дороговизны исходных калиевых соединений.
Наибольшее промышленное распространение имеет конверсионный способ получения нитрата калия. Этот способ основан на обменном разложении NаNO3 и КCl:
NаNO3 + КCl 
NаNO3 получают путем щелочной абсорбции выхлопных нитрозных газов, при производстве азотной кислоты, КCl из сильвинита или других калийных солей.
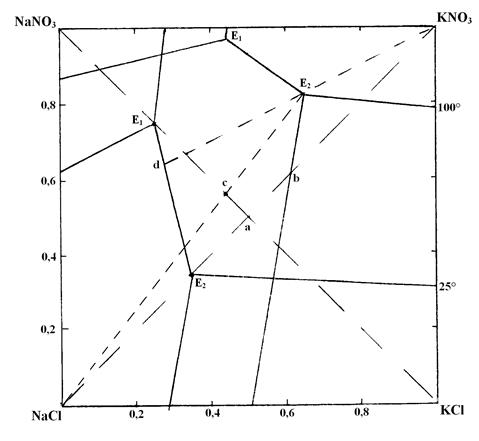
Диаграмма состояния солей, участвующих в реакции – это четырехугольник. В поле расположены поля кристаллизации солей – участников реакции и изотермы кристаллизации при 25 и 100°С. Из диаграммы видно, что поле кристаллизации при 25°С самое большое у KNO3, а при 100°С – самое маленькое (оно уменьшается примерно в 3 раза, что очень важно для технологии).
Процессы кристаллизации проходят также как и в системе NaCl–NаHCO3–NH4HCO3–NH4Cl, свойства диаграммы те же. В данном случае NaNO3–KCl – метастабильная диагональ, NaCl–KNO3 – стабильная диагональ.
Если приготовить раствор эквимолекулярной смеси КCl и NаNO3 при 100°C, то фигуративная точка (точка а) системы окажется в поле кристаллизации NаCl, и он начнёт выпадать из раствора при его выпаривании, состав смеси будет меняться по ав. Если выделить осадок NaCl и охладить раствор до 25°C, то начнёт кристаллизоваться KNO3 (точка будет лежать в его поле). Состав будет меняться по линии в Е2 25 .
Однако при таком пути кристаллизации выход KNO3 мал. Наибольший выход получается, если к концу выделения NaCl раствор будет насыщен NaCl, KCl, KNO3 (точка Е2 100 ). Значит необходимо взять исходную смесь солей в точке С: Nа + – 0,58 , К + – 0,42, Cl — – 0,42, NO3 — – 0,58, т.е. избыток NаNO3. Тогда после отделения кристаллов NаCl и охлаждения кристаллизация KNO3 будет идти по наиболее длинному пути (Е2 100 ) и будет максимальный выход продукта.
Дата добавления: 2015-06-17 ; просмотров: 3087 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Способ получения нитратов металлов
2GI352 союз Соеетоних
Зависимое от авт, свидетельства №
Заявлено 14.V.1966 (№ 1078409/23-26) с присоединением заявки №
Опубликовано 08.1Х.1967. Бюллетень № 18
УДК 546.175:661.874 (088.8) Комитет оо делам изобретений и открытий ори Сонете Министров есср
Дата опубликования описания 31.Х.1967
Авторы изобретения Ф. А. Петрачков, В, П. Карлов и Л. А. Чернявская
Заявитель Донецкий филиал Всесоюзного научно-исследовательского института химических реактивов и особо чистых химических веществ
СПОСОБ ПОЛУЧЕНИЯ HNTPATOB МЕТАЛЛОВ
Известно, что многие металлы, имеющие отрицательный потенциал относительно водорода, растворяются в азотной кислоте с выделением различных продуктов восстановления азотной кислоты, в том числе и аммиака, который, реагируя с избытком азотной кислоты в растворе, образует нитрат аммония.
Известен способ растворения никеля, при котором нет реакции образования нитрата аммония, путем растворения никеля в травочном растворе, содержащем 700 — 1000 г/л
%(МОз) . 6Н О и 60 г/л азотной кислоты при температуре 85 — 110 С. Однако при организации крупнотоннахкных производств азотнокислого никеля и других нитратов металлов накопление нитрата аммония потребует очистки раствора азотнокислого пикеля от примеси нитрата аммония.
Известен способ удаления аммонийных солей путем сухого остатка, но это энергоемкий процесс.
Другой способ состоит в добавке щелочи и отгонке аммиака при кипячении раствора.
Однако при этом pacranp загрязняется ионами щелочного металла.
Предложен и проверен на опытах более рациональный и технически легко выполнимый способ, состоящий в обработке растворов нитратов металлов окислами азота. Предлагаемьн» способ основан на использовании известных реакций.
Так, известно, что при растворении N.O, (или смеси NO u NO — равных количеств) в воде образуется азотистая кислота. При наличии в растворе ионов NH 4, NO 3, NO, будет образовываться определенное количество
Известно, что ннтрит аммония в виде слабокислого раствора легко разлагается с выделением азота и воды.
По предложенному способу очистки раствора азотнокислого никеля от примеси азотпокислого аммония в нагретый раствор пропускают окислы азота (N О;). При этом протекают вышеуказанные реакции, в результате чего уменьшается концентрация нитрата ам1 мония. Например, брали раствор, содержащий 1000 г/л Ni (NO,) 6НзО и 56,3 г/ г МН„JO;„
Этот раствор помещали в стеклянную колонку, заполненную кольцами Рашига. Температуру в колонке поддерживали постоянной (при помощи термостата) и равной 92 С. Снизу в колонку подавали окислы азота, получаемые при взаимодействии нитрата натрия и азотной кислоты.
После 30 лин барботажа содержание нитрата аммония в растворе снизилось до 12 г/л, т. е. разрушилось 79% нитрата аммония, содержащегося в растворе.
В аналогичном опыте при температуре в колонке, равной 71 С, концентрация азотнокислого аммония понизилась за 30 лин до
29 г/г нитрата аммония, т. е. разрушилось
50% азотнокислого аммония.
Составитель Г. Леонтьева
Техред Т. П. Курилко Корректор О. Б. Тюрина
Редактор С. Л. Барсуков
Заказ 3275/19 Тираж 535 Подписное
ЦНИИПИ Комитета по делам изобретений и открытий при Совете Министров СССР
Москва, Центр, пр. Серова, д. 4
Типография, пр. Сапунова, 2 1 ак, установлено, что оптимальная тс гггература разруше ия азотпокпслого аммония ио предлагаемому способу равна 00 С.
1. Способ получения нитратов металлов путем растворения металлов в азотной кислоте при Ilагрсвапl!!1, О!л!Счс!IО!Е(. ся тем, что, с целью очистки раствора питрата металла от примеси Нитрата аммоиия, его обрабатывают окислами азота.
2. Способ по п. 1, отли !а!О!цийся тем, что, раствор нитрата металла обрабатывают окисла пи азота при температуре около 90 С.
Источник
Промышленный способ получения нитратов
Ключевые слова конспекта: нитраты, соли азотной кислоты, селитра, получение и применение нитратов, влияние нитратов на окружающую среду и здоровье человека.
Азотная кислота – одноосновная, образует один ряд солей – нитраты состава X(NO3)n, где X – катион металла или NH4.
Нитраты щелочных металлов и аммония называют селитрами.
Нитраты – вещества с преимущественно ионным типом кристаллических решёток. При обычных условиях это твёрдые кристаллические вещества, которые могут быть окрашены только за счёт катионов металлов. Практически все нитрaты хорошо растворимы в воде, легкоплавки.
В водных растворах нитратов не происходит гидролиз по аниону, так как HNO3 – сильная кислота.
Нитpаты разлагаются при нагревании, так как происходит внутримолекулярное окисление-восстановление. Азот в высшей степени окисления является окислителем по отношению к кислороду О –2 .
Нитрaты щелочных (кроме Li) и щёлочноземельных металлов разлагаются с образованием нитритов и кислорода:
Нитpaты металлов, расположенных в электрохимическом ряду напряжений металлов от Mg до Си включительно, и нитрат Li разлагаются в соответствии со схемой:
Нитpаты металлов, расположенных в электрохимическом ряду напряжений металлов правее Си, разлагаются по схеме:
Особый случай – разложение NH4NO3. При плавлении разлагается:
Получение и применение нитратов
Нитраты получают действием азотной кислоты HNO3 на металлы, оксиды, гидроксиды, соли.
Соли азотной кислоты устойчивы при обычной температуре. Они обычно плавятся при относительно низких температурах (200—600 °C), зачастую с разложением.
Основное применение нитратов — удобрения (селитры), взрывчатые вещества (аммониты), получение стекла, производство лекарств, пищевые добавки при производстве колбас, в пиротехнике, компоненты ракетного топлива.
Соли азотной кислоты являются компонентами минеральных удобрений. Растения используют азот из соли для построения клеток организма, создания хлорофилла.
Влияние нитратов на окружающую среду и здоровье человека
Азот как основной питательный элемент влияет на рост вегетативных органов – зеленых стеблей и листьев. Избыточное употребление азотных удобрений не только ведет к аккумуляции нитратов в растениях, но и приводит к загрязнению ими водоемов и грунтовых вод. Для суммы нитрат-ионов в почве принята предельно допустимая концентрация (ПДК) – 130 мг/кг, в воде разных водоисточников – 45 мг/л.
Для самих растений нитраты безвредны, а вот для человека и травоядных животных они опасны. Смертельная доза нитратов для человека 8 — 15 г, допустимое суточное потребление – 5 мг/кг. Многие растения способны накапливать большие количества нитратов, например: капуста, кабачки, петрушка, укроп, свекла столовая, тыква и др. Такие растения называют нитрато-накопителями.
В организм человека 70% нитратов поступает с овощами, 20% – с водой, 6% – с мясом и рыбой. Попадая в организм человека, часть нитратов всасывается в желудочно-кишечном тракте в неизмененном виде, другая часть, в зависимости от присутствия микроорганизмов, значения рН и других факторов, может превращаться в более ядовитые нитриты, аммиак, гидроксиламин NН2ОН; в кишечнике из нитратов могут образоваться вторичные нитрозамины R2N–N=О, обладающие высокой мутагенной и канцерогенной активностью. Признаки небольшого отравления – слабость, головокружение, тошнота, расстройство желудка и т. д. Снижается работоспособность, возможна потеря сознания.
Конспект урока «Соли азотной кислоты».
Источник
Большая Энциклопедия Нефти и Газа
Получение — нитрат — натрий
Получение нитрата натрия ( или калия) методом катионного обмена является сравнительно энергоемким процессом, следовательно, применение этого метода целесообразно главным образом в районах, располагающих дешевой электроэнергией. Преимуществом метода является простота оформления основных технологических стадий процесса и возможность получения натриевой или калиевой селитры без применения дефицитных щелочей. [1]
Получение нитрата натрия обработкой водного раствора карбоната натрия смесью окислов азота и кислорода. [2]
Получение нитрата натрия , а через него и нитрата калия, с применением для этой цели соды вследствие дефицитности последней не имеет в ближайшее время перспектив для развития. В этом отношении методы, основанные на использовании хлоридов, являются более перспективными. [3]
Получение нитрата натрия обработкой водного раствора карбоната натрия смесью окислов азота и кислорода. [4]
Получение нитрата натрия ( или калия) методом катионного обмена является сравнительно энергоемким процессом, и. [5]
Возможно также получение нитрата натрия ( или калия) методом катионного обмена, который заключается в пропускании раствора кальциевой селитры через аппараты, заполненные катионитом ( стр. [6]
Заводские способы получения нитрата натрия основаны на абсорбции окислов азота раствором соды, или на обменном разложении других нитратов с соединениями натрия, или на катионном обмене. [7]
Заводские способы получения нитрата натрия основаны на абсорбции окислов азота раствором соды, или на обменном разложении других нитратов с соединениями натрия, или на катионном обмене. Наиболее простой способ получения нитрата натрия — — нейтрализация азотной кислоты содой или едким натром в промышленности не используется из-за неэкономичности. Наиболее распространенный промышленный способ основан на абсорбции щелочами окислов азота из выхлопных нитрозных газов производства азотной кислоты. [8]
Распространенный промышленный метод получения нитрата натрия основан на абсорбции щелочами окислов азота, содержащихся в выхлопных нитрозных газах производства разбавленной азотной кислоты, и последующей инверсии нитрита в нитрат натрия. [9]
Представляют интерес способы получения нитрата натрия , не требующие затраты соды или едкого натра. [11]
Одним из способов получения нитрата натрия является его выделение из нитрит-нитратного щелока до инверсии. В этом случае процесс абсорбции окислов азота ведут таким образом, чтобы получить щелок по возможности с большим содержанием нитрита и с меньшим нитрата. [12]
Представляют интерес способы получения нитрата натрия , не требующие затраты соды или едкого натра. К таким способам относятся получение нитрата натрия из поваренной соли и окислов азота, аналогичное получению калиевой селитры ( стр. [14]
Наиболее простой способ получения нитрата натрия — нейтрализация азотной кислоты содой или едким натром в промышленности не используется из-за неэкономичности. Наиболее распространенный промышленный способ основан на абсорбции щелочами окислов азота из выхлопных нитрозных газов производства азотной кислоты. [15]
Источник
Нитраты. Свойства. Получение и применение
Автор: Пользователь скрыл имя, 04 Декабря 2011 в 21:28, курсовая работа
Краткое описание
Нитраты – соли азотной кислоты. Известны для большинства металлов. В настоящее время нитраты широко используются во многих отраслях промышленности, а так же в сельском хозяйстве и медицине. Разнообразие свойств и достаточно широкое использование нитратов определяют актуальность курсовой работы.
Целью курсовой работы является рассмотрение свойств, получения и применения нитратов. Исходя из указанной цели, можно выделить частные задачи, поставленные в курсовой работе:
На основе анализа литературы рассмотреть химические и физические свойства нитратов, основные способы получения и применения.
Оглавление
Файлы: 1 файл
Kyrsa4.docx
3.2Физические и химические свойства
Физические и химические свойства безводного и гидратированного нитрата одного и того же металла могут сильно отличаться.
Безводные нитраты – кристаллические соединения; нитраты d-элементов окрашены. Условно нитраты могут быть разделены на соединения с преимущественно ковалентным типом связи (соли Be, Cr, Zn, Fe и др. переходных металлов) и с преимущественно ионным типом связи (соли щелочных и щелочноземельных металлов). Для ионных нитратов характерны более высокая термическая устойчивость, преобладание кристаллических структур более высокой симметрии (кубической) и отсутствие расщепления полос нитрат-иона в инфракрасных спектрах. Ковалентные нитраты имеют более высокую растворимость в органических растворителях, более низкую термическую устойчивость, их инфракрасные спектры носят более сложный характер; некоторые ковалентные нитраты летучи при комнатной температуре, а при растворении в воде частично разлагаются с выделением оксидов азота.
Все безводные нитраты проявляют сильные окислительные свойства, обусловленные присутствием иона NO3 — , при этом их окислительная способность возрастает при переходе от ионных к ковалентным нитратам. Последние разлагаются в интервале 100-300°С, ионные – при 400-600°С (NaNO3, KNO3 и некоторые другие при нагревании плавятся). Продуктами разложения в твердой и жидкой фазах являются последовательно нитриты, оксонитраты и оксиды, иногда – свободные металлы (когда оксид неустойчив, например Ag2O), а в газовой фазе – NO, NO2, О2 и N2. Состав продуктов разложения зависит от природы металла и его степени окисления, скорости нагревания, температуры, состава газовой среды и других условий.
Переходные металлы в высоких степенях окисления из-за стерическич затруднений не могут образовывать безводные нитраты, и для них характерны оксонитраты, например UO2(NO3)2, NbO(NO3)3. Нитраты образуют большое кол-во двойных и комплексных солей с ионом NO3 — во внутренней сфере. В водных средах в результате гидролиза катионы переходных металлов образуют гидроксонитраты (основные нитраты) переменного состава, которые могут быть выделены и в твердом состоянии.
Гидратированные нитраты отличаются от безводных тем, что в их кристаллических структурах ион металла в большинстве случаев связан с молекулами воды, а не с ионом NO3 — . Поэтому они лучше, чем безводные нитраты, растворяются в воде, но хуже – в органических растворителях, более слабые окислители, инконгруэнтно плавятся в кристаллизационной воде в интервале 25-100°С. При нагревании гидратированных нитратов безводные нитраты, как правило, не образуются, а происходит термолиз с образованием гидроксонитратов и затем оксонитратов и оксидов металлов.
Анализ нитратов на нитрат-ион основан на его восстановлении до NH3 сплавом Деварда и поглощении NH3 титрованным раствором кислоты либо на осаждении в виде нитроннитрата с помощью нитрона.
3.3 Получение и применение
Промышленные методы получения нитратов основаны на поглощении NH3 растворами HNO3 (для NH4NO3) или на поглощении нитрозных газов (NO + NO2) растворами щелочей или карбонатов (для нитратов щелочных металлов, Са, Mg, Ba), а также на разнообразных обменных реакциях солей металлов с HNO3 или нитратов щелочных металлов. Жидкий оксид N2O4 используется как неводный растворитель для синтеза безводных нитратов металлов (Сu, Ag, Zn, Cd, Hg, Mn, Co, In и др.) Его самоионизация может протекать как с образованием катионов нитрония:
так и с образованием катионов нитрозила:
В смеси с донорными растворителями, такими как этилацетат, диэтиловый эфир, ацетонитрил, диметилсульфоксид, диссоциация протекает исключительно по второму пути, так как катион нитрозила стабилизируется электронной парой растворителя:
Для синтеза нитратов используют либо сами металлы, либо их безводные галогениды. Обычно синтез проводят в смеси N2O4 и этилацетата СН3СООС2Н5 (для предупреждения возможного взрыва этилацетат должен быть тщательно очищен от перекисных соединений перегонкой):
Образующийся сольват представляет собой комплексную соль нитрозония ([Zn(NO3)2·2N204] ≡ (NO)2[Zn(NO3)4], [Cu(NO3)2 · N2O4] ≡ (NO)[Cu(NO3)3]). Путем осторожного нагревания в вакууме его превращают в безводный нитрат.
Другим методом получения безводных нитратов является взаимодействие хлорида или карбонила металла с азотным ангидридом:
Так получают нитраты с ковалентным типом связи, неустойчивые в водных растворах.
Нитраты применяют во многих отраслях промышленности. Аммония нитрат (аммиачная селитра) – основное азотсодержащее удобрение; в качестве удобрений используют также нитраты щелочных металлов и Са. Нитраты – компоненты ракетных топлив, пиротехнических составов, травильных растворов при крашении тканей; их используют для закалки металлов, консервации пищевых продуктов, как лекарственные средства и для получения оксидов металлов. [8, p. 72-142]
Селитры – нитраты (азотнокислые соли) щелочных и щёлочноземельных металлов и аммония. Термин «селитра» происходит от позднелатинского sal nitri (лат. sal — соль и nitrum — щёлочь, природная сода, иногда поташ). В природе Селитры образуются при разложении различных органических остатков под действием нитрифицирующих бактерий.
Аммония нитрат (аммиачная селитра) NH4NO3, бесцветные гигроскопичные кристаллы; tпл. – 169,6°С, tкип. – 235 °С. Сведения о кристаллических модификациях приведены в таблице.
Свойства кристаллических модификаций NH4NO3
| Модификация | Кристаллич. решетка | Область существования | Параметры решетки, нм | ||
| a | b | C | |||
| I | Кубич. | 125,8-169,6 | 0,441 | ||
| II | Тетрагон. | 84,2-125,8 | 0,576 | — | 0,502 |
| III | Ромбич. | 32,2-84,2 | 0,718 | 0,771 | 0,583 |
| IV | Ромбич. | 32,2 -16,9 | 0,494 | 0,544 | 0,575 |
| V | Тетрагон. | Ниже -16,9 | 0,572 | — | 1,6 |
Растворимость аммония нитрата (г. в 100 г. растворителя): в воде –119 (0°С), 212 (25°С), 346 (50°С); жидком NH3 – 391 (25 °С). Растворяется также в метаноле, этаноле, пиридине.
При 200 — 270°С разлагается:
Выше 270°С или при воздействии удара может разлагаться со взрывом:
Аммония нитрат обычно получают нейтрализацией 60%-ной HNO3 газообразным NH3 с использованием теплоты реакции (145 кДж/моль) для упаривания раствора NH4NO3. Образующийся аммония нитрат гранулируют. Для получения прочных гранул, обеспечивающих возможность бестарных перевозок, и повышения срока хранения в аммония нитрат вводят (NH4)2SO4, Mg(NO3)2 или смесь (NH4)2SO4 с NH4H2PO4 (обычно не более 0,5% по массе). Мощность агрегатов по производству аммония нитрата до 450-520 тыс.т/год.
Аммония нитрат – азотное удобрение. Его применяют также в производстве взрывчатых веществ (напр., аммонитов, гранулитов), как реагент для растворения циркониевых оболочек твэлов при регенерации облученного ядерного топлива. Мировое производство 14 млн. т/год в пересчете на азот (1980). Аммония нитрат впервые был получен И.Р. Глаубером в 1659. [9;10, c. 27 – 39]
4.2 Нитрат натрия
Натрия нитрат (натриевая селитра, чилийская селитра) NaNO3, бесцветные кристаллы;tпл. – 306,6 °С; плотность – 2,26 г/см 3 ;
Выше 380 °С начинает разлагаться:
Растворимость (г. в 100 г.): в воде – 72,7 (0°С), 87,6 (20°С), 124,7 (60°С), 176 (100°С); при 25 °С в этаноле – 0,036, метаноле – 0,41, пиридине – 0,35; tкип насыщного водного раствора 119°С.
В природе нитрат натрия встречается в виде минерала чилийской селитры (нитронатрит).
Получают натрия нитрат поглощением нитрозных газов (смесь NO и NO2) раствором Na2CO3 или NaOH либо обменным взаимодействием Ca(NO3)2 с Na2SO4, а также из природных залежей методами противоточной кристаллизации и выщелачивания.
Применяют как удобрение, в производстве металлообрабатывающей промышленности, теплоаккумулирующих составов, окислитель в взрывчатых веществах, в ракетных топливах, пиротехнических составах, в производстве стекла, как компонент жидких солевых хладагентов (селитряной смеси), консервант пищевых продуктов.
4.3 Нитрат калия
Калия нитрат (калийная селитра) KNO3, бесцветные кристаллы; t пл – 334,5°С; Выше температуры плавления разлагается с выделением О2 сначала до KNO2, а затем до К2О. Смеси калия нитрата с органическими веществами легко воспламеняются и горят. Растворимость в воде (г. в 100г.): 31,6 (20°С), 243,6 (100 °С);t кип насыщенного водного раствора 18°С.
В природе нитрат калия образуется при разложении органических веществ в результате жизнедеятельности нитрифицирующих бактерий.
Получают нитрат калия обменной реакцией между КСl и NaNO3 или же при действии HNO3 или нитрозных газов (в основном NO2) на К2СО3 или КСl. Применяют как удобрение, а также для изготовления черного пороха и пиротехнических составов, в производстве спичек, стекла, для консервирования мясных продуктов.
4.4 Нитрат кальция
Кальция нитрат (кальциевая селитра) Са(NО3)2, бесцветные кристаллы; tпл – 561 °С; плотность – 2,36 г/см 3 . При 500°С начинает разлагаться с выделением О2 и образованием сначала Ca(NO2)2, а затем СаО и NO2. Растворимость в воде (г. в 100 г.): 128,8 (20 °С), 359 (51,6°С); tкип. насыщенного раствора 151 °С. Безводный нитрат кальция кристаллизуется из раствора выше 51,6°С, в интервале от -28,7 до 42,7 °С кристаллизуется тетрагидрат – бесцветные кристаллы; tпл – 42,7 °С; Известны также дигидрат и тригидрат. Кальция нитрат и его кристаллогидраты гигроскопичны.
Получают кальция нитрат действием HNO3 на известняк или поглощением нитрозных газов (в основном NO2) известковым молоком.
- Применяют кальция нитрат как азотное удобрение и для получения особо чистого СаО. [11, c. 1210-1216]
4.5 Нитрат бария
Бария нитрат (бариевая селитра) Ba(NO3)2, бесцветные кристаллы; t пл. – 595°С (с разложением); плотность – 3,24 г/см 3 ; Диамагнитен ( — 0,254*103). Растворимость в воде (г. на 100 г.): 5,0 (0°С), 9,2 (20°С), 34,2 (100°С); в присутвии Ca(NO3)2 и СаС12 растворимость сильно снижается. В спирте и концентрированной HNO3 практически не растворяется. С нитратами Cs, Li, NH4 + , Na, Rb, T1(I), BaBr2, Ba(NO2)2 образует эвтектичные смеси, с нитратами Со и Sr – непрерывный ряд твердых растворов. С KNO3 дает Ba(NO3)2·2KNO3. Выше 595 o С превращается в Ba(NO2)2, которыйрый около 670 °С разлагается до ВаО.
Источник