- Фенилсалицилат
- Синтез фенил салицилата (салола) из салициловой кислоты
- Феноловый эфир салициловой кислоты как белый, кристаллизующийся пластинками ароматический порошок, слабогорького вкуса, почти не растворим в воде и глицерине, растворяется в 10 частях алкоголя, в хлороформе и жирных маслах. Методы получения порошка.
- Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
- Подобные документы
- Phenylii salicylfs
- Амиды салициловой кислоты. Эфиры кислоты салициловой
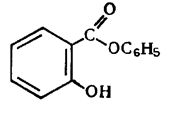
Фенилсалицилат
Phenylii salicylas
Фениловый эфир салициловой кислоты
| С13Н10О3 | М. в. 214,22 |
Получение. В 1886 году Ненцкий синтезировал салол. «Принцип салола» заключается во введении в организм раздражающих (салицилат – раздражающее, фенол — ядовитое) веществ в виде сложного эфира и сохранении нужных свойств – антисептических.
Описание. Белый кристаллический порошок или мелкие бесцветные кристаллы со слабым запахом.
Растворимость. Практически нерастворим в воде, растворим в спирте и растворах едких щелочей, легко растворим в хлороформе, очень легко — в эфире.
Подлинность.
1) Препарат растворяют в спирте и прибавляют каплю раствора хлорида окисного железа; появляется фиолетовое окрашивание (за счет фенольного гидроксила).
2) С реактивом Марки. К препарату добавляют концентрированную серную кислоту и воду; ощущается запах фенола. Затем добавляют формалин; появляется розовое окрашивание.
3) Препарат окисляют щелочью при нагревании, охлаждают и добавляют раствор серной кислоты, образуется осадок салициловой кислоты, запах фенола.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Синтез фенил салицилата (салола) из салициловой кислоты
Феноловый эфир салициловой кислоты как белый, кристаллизующийся пластинками ароматический порошок, слабогорького вкуса, почти не растворим в воде и глицерине, растворяется в 10 частях алкоголя, в хлороформе и жирных маслах. Методы получения порошка.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 10.06.2016 |
| Размер файла | 257,2 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Синтез фенил салицилата (салола) из салициловой кислоты
Феноловый эфир салициловой кислоты — белый, кристаллизующийся пластинками ароматический порошок, слабогорького вкуса, почти не растворим в воде и глицерине, растворяется в 10 частях алкоголя, в 0,3 эфира, в хлороформе и жирных маслах; плавится при 42-43° Ц кипит при 172-173 Ц . Воспринимая частицу воды, распадается на свои составные части (60% салициловой кислоты и 40% фенола). С. назначается внутрь как антисептическое вещество, против суставного ревматизма и как жаропонижающее большие дозы могут проявить ядовитые свойства.
Применение в медицине. При местном применении оказывает антисептическое, противовоспалительное и некоторое кератолитическое действие(отторжение эпидермиса). При приеме внутрь не изменяется в кислой среде желудка, а при попадании в щелочную среду верхних отделов кишечника распадается на фенол и салициловую кислоту. Фенол оказывает бактерицидное действие на патогенную микрофлору, а кислота салициловая оказывает противовоспалительное и жаропонижающее действие. Оба компонента могут всасываться из просвета кишечника в кровь и оказывать резорбтивное действие. Всосавшиеся в кровь фенол и салициловая кислота выделяются главным образом почками, большей частью в неизмененном виде, где также могут оказывать антибактериальное и противовоспалительное действие
1)Наиб. широко применяют этерификацию — взаимодействие спиртов с кислотами: RCOOH + R’OH = RCOOR’ + H2O. Это — обратимая р-ция, в к-рой положение равновесия зависит от природы и кол-ва к-ты и спирта и характеризуется равновесной концентрацией продуктов этерификации (т. наз. предел этерификации), напр. при эквимол. соотношении СН3СООН и C2H5OH равновесие устанавливается, когда
2/3 к-ты и спирта превращается в эфир. На скорость достижения предела этерификации влияют т-ра и катализаторы (сильные к-ты и их ангидриды, арилсульфоновые к-ты, кислые соли и кислые катионообменные смолы). Для повышения выхода воду из реакц. среды удаляют азеотропной дистилляцией. Легче всего этерифицируются первичные спирты, наиб. трудно — третичные.
(Азеотропная дистиляция- дистиляция при которой не меняется состав жидкости)
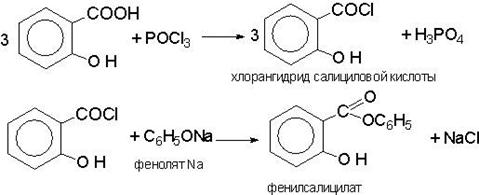
В частности данная реакция идет при сплавлении фенола и салициловой кислоты после чего при 120С через сплав пропускается оксохлорид фосфора POCL3
2)Другой распространенный способ получения салола — переэтерификация — замена одного спиртового или кислотного остатка в молекуле сложного эфира на другой. Осуществляют р-цию взаимодействия эфиров сложных со спиртами, карбоновыми к-тами или др. эфирами сложными в присут. алкоголятов, щелочей, НС1, BF3, солей нек-рых металлов, например
Равновесие смещают вправо путем отгонки более летучих спирта, к-ты или эфира. Метод используют для получения эфиров сложных, к-рые нельзя получить этерификацией, напр. виниловые или изопропиловые эфиры высших к-т.
Сложные эфиры образуются также кислотным алкоголизмом нитрилов (кат.- H2SO4, HC1, n-толуолсульфокислота; р-ция
алкилированием карбоксилат-анионов (к-т или их солей) алкилгалогенидами, алкенами в присут. Катализаторов не подходит для данного синтеза так как фенил неспособен присоединять галогены (2);
метиловые эфиры могут получаться реакцией кислот с диазометаном (4);
так же сложные эфиры могу получаться при взаимодействии минеральных кислот с альдегидами и спиртами но эти реакции не подходят по причине несоответствия классов продуктов реакции необходимым (5,6)
либо минер. к-т с олефинами (7).
Основным методом получения салола является метод этерификации так как является наиболее подходящим часто единственным, но обладает рядом недостатков, например требуется постоянная температура в 120 градусов цельсия, требуются катализаторы (сильные к-ты и их ангидриды, арилсульфоновые к-ты , кислые соли и кислые катионообменные смолы) и реакция идет в 2 стадии, воду отгоняют азеотропной дистилляцией.
Переэтерификация применяется в основном для получения более сложных эфиров которые невозможно получить этерификацией, к тому же она более затратна по причине необходимости отгонять из реактора более летучие вещества для сдвижения равновесия и требует катализаторов (алкоголятов, щелочей, НСL, BF3, солей нек-рых металлов)
У обеих этих реакций есть недостаток — они обратимы.
1. Учебник «органическая химия» Нейланд
2. Учебник «органическая химия» Петров,Бальян,Трощенко
3. Учебник Машковский М.Д. «Лекарства ХХ века». М.: Новая волна, 1998, 320 с
4. Учебник Дайсон Г., Мей П. «Химия синтетических лекарственных веществ». М.: Мир, 1964
5. Журнал «Московские аптеки», 1998, № 2
6. Учебник Weissman G. «Aspirin. Scientific American», 1991, v. 264, № 1
7. Практическое пособие “The practice of medicinal chemistry». Ed. by C. Wermuth. London: Acad. Press, 1995.
8. Сайт http://www.xumuk.ru/encyklopedia/2/5451.html
9. Сайт http://ru.wikipedia.org/wiki/Салициловая_кислота
Размещено на Allbest.ru
Подобные документы
Общая характеристика салициловой кислоты, ее основные физические и химические свойства, реагентность. Стадии и назначение производства салициловой кислоты. Особенности пиразолоновых противовоспалительных средств и других нестероидных препаратов.
реферат [184,7 K], добавлен 16.09.2008
Реакция получения анилина из нитробензола. Производство салициловой кислоты. Схема азосочетания диазотированной сульфаниловой кислоты с N,N-диметиланилином. Структурные формулы фурана и пиримидина. Таутомерные превращения барбитала; строение папаверина.
контрольная работа [451,5 K], добавлен 24.04.2013
Строение и схема получения малонового эфира. Синтез ацетоуксусного эфира из уксусной кислоты, его использование для образования различных кетонов. Таутомерные формы и производные барбитуровой кислоты. Восстановление a,b-Непредельных альдегидов и кетонов.
лекция [270,8 K], добавлен 03.02.2009
Свойства диэтилового эфира малеиновой кислоты. Практическое применение диэтилмалеата — использование в качестве органического растворителя. Методика синтеза. Дикарбоновые кислоты. Реакция этерификации. Механизм этерификации. Метод «меченых атомов».
курсовая работа [585,5 K], добавлен 17.01.2009
Применение акридонов и акридинов в фармакологии и медицине. Получение акридонуксусной кислоты циклизацией N-фенил-N-2-карбоксифенилглицина в среде концентрированной серной кислоты. Сульфокислоты акридона, полифосфорная кислота как реагент для циклизации.
дипломная работа [2,3 M], добавлен 11.04.2014
Источник
Phenylii salicylfs
Фенилсалицилат Фенилсалицилат
Фенилсалицилат (салол) является эфиром салициловой кислот и фенола. Впервые он был получен М В. Ненцким в 1886 г. Учитывая раздражающее действие салициловой кислоты, он стремился найти такой препарат, который бы, сохраняя антисептические свойства фенола,не обладал ядовитым свойством фенола и раздражающим действием кислоты. С этой целью он заблокировал карбоксильную группу в салициловой кислоте и получил эфир ее с фенолом. Исследования показали, что фенилсалицилат, проходя через желудок, не изменяется, а в щелочной среде кишечника омыляется с образованием натриевых солей салициловой кисты и фенола, которые и оказывают лечебное действие. Так как омыление происходит медленно, продукты омыления салола поступают в организм постепенно и не накапливаются в больших количествах, что обеспечивает более длительное действие препарата. Этот принцип введения в организм сильнодействующих веществ в виде их сложных эфиров вошел в литературу как «принцип салола» М. В. Ненцкого и использовался в дальнейшем для синтеза многих лекарственных препаратов.
Фенилсалицилат получают синтетически. Наиболее распространенным и общепринятым методом является следующий:
Полученный препарат очищают перекристаллизацией из спирта
Описание. Бесцветные кристаллы со слабым запахом. В воде нерастворимы. Растворимы в спирте, хлороформе и очень хорошо в эфире. За счет фенольного гидроксила растворяется в щелочах. Дает эвтектические смеси с камфарой, тимолом, ментолом. Имеет очень низкую температуру плавления (42-43 0 С).
1.1. На фенольный гидроксил. Реакцию проводят с раствором FeCI3— фиолетовое окрашивание.
1.2. С реактивом Марки, подобно другим фенолам, препарат дает красное окрашивание (ауриновый краситель)
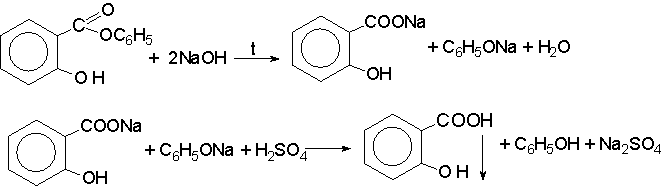
1.3. Фенилсалицилат при омылении образует салицилат натрия и фенолят, которые идентифицируются соответствующими реакциями.
Если после омыления смесь подкисляют, выделится свободная салициловая кислота в виде характерных игольчатых кристаллов. Кристаллы отфильтровывают и определяют температуру плавления.
Испытание на чистоту. Определяют отсутствие примесей салициловой кислоты, салицилата натрия, фенола и предельным содержанием (соответственно эталонам) примесей хлоридов, сульфатов, тяжелых металлов.
1.Метод омыления. В основе метода лежит реакция щелочного гидролиза. Навеску кипятят в колбе с обратным холодильником с определенным объемом стандартного раствора NaOH в течении определенного времени. После охлаждения реакционной смеси избыток NaOH оттитровывают стандартным раствором HCI (индикатор бромкрезоловый пурпуровый)
NaOH + HCI→ NaCI+ H2O
2. Метод броматометрии обратное титрование по продуктам омыления:
3. Метод ацидиметри по салицилату натрия, образующемуся после щелочного гидролиза.
После омыления препарата с индикатором метиловым красным нейтрализуют кислотой избыток не связавшейся щелочи (до ясно видимого розового цвета). Одновременно нейтрализуется и фенолят натрия, гидролизующийся в процессе титрования. Салицилат натрия далее титруется кислотой по метиловому оранжевому в присутствии эфира. Количество кислоты, пошедшее на титрование салицилата, пересчитывают на фенилсалицилат.
Применение. Применяется внутрь в порошках и таблетках при заболеваниях кишечника.
Хранение. В хорошо закупоренных банках, лучше из темного стекла.
Контрольные вопросы для закрепления:
1.Каким реактивом можно отличить фенилсалицилат от кислоты ацетилсалициловой?
2. Какой общий метод количественного определения фенилсалицилата и кислоты ацетилсалициловой?
3. Какие образуются продукты при кислотном гидролизе кислоты ацетилсалициловой?
Рекомендуемая литература
1. Глущенко Н.Н., Плетнева Т.В., Попков В.А. Фармацевтическая химия. М.: Академия, 2004.- 384 с. с. 221-228
2. Государственная фармакопея Российской Федерации/ Издательство «Научный центр экспертизы средств медицинского применения», 2008.-704с.:ил.
1. Государственная фармакопея 11 изд., вып. 1-М: Медицина, 1987. — 336 с.
2. Государственная фармакопея 11 изд., вып. 2-М: Медицина, 1989. — 400 с.
3. Беликов В. Г.Фармацевтическая химия. – 3-е изд., М., МЕДпресс-информ- 2009. 616 с:ил.
1. Фармацевтическая библиотека [Электронный ресурс].
2. Фармацевтические рефератики — Фармацевтический образовательный портал [Электронный ресурс]. URL: http://pharm-eferatiki.ru/pharmtechnology/
3. Компьютерное сопровождение лекции. Диск 1СD-RW.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Амиды салициловой кислоты. Эфиры кислоты салициловой
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Амиды салициловой кислоты. Эфиры кислоты салициловой
Амиды салициловой кислоты
Кислотные свойства
Салициламид и оксафенамид образуют соли со щелочами и солями тяжелых металлов. Препараты плохо растворимы в воде, поэтому их встряхивают в колбе в воде (салициламид) или растворяют в водно-спиртовом растворе (оксафенамид), затем добавляют раствор железа (III) хлорида.
Реакции электрофильного замещения
Являясь производными фенола, данные соединения вступают в реакции электрофильного замещения:
Гидролитическое расщепление
Амиды неустойчивы в кислой и щелочной среде — гидролизуются. При нагревании салициламида с 30 % раствором натрия гидроксида выделяется аммиак, который обнаруживают по изменению цвета красной лакмусовой бумаги.
Гидролиз оксафенамида проводят в среде кислоты хлороводородной концентрированной, продукт гидролиза n-аминофенол легко окисляется кислородом воздуха в щелочной среде до хинонимина. Продукт конденсации хинонимина с резорцином (индофенол) окрашен в красно-фиолетовый цвет:
Анализ чистоты
В оксафенамиде не должно быть примеси п-аминофенола, который обнаруживается по фиолетовой окраске индофенола. Предварительно примесь отделяют от препарата, который также образует индофенол. Примесь (в отличие от оксафенамида) растворяется в воде, в щелочной среде окисляется кислородом воздуха и при добавлении резорцина образует индофенол.
Количественное определение
Салициламид: кислотно-основное титрование в неводной среде (диметилформамид) с индикатором ализариновым желтым. В среде диметилформамида происходит депротонирование препарата:
Затем ионная пара взаимодействует с титрантом:
Для количественного определения оксафенамида используют метод Кьельдаля. Препарат сжигают в течение 3 ч с концентрированной H2SO4, азот препарата переходит в сульфат аммония, затем его вытесняют щелочью и улавливают кислотой борной. Аммонийную соль борной кислоты оттитровывают кислотой хлороводородной:
Индикатор – метиловый оранжевый.
Оксафенамид в таблетках определяют спектрофотометрически по реакции с железа (III) хлоридом.
Эфиры кислоты салициловой
Кислотные свойства
Фенилсалицилат и кислота ацетилсалициловая образуют соли со щелочами. Кроме того, кислота ацетилсалициловая (в отличие от фенилсалинилата) взаимодействует с натрия гидрокарбонатом за счет наличия в ее структуре свободной карбоксильной групы, но не образует комплекс с железа (III) хлоридом.
Фенилсалицилат плохо растворим в воде, поэтому его растворяют в водно-спиртовом растворе, а затем добавляют раствор железа (III) хлорида. Комплекс окрашен в фиолетовый цвет.
Гидролитическое разложение
Известно, что данные соединения легко подвергаются гидролизу под действием кислот, щелочей и воды. Образующиеся после гидролиза вещества открываются соответствующими реакциями.
Например, обнаружение кислоты салициловой осуществляют после гидролиза по образованию комплекса фиолетового цвета с железа (III) хлоридом и арилметанового красителя (красного цвета):
Наиболее лабильна сложноэфирная группа у кислоты ацетилсалициловой, поэтому необходимы особые предосторожности как при количественном определении, так и при хранении.
Анализ чистоты
В фенилсалицилате не должно быть примеси кислоты салициловой, натрия салицилата, фенола. Препарат встряхивают с водой, примеси растворяются в воде и при добавлении раствора железа (III) хлорида раствор окрашивается в фиолетовый цвет.
Регламентируется содержание кислоты салициловой в кислоте ацетилсалициловой. Препарат растворяют в спирте (для предотвращения гидролиза сложноэфирной группы), добавляют железо-аммонийные квасцы и измеряют оптическую плотность при длине волны λ = 520 нм. Содержание примесей не должно превышать 0,05%.
Количественное определение
Общий метод для анализа фенилсалицилата и кислоты ацетилсалициловой — метод нейтрализации (обратный способ). В течение 1,5 ч проводят щелочной гидролиз сложного эфира:
Избыток титрованного раствора щелочи, натрия фенолята, ди- натриевой соли салициловой кислоты оттитровывают кислотой хлороводородной по индикатору брокрезоловому пурпурному. Изменение окраски индикатора происходит при переходе динатриевой соли салицилата в мононатриевую соль (pH — нейтральная):
Для кислоты ацетилсалициловой ГФ предлагает прямой способ метода нейтрализации. Предотвращая гидролиз, препарат растворяют в спирте, определение проводят при 8—10 °С:
Источник