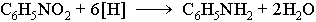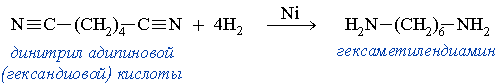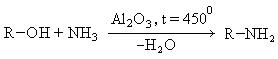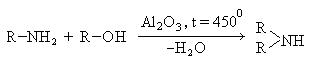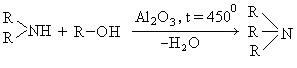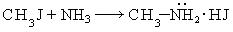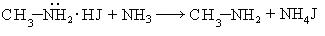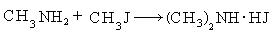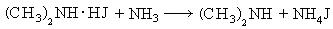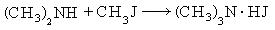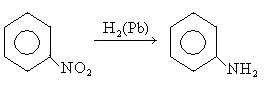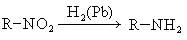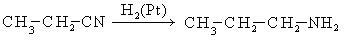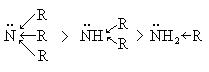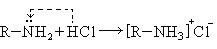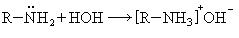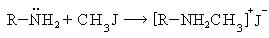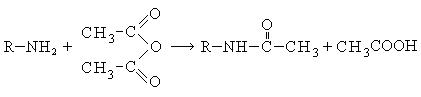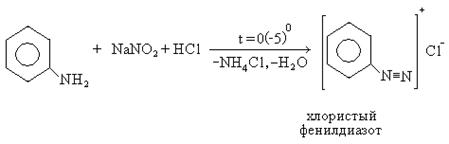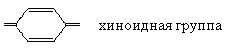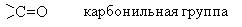- Характерные химические свойства азотсодержащих органических соединений. Важнейшие способы получения аминов и аминокислот
- Содержание:
- Амины
- Способы получения аминов
- Химические реакции аминов
- Аминокислоты
- Способы получения аминокислот
- Химические свойства аминокислот
- Промышленный способ получения аминов
- Способы получения аминов
Характерные химические свойства азотсодержащих органических соединений. Важнейшие способы получения аминов и аминокислот
Содержание:
Азотсодержащие соединения – это молекулы, имеющие в строении атомы азота. С помощью инертного газа образуются различные классы органических соединений:
- амины (R-NH2);
- аминокислоты (H2N-R-COOH);
- нитрилы (R-CN);
- нитросоединения (R-NO2);
- нитрозосоединения (R-NO) и т.д.
Амины
Амины – аммиачные производные, которые рассматриваются как замещенный продукт водородных атомов на органические радикалы (R).
У аминов так же как и в растворе аммиака проявляются слабые основные свойства. Классифицируются по числу катионов водорода, которые заместили, на:
Амины разделяют по характеру органических заместителей:
- предельные – молекулы без ароматических колец и кратных связей;
- непредельные – в молекулах присутствуют ароматические кольца и кратные связи.
В азоте амина находится внешняя электронная пара, за счет которой способен проявлять себя как основание. Но существуют ионы, являющиеся продуктами замещения на радикал всех водородных атомов – NH4 + .
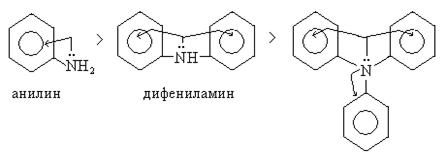
Когда аминогруппа в ароматических аминах связана с ароматическим ядром, то амины являются более слабыми снованиями по сравнению с аммиаком. Так как неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца, таким образом электронная плотность на атоме азота снижается. Бензольное ядро, обладающее большей энергией ионизации, оттягивает на себя электронную плотность молекулы. В результате основные свойства снижаются в реакциях, например взаимодействия с водой. Так, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Способы получения аминов
Амины сохраняют многие особенности аммиака – запах, растворимость в воде, сильные основные свойства.
- Реакция Гофмана (алкилирование аммиака и его производных)
- R-Hal + NH3 → R-NH2 + HHal
- R-Hal + R ’ -NH2 + NH3 → R-NH-R ’ + NH4Hal
- R-Hal + R-NH-R → N-(R)3 + NH4Hal
- Взаимодействие непредельных аминов со спиртами – способ получения вторичных аминов
- С6H5-NH2 + CH3-OH → С6H5-NH-CH3 + H2O
- Пропускание паров спирта и аммиака над катализатором оксида алюминия при температуре в 30°C
- R-OH + NH3 → R-NH2 + H2O
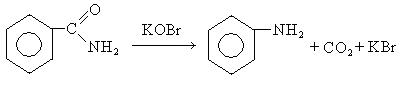
- Расщепление амидов при взаимодействии с гипохлоридом калия
- R-CONH2 + KBrO → R-NH2 + Cl2 + KBr
- Восстановление нитросоединений в присутствии катализатора в виде никеля, палладия – способ получения первичных аминов
- R-NO2 + H2 → R-NH2 + H2O
Химические реакции аминов
Химические свойства определяются реакционными центрами (РЦ):
- первый РЦ, представляющий собой неподеленную пару электронов на азоте;
- второй РЦ, определяющийся полярностью связи N-H;
- третий РЦ – это бензольное кольцо.
У непредельных аминов роль первого РЦ незначительна, т.к. ароматическое кольцо смещает на себя плотность и неподеленная пара электронов азота в проявлении основных свойств не принимает участия.
I. Основные свойства
Атом азота в амине принимает участие в образовании ковалентной связи, выступая как донор, благодаря внешней паре электронов. Т.о. амины присоединяют катион водорода и проявлять свойства основания.
По сравнению с основностью аммиака, амин проявляет большие основные свойства. Это связано с тем, что индуктивный эффект направлен на аминогруппу и азот становится более активным, т.е. прочнее связывает протон.
Степень проявления основных свойств зависит от величины частичного отрицательного заряда на азоте. Чем он выше, тем сильнее основные свойства.
Предельные первичные амины реагируют с азотистой кислотой с образованием спиртов, азота N2 и воды. Например:
- Признаком этой реакции — выделение азота.
- Реакция является качественной на первичные амины .
- Реакцию проводят поэтапно:
- смешивают амин с раствором соли азотистой кислоты (нитрита)
- добавляют к этой смеси сильную минеральную кислоту. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая потом реагирует с амином:
- R – NH2+ KNO2 + HCl = R – OH + N2 + KCl + H2O
Вторичные амины дают при похожих условиях маслянистые жидкости с характерным запахом, поэтому и название N-нитрозаминами.
Третичные амины с азотистой кислотой не взаимодействуют.
Сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
II. Слабые кислотные свойства
Первичным и вторичным аминам характерен разрыв связи N-H и замещение атома водорода на другие функциональные группы.
- Взаимодействия с металлами
- R-NH2 + Na → R-NH-Na + H2
- Алкилирование (реакция Гофмана) под действием катализатора в виде аммиака
- R-NH2 + R’-Hal → R-NH-R’ + HHal
- Ацилирование
- CH3-COCl + CH3-NH2 → CH3-NH-CO-CH3 + HHal
III. Качественная реакция на амины
Она осуществляется с помощью азотистой кислоты, которую необходимо получить непосредственно в момент реакции.
Амины широко применяют в фармакологической промышленности в препаратах с упрощенной адреналиновой структурой, а также в строительной отрасли в качестве компонента полимерных материалов.
Аминокислоты
Аминокислоты – это органические вещества, которые включают в себя аминогруппу (-NH2) и карбоксигруппу (-COOH). Единая формула аминокислот – (NH2)xR(COOH)y, где x и y принимают значения больше одного.
Аминокислоты – это элементарная структура белков, из которых состоят структуры животного тела. В состав белков входят только α-аминокислоты. На планете Земля 20 аминокислот, общая формула которых H2N-CH(R)-COOH. Эта двадцатка содержит в себе радикалы – углеводородные, кислородсодержащие, серосодержащие, азотсодержащие и ароматические.
Способы получения аминокислот
Аминокислоты – это бесцветные кристаллы, плавящиеся при 200°C. Они способны растворяться в воде, но нерастворимы в эфирах.
- Взаимодействие α-галогенпроизводных карбоновых кислот с аммиачным раствором (действие температур)
- Cl-R-COOH + NH3 → H2N-R-COOH + HCl
- Воздействие аммиака и цианистого водорода на альдегиды и кетоны
- R-CHO + NH3 → R-CH=NH + H2O
- R-CH=NH + HCN → R-CH(NH2)-CN
- R-CH(NH2)-CN + 2H2O → R-CH(NH2)-COOH + NH3
- Взаимодействие белка с водой при добавлении кислоты
- [-HN-CH(R)-C(O)-NH-CH(R’)-C(O)-]n + HOH → H2N-CH(R)-COOH + H2N-CH(R’)-COOH
- Добывание аминокислот клеточными организмами
Микроорганизмы при нарушении нормальной жизнедеятельности начинают синтезировать аминокислоту, вместо того, чтобы накапливать белок.
Химические свойства аминокислот
В составе аминокислот две функциональные группы, поэтому с одной группой веществ они ведут себя как амины, с другой как карбоновые кислоты, а с третьей – проявляют все свойства сразу.
I. Карбоксильная группа – ее химические реакции
Многие химические свойства, характерные для спиртов, встречаются и у аминокислот. Реакции задействуют только группу –COOH.
- Кислотные свойства
- Особые взаимодействия
- H2N-CH(R)-COOH + R’-OH → H2N-CH(R)-COOR’ + H2O2. Особые взаимодействия
- H2N-CH(R)-COOH + SOCl2 → H2N-CH(R)-COCl + SO2 + HCl
- Реакция с аммиаком
- H2N-CH(R)-COOH + NH3 → H2N-CH(R)-CONH2 + H2O
- Элиминирование молекулы диоксида углерода (под действием температур)
- H2N-CH(R)-COOH → H2N-CH2-R + CO2
II. Аминогруппа – ее химические реакции
Многие химические свойства, характерные для аминов, встречаются и у аминокислот. Реакции задействуют только группу ––NH2.
- Реакции с кислотами
- H2N-CH(R)-COOH + HCl → [H3N + -CH(R)-COOH]Cl —
- Введение ацила в аминокислоту
- H2N-CH(R)-COOH + CH3-COCl → CH3-C(O)-NH-CH(R)-COOH + HCl
- Введение алкильного остатка в состав аминокислоты
- H2N-CH(R)-COOH + 2СH3J → (CH3)2-N(R)-CH(R)-COOH + 2HJ
- Отщепление аминогруппы от аминокислоты под действием температур
- COOH-CH2-CH(NH2)-COOH → COOH-CH2-CH2-COOH + NH3
III. Реакции по обеим группам
Ряд химических свойств связан с действием реактивов на все функциональные группы.
- Синтез комплексных солей
- Нагревание β-аминокислот
- H2N-CH2-CH2-COOH → CH2=CH-COONH4 + H2O
- Нагревание γ и δ-аминокислот
Аминокислоты – это звенья, из которых составляются нити белка. Из них строятся живые ткани на планете. Почти все аминокислоты организм использует для построения органики тела. Некоторые играют роль медиаторов в нервных импульсах, другие используются в химической промышленности для проведения синтезов, третьи – в пищевой отрасли.
Источник
Промышленный способ получения аминов
2.5. Получение аминов
В аминах атом азота находится в низшей степени окисления, поэтому многие способы их получения основаны на процессах восстановления азотсодержащих соединений других классов (нитропроизводных углеводородов, амидов, нитрилов).
- Наиболее общим методом получения первичных аминов является восстановление нитросоединений:

Важнейший ароматический амин — анилин — образуется при восстановлении нитробензола (восстановители — водород в присутствии металлических катализаторов, Fe + HCl, сульфиды):
Эта реакция носит имя русского химика Н.Н. Зинина, осуществившего ее впервые

R-C
Этим способом в промышленности получают гексаметилендиамин, который используется в производстве полиамидного волокна найлон.
В основе этих превращений лежит реакция нуклеофильного замещения галогена в галогеналканах. Роль нуклеофила играют молекулы аммиака и аминов, имеющие неподеленную пару электронов на атоме азота.
В промышленности алкилирование аммиака в большинстве случаев проводится не галогеналканами, а спиртами, в молекулах которых происходит нуклеофильное замещение ОН-группы на аминогруппу.
Действием галогеналканов на первичные алифатические и ароматические амины получают вторичные и третичные амины, в том числе, смешанные. 
Источник
Способы получения аминов



1. Синтез из спиртов. Пропусканием паров спирта и аммиака при 400 0 С над катализатором получают смесь первичных, вторичных и третичных спиртов:
2. Реакция Гофмана. Действие аммиака на галогенпроизводные позволяет получить смесь солей различных аминов:
3. Реакция Зинина. Нитросоединения восстанавливаются водородом в присутствии катализатора:
4. Восстановление нитрилов:
5. Синтез из амидов кислот:
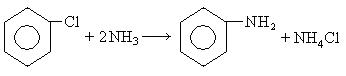
6. Взаимодействие хлорбензола с аммиаком:
Кислотно-основные свойства аминов. Амины обладают ярко выраженными основными свойствами. Это типичные основания по теории Бренстеда, согласно которой к основаниям относятся структуры, склонные присоединять протон. В ряду алифатических аминов более ярко выражены основные свойства у третичного амина, что объясняется донорным индукционным эффектом алкильных групп (R), что увеличивает электронную плотность на азоте и способность азота присоединять протон выражена ярче.
В ряду ароматических аминов более ярко выраженными основными свойствами обладает анилин и соблюдается следующая последовательность:
Химические свойства.В химическом отношении амины очень сходны с аммиаком и вступают в различные реакциии, как нуклеофильные реагенты. Типичными реакциями аминов являются реакции по аминогруппе.
1. Присоединение хлороводорода:
2. Присоединение воды:
4. Реакция ацелирования:
5. Реакция диазотирования:
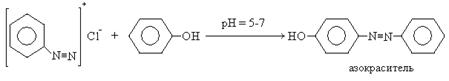
Охлажденные растворы диазосолей используются для получения азокрасителей. В качестве азосоставляющей в реакциях азосочетания используются фенолы или ароматические амины.
Реакцию азосочетания можно рассматривать как реакцию электрофильного замещения в ароматическом бензольном кольце. Электрофильной частицей выступает диазокатион и замещение идет преимущественно в пара-положение.
Полученный продукт является красителем. Красителями называют органические соединения, обладающие окраской и способные окрашивать различные ткани. Красители должны обязательно содержать в своем составе хромоформные группы:
и иметь высокую степень сопряжения в молекуле.
Для того, чтобы краситель связывался с тканью, в его составе должны быть ауксохромные группы: OH, NH2, СН3.
Существуют различные способы крашения тканей. При ледяном крашении ткань пропитывают азосоставляющей (фенол, амин), а рисунок наносят ледяным раствором соли диазония, то есть реакция азосочетания протекает на самой ткани.
6. Отношение аминов к азотистой кислоте (качественные реакции на алифатические амины). Первичные амины реагируют с выделением азота и образованием спирта. Вторичные амины реагируют с азотистой кислотой с образованием нитрозоаминов. Третичные амины в реакцию не вступают.
Источник