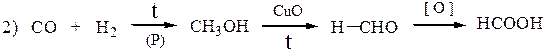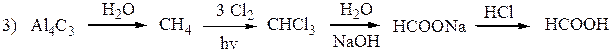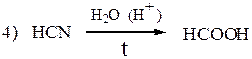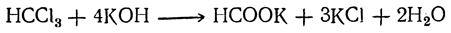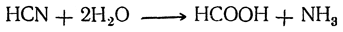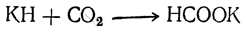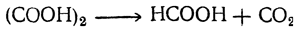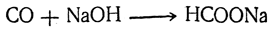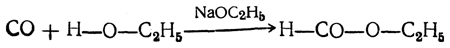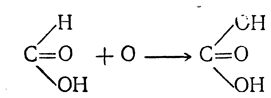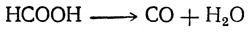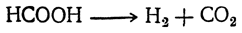Отдельные представители
Муравьиная кислота.Промышленные методы получения муравьиной кислоты:
· каталитическое окисление метана:
· нагревание оксида углерода (II) с гидроксидом натрия (p; 200 0 C):
СО + NaОН ¾¾® 2 Н–СООNa
· другие методы получения:
Муравьиная кислота имеет ряд особенностей, отличающих ее от других предельных одноосновных карбоновых кислот. Она может проявлять свойства альдегидов: окисляется (реакция серебряного зеркала, с жидкостью Фелинга), реагирует с HCN и вступает в другие реакции AN по карбонильной группе, в реакцию Канниццаро, разлагается при нагревании с Н2SО4 до СО и Н2О. Для обнаружения муравьиной кислоты среди других карбоновых кислот обычно используют реакцию серебряного зеркала или способность обесцвечивать фиолетовый раствор перманганата калия:
Муравьиная кислота находит применение в медицине, пчеловодстве, органическом синтезе, при получении растворителей, консервантов; используется в качестве сильного восстановителя.
Уксусная кислота. Промышленные методы получения уксусной кислоты:
· каталитическое окисление бутана
· нагревание cмеси оксида углерода (II) и метанола в присутствии катализатора под давлением
Уксусная кислота применяется в пищевой и химической промышленности.
Источник
Муравьиная кислота
Муравьиная кислота НСООН была открыта еще в XVII столетии в едких выделениях муравьев. Она содержится также в жгучей крапиве.
Муравьиная кислота может быть получена всевозможными способами (аналогичными описанным выше общим способам) из различных простейших соединений углерода. Так, например, она получается из хлороформа действием разбавленной щелочи
В настоящее время единственным промышленным способом получения муравьиной кислоты является пропускание окиси углерода через нагретый едкий натр:
Пропусканием окиси углерода через нагретые спиртовые растворы алкоголятов получаются эфиры муравьиной кислоты по уравнению
Муравьиную кислоту в виде водного раствора можно получить из муравьинокислых солей перегонкой с разбавленной серной кислотой. Безводную кислоту не удается получить дробной перегонкой водных растворов, так как муравьиная кислота дает с водой постояннокипящую (при 107° С) смесь, содержащую 77,5% кислоты. Безводная кислота может быть получена или разложением сероводородом муравьинокислого свинца, или обезвоживанием водной кислоты при помощи безводной щавелевой кислоты.
Безводная муравьиная кислота — жидкость, обладающая крайне острым запахом.
Муравьиная кислота отличается от всех остальных жирных кислот тем, что карбоксильный углерод в ней соединен не с алкилом, а с атомом водорода. Поэтому ее можно рассматривать и как альдегид, в котором группа СНО соединена с гидроксилом. Подобно альдегидам муравьиная кислота может окисляться, образуя угольную кислоту
т. е. представляет собой как бы альдегид, соответствующий угольной кислоте.
Муравьиная кислота, как и альдегиды, является сильным восстановителем. Она может восстанавливать при нагревании соли окиси ртути до солей закиси и даже до металлической ртути, а также окись серебра до металлического серебра, вследствие чего серебряная соль муравьиной кислоты легко разлагается с выделением серебра.
При нагревании с концентрированной серной кислотой муравьиная кислота распадается на окись углерода и воду:
Эта реакция может быть использована для получения чистой окиси углерода.
В присутствии порошкообразного иридия или родия муравьиная кислота распадается на водород и двуокись углерода:
При быстром нагревании муравьинокислого натрия до 400° С выделяется водород и образуется щавелевокислый натрий:
Муравьиная кислота находит довольно значительное применение как восстановитель, а также используется при крашении тканей; 1,25%-ный водный раствор ее употребляется в медицине («муравьиный спирт», или spiritus formicarum).
Источник
Муравьиная кислота
| Муравьиная кислота | |
|---|---|
 | |
 | |
| Систематическое наименование | Метановая кислота |
| Традиционные названия | Муравьиная кислота |
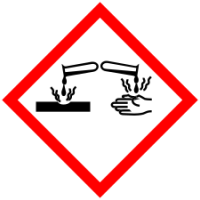
| Хим. формула | CH₂O₂ |
| Рац. формула | HCOOH |
| Состояние | Жидкость |
| Молярная масса | 46,025380 г/моль |
| Плотность | 1,2196 г/см³ |
| Динамическая вязкость | 0,16 Па·с |
| Энергия ионизации | 11,05 ± 0,01 эВ |
| Т. плав. | 8,25 °C |
| Т. кип. | 100,7 °C |
| Т. всп. | 60 °C |
| Т. свспл. | 520 °C |
| Пр. взрв. | 18 ± 1 об.% |
| Тройная точка | 281,40 K (8,25 °C), 2,2 кПа |
| Кр. точка | 588 K (315 °C), 5,81 МПа |
| Мол. теплоёмк. | 98,74 Дж/(моль·К) |
| Энтальпия образования | −409,19 кДж/моль |
| Давление пара | 120 мм. рт. ст. (16 кПа) при 50 °C |
| pKa | 3,75 |
| Показатель преломления | 1,3714 |
| Дипольный момент | 1,41 (газ) Д |
| ГОСТ | ГОСТ 5848-73 ГОСТ 1706-78 |
| Рег. номер CAS | 64-18-6 |
| PubChem | 284 |
| Рег. номер EINECS | 200-579-1 |
| SMILES | |
| Рег. номер EC | 200-579-1 |
| Кодекс Алиментариус | E236 |
| RTECS | LQ4900000 |
| ChEBI | 30751 |
| ChemSpider | 278 |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Муравьиная кислота (систематическое наименование: метановая кислота) HCOOH — органическое соединение, первый представитель в ряду насыщенных одноосновных карбоновых кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236. Своё название муравьиная кислота получила потому, что впервые она была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв. В природе также обнаружена у пчёл, в крапиве, хвое. Соли и анионы муравьиной кислоты называются формиатами.
Содержание
Физические и химические свойства
При стандартных условиях муравьиная кислота представляет собой резко пахнущую бесцветную жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
Константа диссоциации: 1,772⋅10 −4 .
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается на воду и моноксид углерода:
Муравьиная кислота реагирует с аммиачным раствором оксида серебра:
Взаимодействие муравьиной кислоты с гидроксидом меди:
Проявляет все свойства одноосновных карбоновых кислот:
Образует формиаты с металлами:
Со спиртами образует сложные эфиры:
HCOOH + CH3OH → HCOOCH3 + H2O 
Получение
- Побочный продукт в производстве уксусной кислоты жидкофазным окислением бутана.
- Окисление метанола:
CH3OH → HCHO → HCOOH - Реакцией монооксида углерода с гидроксидом натрия:
NaOH + CO → HCOONa → (+H2SO4, −Na2SO4) HCOOH
Это основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6—0,8 МПа пропускают через нагретый до 120—130 °C гидроксид натрия; на второй стадии проводят обработку формиата натрия серной кислотой и вакуумную перегонку продукта. - Разложением глицериновых эфиров щавелевой кислоты. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя углекислый газ, при этом образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и глицерин.
Безопасность
Опасность муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10 % обладает раздражающим эффектом, больше 10 % — разъедающим.
При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Контакт с концентрированными парами муравьиной кислоты может привести к повреждению глаз и дыхательных путей. Случайное попадание внутрь даже разбавленных растворов вызывает явления тяжёлого некротического гастроэнтерита.
Муравьиная кислота быстро метаболизируется и выводится организмом. Тем не менее, муравьиная кислота и формальдегид, образующиеся при отравлении метанолом, вызывают повреждение зрительного нерва и ведут к слепоте.
По данным ПДК в воздухе рабочей зоны равна 1 мг/м 3 (максимально-разовая). Может попадать в организм при вдыхании. Порог восприятия запаха может достигать, например, 453 мг/м 3 . можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию муравьиной кислоты на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от неё следует использовать более эффективные изменение технологии и средства коллективной защиты.
Нахождение в природе
В природе муравьиная кислота обнаружена в хвое, крапиве, фруктах, едких выделениях медуз, пчёл и муравьёв. Муравьиная кислота впервые была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв, чем и объясняется её название.
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении бутана и лёгкой бензиновой фракции в производстве уксусной кислоты. Муравьиную кислоту получают также гидролизом формамида (
35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование метанола, взаимодействие метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида 75%-ной H2SO4. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию СО в присутствии щёлочи (кислоту выделяют из соли действием H2SO4), дегидрогенизацию CH3OH в паровой фазе в присутствии катализаторов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения).
Применение
В основном, муравьиную кислоту используют как консервирующий и антибактериальный агент при заготовке корма. Муравьиная кислота замедляет процессы гниения и распада, поэтому сено и силос, обработанные муравьиной кислотой, дольше сохраняются. Муравьиная кислота также используется в протравном крашении шерсти, для борьбы с паразитами в пчеловодстве, как растворитель в некоторых химических реакциях.
В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5, для получения монооксида углерода.
В медицине используется для приготовления растворов пермуравьиной кислоты («первомур», или рецептура «С-4» (смесь перекиси водорода и муравьиной кислоты)). Первомур используют в хирургии в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования.
Производные муравьиной кислоты
Соли и эфиры муравьиной кислоты называют формиатами.
Источник