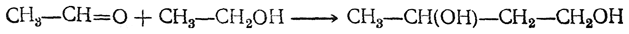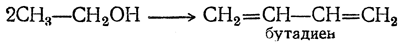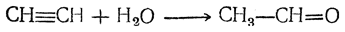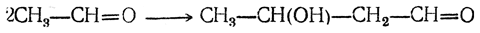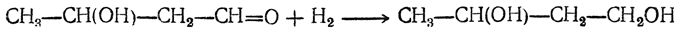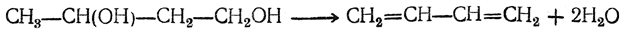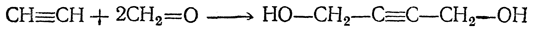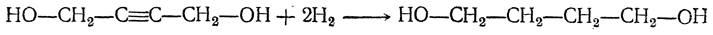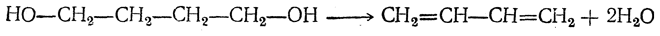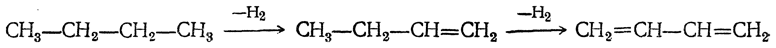- Получение алкадиенов
- Получение алкадиенов
- 1. Дегидрирование алканов
- 2. Синтез Лебедева
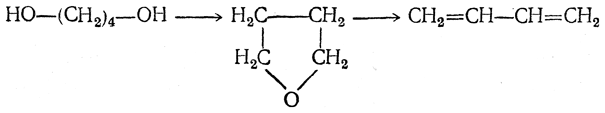
- 3. Дегидратация двухатомных спиртов
- 4. Дегидрогалогенирование дигалогеналканов
- Бутадиен-1,3, или дивинил
- Производство бутадиена-1,3 (дивинила)
- Физико-химические свойства бутадиена-1,3, основные промышленные способы производства. Технологическая схема одностадийного дегидрирования н-бутана до бутадиена-1,3. Устройство реактора дегидрирования. Предложения по улучшению качества бутадиена.
- Добыча нефти и газа
- Изучаем тонкости нефтегазового дела ВМЕСТЕ!
- Способы производства бутадиена-1,3 .Производство бутадиена двухстадийным дегидрированием n-бутана
Получение алкадиенов
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):

Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
Н агревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
Источник
Бутадиен-1,3, или дивинил
Бутадиен-1,3, или дивинил, СН2=СН—СН=СН2 представляет собой газ, конденсирующийся при —4,5° С. Вследствие громадного технического значения бутадиена-1,3 как одного из важнейших исходных мономеров для производства синтетических каучуков было разработано много способов его получения, в том числе и промышленных.
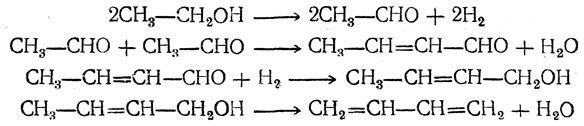
Бутадиен образуется при термическом разложении различных органических веществ; в небольших количествах содержится в газах, получаемых пиролизом нефтепродуктов и каменного угля. Он может быть получен пиролизом циклогексана и других углеводородов нефти, пиролизом циклогексанола, дегидратацией 1,3-бутиленгликоля, а также конденсацией альдегида и спирта в присутствии глинозема как катализатора (И. И. Остромысленский). В последнем случае, вероятно, промежуточно образуется 1,3-бутиленгликоль
который сразу же дегидратируется. Другой способ получения бутадиена из спирта состоит в окислении этанола в ацегальдегид, который конденсируют в альдоль; восстановление альдоля дает 1,3-бутиленгликоль.
Первым технически целесообразным путем получения бутадиена из спирта является способ С. В. Лебедева, впервые осуществленный в промышленных масштабах в СССР в 1932 г. и в дальнейшем получивший широкое распространение. По С. В. Лебедеву спирт непосредственно превращается в бутадиен при пропускании его паров при 400—500° С над катализатором, обладающим одновременно дегидрирующим и дегидратирующим действием. Суммарно процесс выражается уравнением
Вероятно, механизм этой реакции (М. Я. Каган, Ю. Д. Горин) таков:
Можно получать дивинил, в том числе и в промышленном масштабе, на основе ацетилена. Более старый метод синтеза из ацетилена может быть представлен следующей схемой:
Позднее был предложен следующий путь: 1. Получение 1,4-бутиндиола конденсацией ацетилена и формальдегида (с Сu2Сl2 в качестве катализатора):
2. Гидрирование 1,4-бутиндиола в 1,4-бутандиол:
3. Дегидратация 1,4-бутандиола в дивинил либо непосредственно
либо с промежуточным выделением тетрагидрофурана
В настоящее время самым эффективным методом получения дивинила является каталитическое дегидрирование природного бутана, а также бутиленов, содержащихся в газах термической переработки нефти. Реакция проводится над различными алюмо-хромовыми катализаторами при 500—650° С. В зависимости от применяемых катализаторов бутан может быть превращен в бутадиен либо сразу, либо в две стадии
причем для каждой стадии требуются свои катализаторы и условия реакции. Эти методы, разрабатывавшиеся одновременно в СССР и в США, в настоящее время осуществляются как промышленные.
Хлорпроизводное дивинила — 2-хлорбутадиен-1,3, или хлоропрен, СН2—СН—ССl=СН2 может быть получен присоединением молекулы хлористого водорода к винилацетилену, получаемому при пропускании ацетилена через солянокислые растворы медных солей. Хлоропрен — жидкость с характерным эфирным запахом, несколько напоминающим запах бромистого этила; т. кип. 59,4°С, относительная плотность 0,9533 (при 20°С). Подобно дивинилу, но значительно легче, хлоропрен полимеризуется в каучукоподобные вещества — синтетические каучуки, выпускаемые в СССР под названием наирит, а в США — под названием неопрен.
Полихлоропреновые каучуки обладают рядом ценных физико-химических свойств — стойкостью к атмосферным воздействиям, к солнечному свету, к различным маслам и химическим агентам, а также негорючестью, благодаря чему они нашли очень широкое применение.
Источник
Производство бутадиена-1,3 (дивинила)
Физико-химические свойства бутадиена-1,3, основные промышленные способы производства. Технологическая схема одностадийного дегидрирования н-бутана до бутадиена-1,3. Устройство реактора дегидрирования. Предложения по улучшению качества бутадиена.
| Рубрика | Химия |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 24.10.2011 |
Становление промышленного органического синтеза протекало в два этапа:
выделение органических соединений из природного растительного и животного сырья либо его использование в процессах ферментативного синтеза;
выделение органических веществ из каменноугольной смолы и организация на их основе промышленного производства (углехимический синтез);
выделение органических веществ из нефтяного сырья и организация промышленного производства на новой сырьевой базе (нефтехимический синтез).
Практически до середины 19 века органические вещества получали, в основном, путем ферментации из сельскохозяйственного сырья. Это такие продукты, как уксус, этиловый спирт, молочная и лимонная кислоты, глицерин, ацетон и др.
Огромную роль в становлении промышленного органического синтеза сыграли достижения и открытия химиков-синтетиков. Установление связи между строением вещества и его свойствами позволяло планировать синтез соединений, обладающих определенными потребительскими свойствами. С другой стороны, возрастала потребность развивающегося капитализма в увеличении производства органических продуктов, которые не могла обеспечить сельскохозяйственная сырьевая база.
Новым крупнотоннажным источником органических соединений стала каменноугольная смола-отход производства металлургического кокса. В 1820-1850 гг. в Германии началось изучение ее состава и поиск способов выделения из нее таких компонентов, как бензол и его гомологи, нафталин и т.д. Вначале было освоено промышленное получение синтетических красителей: ализарина, фуксина и индигоподобных веществ, ранее получаемых из растительного сырья. Параллельно было начато получение взрывчатых веществ нитрованием каменноугольных толуола (тол) и фенола (пикриновая кислота), а также положено начало выпуску таких лекарственных веществ, как аспирин, салол, фенацитин и др. Создание собственной углехимической промышленности в США, Англии, Франции и России относится к началу 20 века.
Современный промышленный органический синтез можно условно разделить на две группы производств. Первая группа включает основной (тяжелый) органический синтез. Это крупнотоннажные, как правило, непрерывные производства относительно более простых органических соединений, преимущественно используемых в качестве полупродуктов в более сложных синтезах. Процессы получения органических веществ многообразны и основаны на реакциях окисления-восстановления, гидрирования- дегидрирования, гидратации- дегидратации, этерификации, изомеризации, сульфирования, нитрования и т.д. Специфические особенности некоторых производств, основанных на использовании определенного вида сырья или типа реакций, важное значение этих производств в народном хозяйстве способствовали отделению от основного органического синтеза ряда самостоятельных отраслей. Примером могут послужить производства пластических масс, синтетических каучуков и химических волокон.
К продуктам основного органического синтеза относятся спирты, альдегиды, кетоны, карбоновые кислоты и их эфиры, галогенопроизводные и нитропроизводные алифатических и ароматических углеводородов; олефины, диены и др. важнейшими из них являются метанол, этанол, формальдегид, этилен, пропилен, бутадиен, изопрен, окиси этилена и пропилена, уксусный альдегид и уксусная кислота, фенол, анилин и т.д.
Мировое производство многих из этих продуктов превышает 1млн. т. в год.
Вторая группа производств промышленного органического синтеза относится к так называемому тонкому органическому синтезу. Это нередко периодические процессы, связанные с получением красителей, лекарственных и душистых веществ более сложной структуры, которые производятся в значительно меньших количествах и базируются на использовании полупродуктов, получаемых промышленностью основного органического синтеза.
Взаимосвязь основных сырьевых источников промышленности органического синтеза и направлений их использования может быть представлена схемой:
Нефть, уголь и газ как природные ископаемые составляют основу сырьевой базы промышленности органического синтеза. В процессе переработки этих природных ресурсов получают пять основных сырьевых групп: парафины, олефины, ацетилен, ароматические углеводороды и синтез-газ. Из этих источников сырья получают все многообразие продуктов, как основного, так и тонкого органического синтеза. Эти же источники поставляют сырье для ставших самостоятельными отраслей, производящих высокомолекулярные соединения, фармацевтические препараты, красители и т.п.
Разновидностью непредельных углеводородов являются диеновые углеводороды. Их свойства определяются их строением и взаимным расположением двух двойных связей в молекуле. Наибольшее значение имеют диены с сопряженными двойными связями. Они способны полимеризоваться и образовывать цепные полимерные материалы.
Диеновый синтез дает разнообразные соединения. Продуктами полимеризации диеновых углеводородов являются каучуки, имеющие огромное техническое значение (служат основой для производства разнообразных резиновых изделий). Для получения диеновых углеводородов используют попутные газы, газы пиролиза нефтепродуктов и т.п.
Организация данного химического производства имеет свои показатели, которые характеризуют его деятельность: производительность сил, нормативная трудоемкость, материальный баланс.
1. Теоретическая часть
1.1 Физико-химические свойства сырья
Бутан — бесцветный горючий газ. Растворимость в воде — 6.1 мг в 100 мл воды (для н-бутана, при 20 °C). Температура плавления 138.3 °C (134.9 K), Температура кипения 0.5 °C (272.7 K).
Фракция нормального бутана применяется в качестве сырья для получения бутадиена в производстве синтетического каучука (марки «высшая» и «А»), а также для пиролиза и других целей.
Транспортировка фракции нормального бутана производится в железнодорожных вагонах-цистернах, предназначенных для перевозки сжиженных газов или по трубопроводу. Перевозка фракции нормального бутана железнодорожным транспортом осуществляется в соответствии с Правилами перевозок опасных грузов по железным дорогам.
Хранение фракции нормального бутана — по ГОСТ 1510 (аналогично газам углеводородным сжиженным топливным) и правилам устройства и безопасной эксплуатации сосудов, работающих под давлением, утвержденным Госгортехнадзором России с указанием манипуляционного знака «Боится нагрева» по ГОСТ 14192.
1.2 Физико-химические свойства бутадиена-1,3
Бутадиен-1,3 — СН2=СН-СН=СН2 (дивинил) — бесцветный газ с характерным неприятным запахом. Температура плавления — 108,90С, а температура кипения — 4,41оС.
Дивинил хорошо растворим в бензоле, эфире, хлороформе, плохо растворим в метаноле и этаноле. Растворимость дивинила в воде при нормальных условиях 0,09% по массе. С некоторыми растворителями образует азеотропные смеси.
Критическая температура бутадиена-1,3 152оС. С воздухом дивинил образует взрывчатые смеси с пределами воспламеняемости 2 и 11,5% об. Температура вспышки бутадиена составляет -40оС, а температура самовоспламенения 420оС.
Бутадиен легко полимеризуется и сополимеризуется со стиролом, нитрилами или эфирами акриловой и метакриловой кислот, изопреном и др.
Дивинил самопроизвольно димеризуется с образованием 4-винилциклогексана. В присутствии кислорода дивинил образует пероксиды, инициирующие его самопроизвольную полимеризацию.
Источник
Добыча нефти и газа
Изучаем тонкости нефтегазового дела ВМЕСТЕ!
Способы производства бутадиена-1,3 .Производство бутадиена двухстадийным дегидрированием n-бутана
Разработка процесса получения бутадиена двухстадийным дегидрированием n-бутана была гигантским скачком в развитии производства крупнотоннажного мономера БД.
Этой технологией занималась группа ученых и инженеров в Ярославском институте НИИМСК (ныне ОАО НИИ «Ярсинтез») под руководством В.М. Соболева и А.Н. Бушина. Вокруг них сплотились молодые инженеры, ставшие впоследствии известными учеными: С.А. Монозон, Г.Р. Котельников, Я. Кирнос, Б.А. Плечев, С.Ю.Павлов и др. На опытном заводе института были смонтированы и работали установки дегидрирования, разделения фракций углеводородов, выделения и очистки БД. После отработки процесса в целом Гипрокаучук спроектировал первое опытно-промышленное производство БД из n-бутана на Сумгаитском заводе СК мощностью 20 тыс. т БД в год.
Дегидрирование n-бутана является последовательной обратимой реакцией, на первой стадии образуется три изомерных n-бутена, которые при дальнейшем дегидрировании дают БД:
Основными побочными реакциями являются полимеризация БД и крекинг БД и бутенов.
В промышленности процесс дегидрирования ведут в присутствии катализаторов, что позволяет снизить температуру процесса. Реакция дегидрирования идет с поглощением тепла и увеличением объема, поэтому ее протеканию благоприятствуют высокие температуры и пониженное давление.
Дегидрирование проводят в определенном оптимальном интервале температур. Дальнейшее повышение температуры приводит к уменьшению выхода целевых продуктов из-за усиления вторичных реакций распада и «уплотнения». Реакции распада приводят к образованию углеводородов С1-С3, а реакции «уплотнения» к накоплению на поверхности катализатора пленки кокса, снижающей его активность. Поэтому необходима
периодическая регенерация катализатора — выжиг углеродистых отложений.
Процесс проводится в условиях, обеспечивающих максимальный выход n-бутенов и БД и минимальный выход побочных продуктов.
Дегидрирование осуществляется в две стадии с возвратом в реактор непрореагировавшего сырья.
Конструктивное оформление процессов определяется следующими основными моментами:
—необходимость подвода большого количества тепла в зону реакции;
—обеспечение высокой температуры и очень малого времени контакта;
— необходимость выжига кокса с поверхности катализатора;
— необходимость быстрого охлаждения продуктов реакции.
Преимуществом двухстадийного дегидрирования является
возможность создания на каждой стадии оптимальных условий, обеспечивающих максимальный выход n-бутенов и БД и максимальную селективность по этим продуктам.
Процесс состоит из следующих основных стадий (рис. 25):
1. Дегидрирование n-бутана до n-бутенов;
2. Разделение контактного газа первой стадии дегидрирования абсорбцией и ректификацией с выделением буташбутеновой фракции;
3. Разделение буташбутеновой фракции экстрактивной дистилляцией с возвратом n-бутана на первую стадию дегидрирования;
4. Дегидрирование n-бутенов до БД;
5. Разделение контактного газа второй стадии дегидрирования абсорбцией и ректификацией с выделением бутен-БД фракции;
6. Разделение бутен-БД фракции. Сюда же поступает бутеновая фракция с первой стадии дегидрирования для выделения содержащихся в ней небольших количеств БД. Смесь бутенов возвращается на дегидрирование. БД отправляется на последующую переработку.
Источник