- Азотная кислота
- Физические и химические свойства
- Получение
- Применение азотной кислоты
- Токсичность
- Азотная кислота: получение и химические свойства
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Производство азотной кислоты в промышленности: технология, стадии, особенности
- Промышленный выпуск азотной кислоты: история развития технологий
- Сырье для выпуска азотной кислоты
- Разновидности азотной кислоты и основные стадии ее выпуска
- Производство разбавленной кислоты по технологии АК-72
- Технология выпуска продукта под давлением 0,7 МПа: нюансы
- Производство концентрированной кислоты: прямой синтез
- Производство концентрированной кислоты на основе разбавленной
- Особенности концентрирования с помощью серной кислоты
- Концентрирование с помощью нитратов
- Применение катализаторов при выпуске азотной кислоты
- Основные проблемы в производстве азотной кислоты
Азотная кислота
Физические и химические свойства
Плотность безводной азотной кислоты ρ = 1522 кг/м 3 , температура плавления tпл— 41,15°С, температура кипения tкип 84° С.
С водой смешивается в любых отношениях с образованием азеотропной смеси с tкип = 121,8°C, содержащей 69,2% кислоты. Также существуют кристаллогидраты HNO3∙H2O с tпл -37,85°С и HNO3∙3H2O c tпл -18,5°С. В отсутствии воды азотная кислота неустойчива, разлагается на свету с выделением кислорода уже при обычных температурах (4HNO3 → 4NO2 + 2H2O + O2), причём выделяющейся двуокисью азота окрашивается в жёлтый цвет, а при высоких концентрациях NO2 — в красный.
Азотная кислота является сильным окислителем, окисляет серу до серной кислоты, фосфор — до фосфорной кислоты. Только золото, тантал и некоторые платиновые металлы не реагируют с азотной кислотой. С большинством металлов азотная кислота взаимодействует преимущественно с выделением окислов азота: ЗСu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O.
Некоторые металлы, например железо, хром, алюминий, легко растворяющиеся в разбавленной азотной кислоте, но устойчивы к воздействию концентрированной, что объясняется образованием на поверхности металла защитного слоя окисла. Такая особенность позволяет хранить и перевозить концентрированную азотную кислоту в стальных ёмкостях.
Смесь концентрированной азотной и соляной кислоты в отношении 1:3, называемая царской водкой, растворяет даже золото и платину. Органические соединения под действием азотной кислоты окисляются или нитруются, причём в последнем случае остаток (нитрогруппа NO2 + ) замещает в органических соединениях водород (происходит нитрование).
Получение
В 13 в. было описано получение азотной кислоты нагреванием калиевой селитры с квасцами, железным купоросом и глиной.
В середине 17 в. И. Р. Глаубер предложил получать азотную кислоту при умеренном (до 150°C) нагревании калиевой селитры с концентрированной серной кислотой: KNO3 + H2SO4 → HNO3 + KHSO4 До начала 20 в. этот способ применяли в промышленности, заменяя калиевую селитру более дешёвой природной чилийской селитрой NaNO3.
Современный способ производства азотной кислоты основан на каталитическом окислении аммиака кислородом воздуха. Основные стадии процесса:
- контактное окисление аммиака до окиси азота: 4NH3 + 5O2 → 4NO + 6H2O;
- окисление окиси азота до двуокиси и поглощение смеси «нитрозных газов» водой:
2NO + O2 → 2NO2
3NO2 + H2O → 2HNO3 + NO - смесь аммиака (10 — 12% ) с воздухом пропускают через нагретую до 750 — 900°С сетку катализатора, которым служат сплавы платины — тройной (93% Pt, 3% Rh, 4% Pd) или двойной (90 — 95% Pt, 10 — 5% Rh)
- окисление NO до NO2 и растворение NO2 в воде — может быть проведенj при атмосферном давлении, под давлением до 1 Мн/м 2 или комбинированным способом, при котором под давлением происходит только поглощение нитрозных газов водой
Получают азотную кислоту с концентрациями 45 — 49% или (при использовании давления) 55 — 58% . Дистилляцией таких растворов может быть получена азотная кислота азеотропного состава. Более концентрированную кислоту (до 100% ) получают перегонкой растворов азотной кислоты с концентрированной H2SO4 или прямым синтезом — взаимодействием N2O4 с водой (или разбавленной азотной кислотой) и кислородом: 2N2O4 + 2H2O + O2 → 4HNO3.
Применение азотной кислоты
Важнейшие области применения азотной кислоты — производство азотных и комбинированных удобрений, взрывчатых веществ (тринитротолуола и др.), органических красителей.
В органическом синтезе широко применяют смесь концентрированной азотной и серной кислоты — «нитрующую смесь».
Азотную кислоту используют в камерном способе производства серной кислоты, для получения фосфорной кислоты из фосфора, как окислитель ракетного топлива.
В металлургии азотую кислоту применяют для травления и растворения металлов, а также для разделения золота и серебра.
Токсичность
Вдыхание паров азотной кислоты приводит к отравлению, попадание кислоты (особенно концентрированной) на кожу вызывает ожоги. Предельно допустимое содержание азотной кислоты в воздухе промышленных помещений равно 50 мг/м 3 в пересчёте на N2O5.
Концентрированная азотная кислота при соприкосновении с органическими веществами вызывает пожары и взрывы.
Источник
Азотная кислота: получение и химические свойства
Строение молекулы и физические свойства
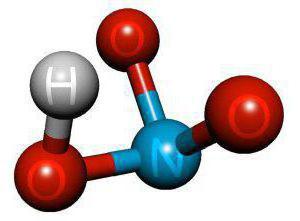
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например , концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
2. В промышленности азотную кислоту получают из аммиака . Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
Химические свойства
Азотная кислота – это сильная кислота . За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства .
1. Азотная кислота практически полностью диссоциирует в водном растворе.
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , азотная кислота взаимодействует с оксидом меди (II):
Еще пример : азотная кислота реагирует с гидроксидом натрия:
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например , азотная кислота взаимодействует с карбонатом натрия:
4. Азотная кислота частично разлагается при кипении или под действием света:
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
Таблица . Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например , азотная кислота окисляет серу, фосфор, углерод, йод:
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором . Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
7. Концентрированная а зотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например , азотная кислота окисляет оксид серы (IV):
Еще пример : азотная кислота окисляет иодоводород:
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например , сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
При нагревании до серной кислоты:
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция«).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.
Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Источник
Производство азотной кислоты в промышленности: технология, стадии, особенности


Азотная кислота — в числе самых востребованных типов промышленного сырья. Ее производство может осуществляться разными методами — в зависимости от того, в какой разновидности кислота должна поставляться заказчику. В чем заключается сущность соответствующих технологий? Каким образом они соотносятся с типом выпускаемой на фабрике азотной кислоты?
Промышленный выпуск азотной кислоты: история развития технологий
Прежде всего полезно будет изучить исторические факты о том, как развивалось производство азотной кислоты в России. В отечественной промышленности выпуск данного вещества, если следовать доступным сведениям, был инициирован при Петре I. Впоследствии М. В. Ломоносовым был предложен способ производства азотной кислоты из селитры — данное вещество фактически до начала 20 века считалась главным сырьем для выпуска рассматриваемого вещества.
Наряду с селитрой, производство азотной кислоты в промышленности осуществлялось с применением серной кислоты. Два рассматриваемых вещества, взаимодействуя между собой, образовывали азотную кислоту и серный оксид натрия. Преимущество данного способа заключалось в возможности получить азотную кислоту в концентрации порядка 96-98 % (при условии использования сырья требуемого качества).
Соответствующая технология достаточно активно совершенствовалась — в пользу увеличения скорости обработки сырья и обеспечения выхода большего объема продукта. Но постепенно она уступила место концепции, по которой производство азотной кислоты осуществлялось посредством контактного окисления аммиака.
Также был изобретен метод, по которому в качестве основного сырья для производства кислоты использовался оксид азота, получаемый посредством дугового окисления соответствующего газа из атмосферы. Распространена точка зрения, по которой первый способ — более экономически рентабельный.
По мере совершенствования технологических подходов к выпуску азотной кислоты сформировался подход, по которому самый оптимальный вариант производства соответствующего вещества — задействование промышленной инфраструктуры, функционирующей под повышенным давлением. Альтернативный ему — производство кислоты при атмосферном давлении, который считается менее рентабельным, с экономической точки зрения.
Выпуск вещества при обычном или повышенном давлении предполагают производство азотной кислоты из аммиака. Есть и комбинированный метод, сочетающий преимущества двух других. Особенности производства азотной кислоты комбинированным методом заключаются, во-первых, в окислении аммиака при атмосферном давлении, а осуществление его абсорбции — при повышенном.
Аммиак считается сейчас основным сырьем для выпуска вещества, о котором идет речь, наряду с водой и атмосферным воздухом. Изучим специфику их применения в производстве кислоты подробнее.
Сырье для выпуска азотной кислоты
Итак, основное сырье, используемое в производстве рассматриваемого вещества — это аммиак, воздух, а также вода.
При этом требуется применение аммиака в очищенном виде. Для этого он в рамках различных производственных циклов очищается на специальном испарительном и дистилляционном оборудовании. Аналогично при выпуске азотной кислоты должен применяться и чистый воздух. Он также фильтруется с применением специального оборудования. В свою очередь, вода, которая используется при выпуске азотной кислоты, очищается от примесей и солей. Во многих случаях для получения рассматриваемого вещества необходимо задействовать чистый конденсат.
Изучим то, в каких разновидностях рассматриваемое вещество может быть представлено, а также то, каким образом производится каждый тип азотной кислоты.
Разновидности азотной кислоты и основные стадии ее выпуска
Существует 2 разновидности азотной кислоты, выпускаемой на современных промышленных предприятиях — разбавленная и концентрированная. Производство разбавленной азотной кислоты осуществляется в рамках 3 основных стадий:
- конверсии аммиака (конечный ее продукт — оксид азота);
- получение диоксида азота;
- осуществление абсорбции оксидов азота при использовании воды.
На современных промышленных предприятиях распространен выпуск разбавленной азотной кислоты в рамках так называемой схемы АК-72. Но есть, безусловно, и другие технологии выпуска данного вещества.
В свою очередь, производство концентрированной азотной кислоты может быть осуществлено посредством повышения уровня содержания соответствующего вещества в разбавленной форме либо посредством прямого синтеза. Первый метод, как правило, позволяет получить раствор кислоты в концентрации порядка 68 %, чего может быть недостаточно для применения рассматриваемого вещества в ряде областей. Поэтому также распространен метод прямого синтеза, позволяющий получить вещество в концентрации порядка 97-98 %.
Рассмотрим более подробно то, как осуществляется производство азотной кислоты в той или иной разновидности. Выше мы отметили, что выпуск разбавленного вещества может осуществляться по схеме АК-72. Изучим для начала ее специфику.
Производство разбавленной кислоты по технологии АК-72
Рассматриваемая схема, посредством которой осуществляется производство азотной кислоты, предполагает применение замкнутого цикла, сопровождающегося:
- конверсией аммиака;
- охлаждением сопутствующих газов по давлением порядка 0,42-0,47 Мпа:
- осуществлением абсорбции оксидов под давлением порядка 1,1-1,26 МПа.
Конечный продукт схемы АК-72 — азотная кислота в концентрации порядка 60%. Производство азотной кислоты в рамках рассматриваемой технологии осуществляется в рамках таких стадий, как:
- обеспечение поступления воздуха из атмосферы в промышленный агрегат и осуществление его очистки;
- сжатие воздуха, разделение его на технологические потоки;
- осуществление испарения аммиака, очистка соответствующего газа от масляных и иных примесей, а также последующее его нагревание;
- смешивание очищенного амиака и воздуха, последующая очистка данной смеси и передача ее на катализатор;
- получение нитрозных газов и их охлаждение;
- сбор конденсата с азотной кислотой;
- концентрация и абсорбция азотной кислоты;
- охлаждение и очистка получившегося продукта.
Готовая кислота направляется в хранилище или заказчику.
Наряду с рассматриваемой технологией, по которой осуществляется производство азотной кислоты — АК-72, применяется другая популярная концепция выпуска соответствующего вещества, которая предполагает обеспечение функционирования промышленной инфраструктуры под давлением порядка 0,7 МПа. Рассмотрим ее особенности.
Технология выпуска продукта под давлением 0,7 МПа: нюансы
Посредством технологии, о которой идет речь, осуществляется производство неконцентрированной азотной кислоты — как альтернатива концепции АК-72. Она предполагает реализацию следующих стадий выпуска рассматриваемого вещества.
Прежде всего, как и в предыдущей технологии, очищается атмосферный воздух. Для этого, как правило, применяется двухступенчатый фильтр. Далее воздух, прошешдий очистку, сжимается посредством воздушного компрессора — примерно до показателя 0,35 Мпа. При этом воздух нагревается — до температуры порядка 175 градусов, и его необходимо охладить. После того как данная задача решена, он направляется в область дополнительного сжатия, в которой его давление увеличивается примерно до 0,716 МПа. Формирующийся поток воздуха, в свою очередь, нагревается до высокой температуры — около 270 градусов посредством воздействия нитротных газов. После он смешивается с аммиаком в специальной области промышленного агрегата. Соответствующее вещество задействуется при выпуске кислоты изначально в газообразном состоянии, которое образуется вследствие испарения жидкости. Кроме того, аммиак должен быть очищен. После подготовки газ нагревается и подается в смеситель одновременно с воздухом. Данная смесь также фильтруется и после очистки подается на конверсию аммиака. Соответствующая процедура осуществляется с применением сеток из сплава платины и родия при очень высокой температуре — порядка 900 градусов. Уровень конверсии при этом составляет порядка 96%.
Производство слабой азотной кислоты по рассматриваемой технологии предполагает образование нитрозных газов. Они выводятся в специальную область промышленного агрегата, в котором охлаждаются. За счет этого происходит испарение очищенной воды и появление пара с высоким давлением. Проведенные через соответствующую область промышленного агрегата нитрозные газы перемещаются в окислитель. Стоит отметить, что их окисление частично происходит уже на предыдущей стадии производства кислоты. Но в окислителе оно становится еще более интенсивным. При этом нитрозные газы разогреваются до температуры порядка 335 градусов. Впоследствии они охлаждаются в специальном теплообменнике, а затем — направляются в конденсатор.
После этого образуется азотная кислота в слабой концентрации. От нее необходимо отделить оставшиеся нитрозные газы — для этого используется сепаратор. Из него азотная кислота подается в абсорбционную область промышленного агрегата. Кислота впоследствии перетекает в области аппарата, расположенные ниже. При этом она взаимодействует с оксидами азота, вследствие чего ее концентрация увеличивается. На выходе она составляет порядка 55-58 %. В ней, как правило, содержатся растворенные оксиды, которые необходимо извлечь: для этого вещество направляется в продувочную область агрегата. С помощью разогретого воздуха оксиды извлекаются из кислоты. Готовый продукт размещается на складе или отгружается заказчику.
Производство концентрированной кислоты: прямой синтез
Рассмотрев то, как осуществляется производство разбавленной азотной кислоты, изучим специфику выпуска концентрированного вещества. В числе самых экономически рентабельных технологий, задействуемых на предприятиях соответствующего профиля — получение кислоты посредством прямого синтеза из сырья в виде оксидов азота.
Сущность данного метода — в стимулировании химической реакции между указанным веществом, водой, а также кислородом под давлением порядка 5 МПа. Технология, по которой осуществляется производство азотной кислоты концентрированного типа на основе разбавленной, имеет нюанс: обеспечение перехода диоксида азота в жидкую форму возможно при давлении и температуре, близким к атмосферным. Однако, в некоторых реакциях концентрация соответствующего вещества недостаточна для его перевода в жидкое состояние при обычном давлении, и его приходится повышать.
Производство концентрированной кислоты на основе разбавленной
В данном случае предполагается концентрирование кислоты посредством абсорбирующих веществ — таких как серная, фосфорная кислоты, различные растворы нитратов. Основные стадии производства азотной кислоты концентрированного типа на основе разбавленной с применением серной кислоты следующие.
Сначала сырье делится на 2 потока: первый подается в испаритель, второй — попадает в холодную область промышленного агрегата. Серная кислота подается в область аппарата, расположенную выше второго потока разбавленной азотной кислоты. В нижнюю часть агрегата, в свою очередь, осуществляется подача пара, который нагревает используемую смесь, вследствие чего из нее испаряется азотная кислота. Ее пары поднимаются вверх по аппарату, после чего выводятся в холодильник. Там пары кислоты конденсируются — до тех пор, пока ее концентрация не достигнет 98-99 %.
При этом некоторая часть присутствующих в рамках данной стадии производства оксидов азота поглощается кислотой. Их необходимо извлечь из продукта: чаще всего в этих целях используются пары азотной кислоты, которые направляются в конденсатор. Извлеченные оксиды азота, а также пары кислоты, которые не образовали конденсата, направляются в другую область аппарата — на абсорбцию, где проходят обработку водой. В результате образуется разбавленная кислота, которая вновь подается на конденсирование и охлаждение. Готовый продукт направляется на склад или заказчику.
Особенности концентрирования с помощью серной кислоты
Основная задача, которая характеризует производство азотной кислоты в промышленности — осуществление рентабельного и эффективного ее концентрирования. Существует несколько подходов к выработке оптимальной схемы ее решения. Полезно будет рассмотреть те, что относятся к самым распространенным.
Выше мы отметили, что для концентрирования вещества, о котором идет речь, может применяться серная кислота. Существует довольно распространенный способ повышения эффективности ее применения — предварительное повышение концентрации азотной кислоты посредством выпаривания. Оптимально, что перед обработкой серной кислотой соответствующее вещество будет иметь концентрацию порядка 59-60 %. Стоит отметить, что на практике данная технология производства азотной кислоты характеризуется низким уровнем экологичности. Поэтому в качестве альтернативы применению серной кислоты распространено использование нитратов. Изучим их специфику подробнее.
Концентрирование с помощью нитратов
Чаще всего для решения рассматриваемой задачи, характеризующей производство азотной кислоты из аммиака, применяются нитраты магния или же цинка. Прежде всего он существенно более экологичен, чем метод, предполагающий использование серной кислоты. Кроме того, данная технология позволяет обеспечить самое высокое качество азотной кислоты как конечного продукта.
Вместе с тем у нее есть ряд недостатков, который предопределяют появление затруднений в повсеместном ее применении. Прежде всего — это довольно высокая себестоимость производственного процесса. Кроме того, данная технология во многих случаях предполагает появление твердых отходов, переработка которых может быть осложнена.
Применение катализаторов при выпуске азотной кислоты
Полезно будет рассмотреть то, какие еще вещества применяются наряду с основным сырьем для выпуска рассматриваемого продукта в промышленном (чаще всего в качестве таковых рассматриваются катализаторы) производстве азотной кислоты. Использование веществ, о которых идет речь, обусловлено необходимостью увеличения рентабельности выпуска кислоты, повышение динамики ее выхода на промышленном агрегате.
Главное требование к катализатору при производстве рассматриваемого продукта — избирательность действия. То есть он должен воздействовать на основную химическую реакцию, не затрагивая побочные процессы. Чаще всего в производстве кислоты задействуются катализаторы, в составе которых присутствует платина.
Выше мы отметили, что при выпуске слабоконцентрированного вещества при повышенном давлении задействуются катализаторы на основе платины и родия. В ряде случаев также применяются сплавы с добавлением палладия. Но основной металл в них — платина, ее содержание обычно составляет не менее 81%. Сущность катализатора в данном случае — стимулировать быстрое прохождение основной химической реакции. Как правило, она проходит в рамках внешнедиффузионного участка.
При этом процесс зависит от пределов диффузии кислорода относительно поверхности катализатора. Данная особенность обуславливает более высокую концентрацию аммиака — основного сырья для выпуска азотной кислоты, на поверхности того или иногда катализатора, если сравнивать соответствующий показатель с концентрацией на воздухе. Возможно увеличение удельного веса различных побочных реакций, при которых наблюдается неполное окисление и образование азота либо его оксида. В связи с этим кислород у поверхности должен находиться в количестве, достаточном для вытеснения аммиака. В этом случае удастся достичь достаточно глубокого окисления.
Можно отметить, что, наряду с платиновыми катализаторами, в производстве азотной кислоты также задействуются комбинированные вещества. В частности, железохромовые. Они позволяют существенно снизить экономические издержки, характеризующие выпуск рассматриваемого вещества.
Итак, мы рассмотрели способы производства азотной кислоты, выделили основные ее типы. То, сколько стадий производства азотной кислоты необходимо реализовать, зависит от ее разновидности, а также конкретной технологии выпуска соответствующего вещества. Полезно будет теперь рассмотреть то, какие сложности характеризуют промышленное производство данного востребованного во многих сферах экономики продукта.
Основные проблемы в производстве азотной кислоты
Итак, как мы уже знаем, производство азотной кислоты контактным способом — одним из самых распространенных в современной промышленности, предполагает задействование катализатора в целях ускорения окисления аммиака и увеличения выхода продукта. Основная проблема выпуска рассматриваемого продукта — достаточно высокая цена соответствующего катализатора. При этом его селективность не всегда достигает оптимальной величины. Кроме того, значительная часть платины, что используется в качестве основного элемента для катализатора, может теряться в ходе производства. В результате, опять же, снижается экономическая эффективность выпуска продукта.
Еще одна проблема, характеризующая производство азотной кислоты — экологическая. Выше мы отметили, что при концентрации сырья может использоваться серная кислота, и по факту прохождения соответствующего производственного цикла образуются вредные вещества. Альтернативой в данном случае может быть применение нитратов — но это, опять же, предполагает увеличение экономических издержек. Однако экологический фактор для современных производителей сегодня столь же значимый, как и уровень рентабельности производства.
Источник