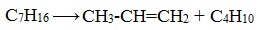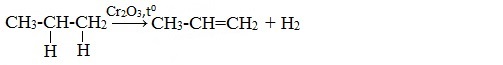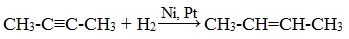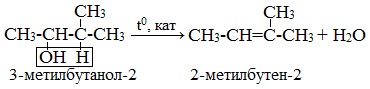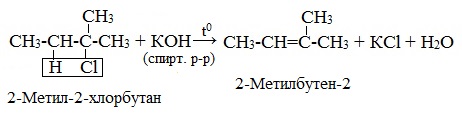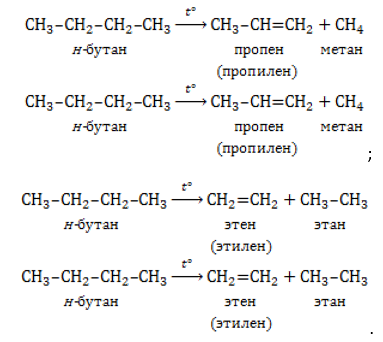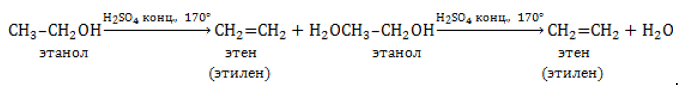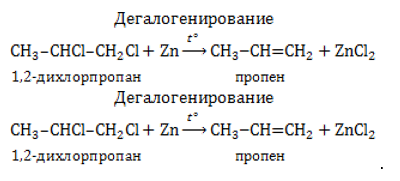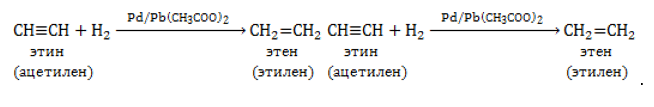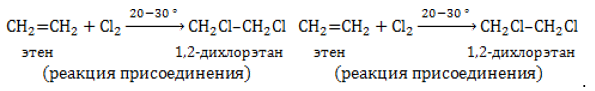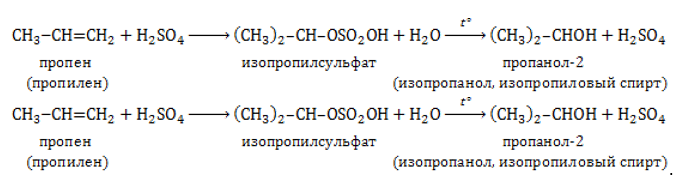- Способы получения алкенов
- Получение алкенов
- 1. Дегидрирование алканов
- 2. Крекинг алканов
- 3. Дегидрогалогенирование галогеналканов
- 4. Дегидратация спиртов
- 5. Дегалогенирование дигалогеналканов
- Получение алкинов
- Получение алкинов
- 1. Дегидрирование алканов
- 2. Пиролиз метана
- 3. Гидролиз карбида кальция
- 4. Дегидрогалогенирование дигалогеналканов
- 5. Алкилирование соединений алкинов с металлами
- Добавить комментарий Отменить ответ
- Промышленные способы получения алкинов
- Применение алкенов
- Получение алкеновых углеводородов
- Основные способы получения алкенов в промышленности
- Лабораторный синтез алкенов
- Области применения алкенов
- Заключение
Способы получения алкенов
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Получение алкенов
Рассмотрим промышленные и лабораторные способы получения алкенов.
1. Дегидрирование алканов
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, образуются двойные и тройные связи.
| Например, при дегидрировании этана может образоваться этилен или ацетилен: |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:

Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

2. Крекинг алканов
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
| Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды. |

Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
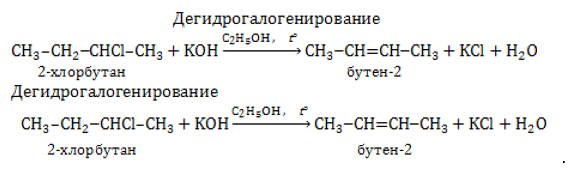
3. Дегидрогалогенирование галогеналканов
Галогеналканы взаимодействуют с щелочами в спиртовом растворе. При этом происходит дегидрогалогенирование – отщепление (элиминирование) атомов водорода и галогена от галогеналкана.
| Например, при взаимодействии хлорэтана с спиртовым раствором гидроксида натрия образуется этилен. |
При отщеплении галогена и водорода от некоторых галогеналканов могут образоваться различные органические продукты. В таком случае выполняется правило Зайцева.
| Правило Зайцева: отщепление атома водорода при дегидрогалогенировании и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода. |
| Например, при взаимодействии 2-хлорбутана со спиртовым раствором гидроксида натрия преимущественно образуется бутен-2. Бутен-1 образуется в небольшом количестве (примерно 20%). В реакции мы указываем основной продукт. |
4. Дегидратация спиртов
При нагревании спиртов (выше 140 о С) в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота) или катализаторов (оксид алюминия) протекает дегидратация. Дегидратация — это отщепление молекул воды.
При дегидратации спиртов образуются алкены.
| Например, при дегидратации этанола при высокой температуре образуется этилен. |

Дегидратация более сложных молекул также протекает по правилу Зайцева.
| Например, при дегидратации бутанола-2 преимущественно образуется бутен-2. |
5. Дегалогенирование дигалогеналканов
Дигалогеналканы, в молекулах которых два атома галогена расположены у соседних атомов углерода, реагируют с активными металлами с образованием алкенов.
Как правило, для отщепления используют двухвалентные активные металлы — цинк или магний.
Источник
Получение алкинов
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Получение алкинов
1. Дегидрирование алканов
При дегидрировании алканов, содержащих от двух до трех атомов углерода в молекуле, образуются двойные и тройные связи.
| Например, при дегидрировании этана может образоваться этилен или ацетилен: |
2. Пиролиз метана
Пиролиз метана – это промышленный способ получения ацетилена.
Реакцию проводят, очень быстро пропуская метан между электродами (электродуговой способ) — примерно 0,1-0,01 секунды при температуре 1500 о С.
Если процесс проводить дольше, то метан разлагается на углерод и водород:
3. Гидролиз карбида кальция
Лабораторный способ получения ацетилена – водный или кислотный гидролиз карбида кальция CaC2.
В кислой среде образуется ацетилен и соответствующая соль:
Карбид кальция можно получить, нагревая оксид кальция с углеродом:
СаО + 3С (изб) → СаС2 + СО
4. Дегидрогалогенирование дигалогеналканов
Дигалогеналканы, в молекулах которых два атома галогена расположены у одного, либо у соседних атомов углерода, реагируют с избытком спиртового раствора щелочей с образованием алкинов.
| Например, 1,2-дихлорпропан реагирует со спиртовым раствором гидроксида натрия |
1,1-дихлорпропан реагирует со спиртовым раствором щелочи с образованием пропина.
5. Алкилирование соединений алкинов с металлами
Ацетилениды, пропиниды и прочие соединения алкинов с металлами реагируют с галогеналканами с образованием гомологов алкинов. При этом происходит удлиннение исходной молекулы алкина.
| Например, пропинид натрия реагирует с бромэтаном с образованием пентина-2 |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Источник
Промышленные способы получения алкинов
В промышленности
В природе алкены встречаются в меньшей степени, чем предельные углеводороды, вследствие своей высокой реакционной способности. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, поэтому их получают с использованием различных реакций.
1.Крекинг алканов
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400 о -700 о С).
2.Дигидрирование алканов (отщепление молекул водорода)
Реакция проводится при температуре 400 0 С, катализатором является оксид хрома (III) или Ni.
3.Гидрирование алкинов (присоединение молекул водорода)
В лаборатории
Алкены получают по реакциям отщепления (элиминирования) двух атомов или групп атомов от соседних атомов углерода с образованием между ними π-связи.
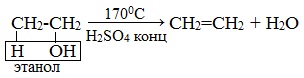
1. Дегидратация спиртов (отщепление молекул воды)
Этилен получают при нагревании этилового спирта в присутствии концентрированной серной кислоты, как сильного водоотнимающего вещества при нагревании и недостатке спирта:
При внутримолекулярной дегидратация вторичных и третичных спиртов атом водорода отрывается от менее гидрогенизированного соседнего атома углерода (правило А.М.Зайцева).
Видеоопыт «Получение этилена из этилового спирта»
Видеоопыт «Получение этилена и опыты с ним»
2. Дегидрогалогенирование моногалогеналканов действием спиртового раствора щелочи (происходит по правилу Зайцева)
3. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов (Mg, Zn)
Источник
Применение алкенов
К углеводородным соединениям класса алкенов относятся вещества, обладающие высокой реакционной способностью. Это свойство дает возможность получать из алкенов важные продукты, в которых нуждаются различные отрасли от транспорта до фармацевтической промышленности. Широкое и массовое применение алкенов является причиной постоянного роста их производства.
Получение алкеновых углеводородов
Главный источник сырья для алкенов – предельные углеводороды, выделяемые из нефти, нефтяных попутных газов и природного газа, а также их производные.
Основные способы получения алкенов в промышленности
- Высокотемпературная переработка горючих полезных ископаемых.
- Пиролиз.
Процесс пиролиза (термического разложения) высокомолекулярных алканов и циклоалканов проводится при 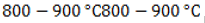
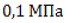
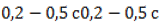
Пиролиз – распространенный способ получения наиболее востребованных алкенов – этилена и пропилена.
Отличие крекинга от пиролиза состоит в более низкой рабочей температуре процесса (450 — 550℃ 450 — 550℃) и в большей длительности, однако при этом требуется повышенное давление 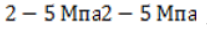
Крекингом нефти и газойля получают значительную часть бутилена, изобутилена и более высокомолекулярных алкенов.
При термической обработке каменного угля образуется коксовый газ, содержащий этилен. В ряде случаев его выделение оказывается экономически выгодным и производится в промышленных масштабах.
Нагревание алканов до 
Лабораторный синтез алкенов
Алкены получают в лаборатории с помощью таких методов, как:
Отщепление гидроксогруппы OHOH и водорода HH от молекулы спирта протекает при 150℃ и выше в присутствии сильного водопоглощающего агента, например, концентрированной серной или фосфорной кислоты:
Данный способ может применяться и для промышленного синтеза в том случае, если стоимость этанола, получаемого из сельскохозяйственного сырья, оказывается ниже, чем у нефтепродуктов.
- Дегалогенирование и дегидрогалогенирование галогенпроизводных алканов.
Если в дигалогеналкане галогенизированы атомы углерода, расположенные в молекулярной цепочке рядом, они могут быть отщеплены с образованием алкена цинком либо другим активным металлом – магнием:
От молекулы моногалогеналкана возможно отнятие водорода и галогена щелочью, растворенной в спирте. В результате отщепления в молекуле возникает двойная связь:
Водород отщепляется от наименее гидрированного углеродного атома в молекуле галогеналкана (правило Зайцева).
В присутствии специального катализатора Линдлара алкины гидрируются до алкенов:
Полное гидрирование приводит к образованию алканов.
Области применения алкенов
В качестве химического сырья или конечного продукта алкены широко востребованы в промышленности.
Синтез полимеров
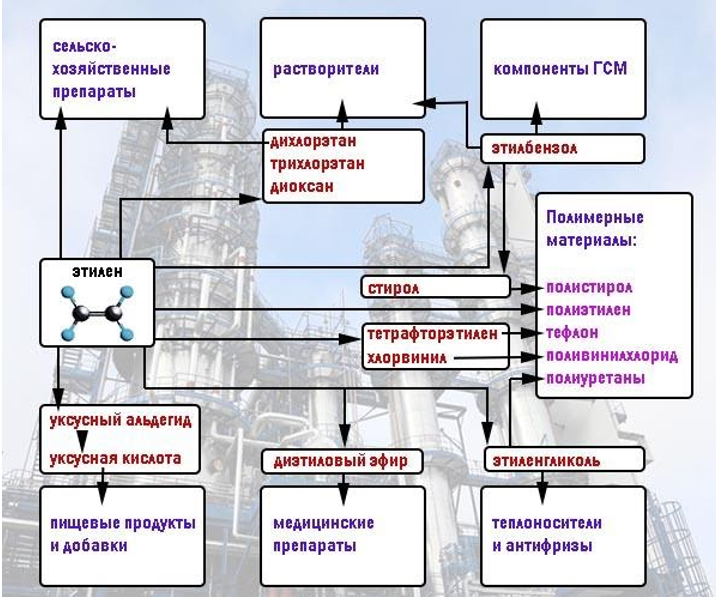
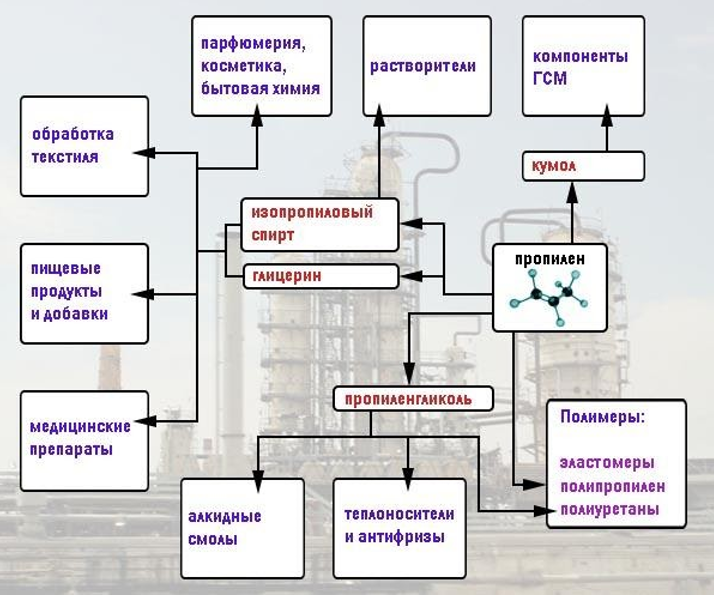
Из этилена и его производных получают полиэтилен, тефлон (политетрафторэтилен), полистирол, поливинилхлорид; из пропилена – полипропилен. Этилен и пропиленгликоли, получаемые окислением соответствующих алкенов, используются в производстве полиуретанов.
Из этилен-пропиленовых эластомеров изготавливают резины и изоляционные материалы. Бутен (бутилен) представляет собой сырье для получения изопрена, бутадиена, изобутилена, продуктами полимеризации которых являются каучуки.
Производство горюче-смазочных материалов и антифризов
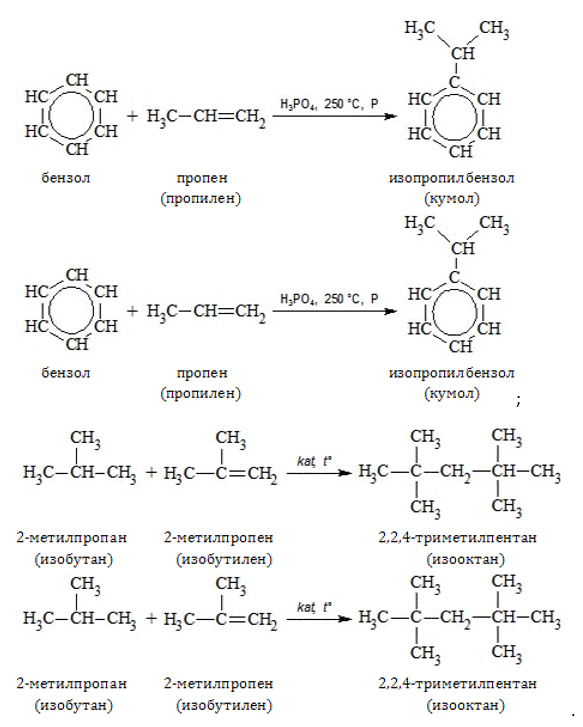
В качестве добавок к бензинам применяются:
- этилбензол;
- изопропилбензол, или кумол (получают на основе пропена);
- изооктан (синтезируют с использованием бутена).
Производные этилена и изобутилена входят в состав машинных масел. Многоатомные спирты этиленгликоль и пропиленгликоль используются как основа для антифризов.
Бутилен содержится в газовых смесях для сварки и резки металлов.
Производство растворителей
Этилен служит сырьем для синтеза диоксана, дихлорэтана и трихлорэтилена – органических растворителей широкого назначения.
Другой распространенный растворитель – бутанон, или метилэтилкетон – получают из бутена.
Сельское хозяйство
Дихлорэтан применяют также для обеззараживания семян и помещений сельскохозяйственного назначения. В сельском хозяйстве используется и непосредственно этилен как растительный гормон, особенно в качестве стимулятора роста и созревания плодов.
Фармацевтическое производство
Широкое применение в медицине находят производные пропена – изопропанол и глицерин как эффективные антисептики, компоненты препаратов для лечения кожных заболеваний и растворители. Глицерин также предотвращает высыхание вязких препаратов – мазей, паст – и способствует увеличению срока их годности. Он входит в состав противоожоговых и противокашлевых средств.
Получаемый из этилена диэтиловый эфир применяется в медицинской практике как препарат для общего наркоза и местной анестезии.
Пищевая и легкая промышленность
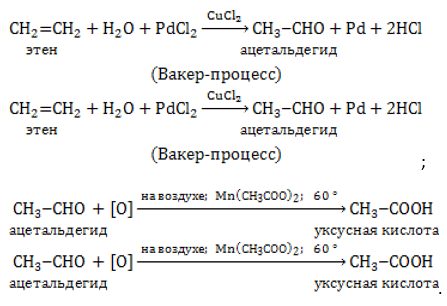
Путем окисления этилена на катализаторе получают уксусный альдегид, являющийся сырьем для производства уксусной кислоты.
Глицерин зарегистрирован в качестве эмульгатора, защитного пленкообразователя и загустителя как пищевая добавка E422. Наряду с изопропиловым спиртом входит в состав косметической и парфюмерной продукции и бытовой химии.
Текстильная промышленность также использует глицерин для обработки волокон и тканей.
Алкены состава 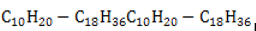
Разнообразие сфер применения алкенов и их производных можно представить в схематическом виде:
Заключение
Алкены вследствие высокой реакционной способности относятся к веществам, мало распространенным в природе. Исключение – этилен, вырабатываемый в растительных тканях. Однако большие объемы производства алкенов для удовлетворения потребностей разных отраслей превращают алкены в широко распространённый вид химического сырья.
Источник