Из чего делают уксусную кислоту в промышленности?
Огромное количество заводов по производству уксуса используют ускоренный метод изготовления. Поэтому давайте разберемся, как получают уксусную кислоту в промышленности в этом случае.
Сырьем для производства уксусной кислоты на таких заводах является спирт-сырец. Однако не всякий спирт-сырец можно использовать в уксусном производстве. Группа высших спиртов, входящая в состав сивушного масла, угнетающим образом действует на бактерии. Их присутствие в сыром спирте в большом количестве приводит к расстройству всего производственного процесса. По этой причине не допускают спирт-сырец, который предварительно смешанный с остаточными погонами, полученными в ходе ректификации сырого спирта.
Однако спирт-сырец, укрепленный прибавлением головных фракций, который выделяются при ректификации спирта и содержатся альдегиды и эфиры, оказывается полностью приемлемым для уксусного производства. Гидролизный и сульфитный спирты употребляются лишь в том случае, когда они свободны от кротонового альдегида и метилового спирта.
Технологическая схема производства уксусной кислоты.
Рассмотрим технологическую схему производства натуральной уксусной кислоты. Спирт приходит в сборник, где разбавляется с водой и денатурируется укусом с таким расчетом, чтобы содержание спирта было 9%, а концентрированной уксусной кислоты 1%. В следующий бак к полученному в сборнике затору прибавляется дополнительный уксус, а также другие питательные вещества для более интенсивного развития уксусных бактерий. Полученное сусло перекачивается в напорный бак.
Сразу из напорного бака вещество поступает через дозировочные и распределительные бачки в маточники. Затем опять наступает перерыв, нужный для того, чтобы бачек опять наполнился, и после этого жидкость опять будет стекать в маточники. Маточник – это дубовый цилиндрический чан с высотой 3 метра и диаметром 1 метр, в котором на высоте 150 миллиметров и 1200 миллиметров от дна укреплены два ложных дна (деревянных круга) с большим числом очень мелких отверстий. На эти круги накладываются буковые стружки, свернутые в трубки. Общий вес стружек в сухом виде составляет около 300 кг. Их объем – 2 м3. Чтобы облегчить доступ воздуха в маточник в их стенках имеет два ряда отверстий.
Сусло поступает внутрь маточника через специальную воронку, и которой оно позже поступает в распределительное устройство, действующее по принципу сегнерова колеса. Средняя суточная производительность каждого уксусообразователя от 26 до 30 литров уксуса с концентрацией 9,2-9,5%, а это соответствует 2,5-2,8 кг концентрированной уксусной кислоты. Объем сусла, подаваемого в один аппарат в сутки – 80-90 литров при содержании 3% спирта и 7% кислоты. Следовательно, чтобы получить в среднем 28 литров уксуса из каждого аппарата, нужно пропустить примерно 85 литров сусла через группу из 3-х аппаратов.
Из маточников уже готовый уксус поступает по трубкам в сборник, откуда перекачивается высокомощным центробежным насосом в разливочное отделение в напорный бак. Из бака вещество самотеком поступает через фильтры на расфасовку.
Перед началом фильтрации для осветления уксуса, в него добавляют адсорбент. Один из наилучших адсорбентов – это бентонит. Осветление этим составом достигается очень быстро при очень малом его расходе, а это способствует уменьшению потерь уксуса с осадками.
Дмитриевский химический завод — это ведущий производитель растворителей в России. Производство многокомпонентных растворителей, бутилацетата и уксусной кислоты реализуется уже более чем 100 лет. Поставляем растворители на ведущие автоконцерны России. Есть опция изготовления растворителя по рецептуре заказчика. Растворитель 646 от Дмитриевского химического завода — это продукт эталонного качества по доступной цене.
Источник
Курсовая работа: Производство уксусной кислоты
| Название: Производство уксусной кислоты Раздел: Рефераты по химии Тип: курсовая работа Добавлен 19:46:12 18 декабря 2010 Похожие работы Просмотров: 15641 Комментариев: 21 Оценило: 8 человек Средний балл: 4.6 Оценка: 5 Скачать | |||||||||||||||||||||||
| 1. Внешний вид | Бесцветная, прозрачная жидкость без механических примесей |
| 2. Растворимость в воде | Полная, раствор прозрачный |
| 3. Массовая доля уксусной кислоты, %, не менее | 99,5 |
| 4. Массовая доля уксусного альдегида, %, не более | 0,004 |
| 5. Массовая доля муравьиной кислоты, %, не более | 0,05 |
| 6. Массовая доля сульфатов (SO4), %, не более | 0,0003 |
| 7. Массовая доля хлоридов (Cl),%, не более | 0,0004 |
| 8. Массовая доля тяжелых металлов осаждаемых сероводородом (Pb), %, не более | 0,0004 |
| 9. Массовая доля железа (Fe), %, не более | 0,0004 |
| 10. Массовая доля нелетучего остатка, %, не более | 0,004 |
| 11. Устойчивость окраски раствора марганцовокислого калия, мин, не менее | 60 |
| 12. Массовая доля веществ, окисляемых двухромовокислым калием, cm3 раствора тиосульфата натрия, концентрация с (Na2 SO3 *5H2 O) = 0,1 моль/дм3 (0,1H), не более | 5,0 |
1.2 Применение уксусной кислоты Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов.Водный раствор уксусной кислоты используют в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей).В состав уксуса входят такие кислоты, как яблочная, молочная, аскорбиновая, уксусная.Яблочный уксус ( 4% уксусной кислоты )Яблочный уксус содержит 20 важнейших минеральных веществ и микроэлементов, а также уксусную, пропионовую, молочную и лимонную кислоты, целый ряд ферментов и аминокислот, ценные балластные вещества, такие, как поташ, пектин. Яблочный уксус широко применяется при приготовлении различных блюд и консервировании. Он прекрасно сочетается со всевозможными салатами, как из свежих овощей, так и мясными и рыбными. В нем можно мариновать мясо, огурцы, капусту, каперсы, портулак, а также трюфели. Однако, на Западе яблочный уксус известен больше своими лечебными свойствами. Он применяется при повышенном кровяном давлении, мигренях, астме, головной боли, алкоголизме, головокружении, артрите, болезнях почек, высокой температуре, ожогах, пролежнях и др.Здоровым людям рекомендуется каждый день употреблять полезный и освежающий напиток: в стакане воды размешать ложку меда и добавить 1 ложку яблочного уксуса. Желающим похудеть, рекомендуем каждый раз во время еды выпивать стакан несладкой воды с двумя ложками яблочного уксуса.Уксус широко используется в домашнем консервировании для приготовления маринадов различной крепости. В народной медицине уксус используется как неспецифическое жаропонижающее средство (путем протирания кожи раствором воды и уксуса в пропорции 3:1), а также при головных болях методом примочек. Распространено применение уксуса при укусах насекомых посредством компрессов.Известно применение спиртового уксуса в косметологии. А именно для придания мягкости и блеска волосам после химической завивки и перманентной окраски. Для этого волосы рекомендуется ополаскивать теплой водой с добавлением спиртового уксуса (на 1 литр воды — 3-4 ложки уксуса).Уксус виноградный ( 4% уксусной кислоты )Виноградный уксус широко используется ведущими поварами не только Словении, но и всего мира. В Словении его традиционно используют при приготовлении различных овощных и сезонных салатов (2-3 ст. ложки на салатницу), т.к. он придает неповторимый и изысканный вкус блюду. Также виноградный уксус прекрасно сочетается с различными рыбными салатами и блюдами из морских продуктов. При приготовлении шашлыков из различных сортов мяса, но особенно из свинины, виноградный уксус просто незаменим.Уксусная кислота применяется также для производства лекарственных средств. Таблетки Аспирина (ЭС) содержат активный ингредиент ацетилсалициловую кислоту, которая представляет собой уксусный эфир салициловой кислоты. Ацетилсалициловая кислота производится путём нагревания салициловой кислоты с безводной уксусной кислотой в присутствии небольшого количества серной кислоты (в качестве катализатора).При нагревании с гидроксидом натрия (NaOH) в водном растворе ацетилсалициловая кислота гидролизуется до салицилата натрия и ацетата натрия. При закислении среды салициловая кислота выпадает в осадок и может быть идентифицирована по температуре плавления (156-1600С). Другим методом идентификации салициловой кислоты, образующейся при гидролизе, является окрашивание её раствора в тёмно-фиолетовый цвет при добавлении хлорида железа (FeCl3). Уксусная кислота, присутствующая в фильтрате, превращается при нагревании с этанолом и серной кислотой в этоксиэтанол, который можно легко распознать по его характерному запаху. Кроме того, ацетилсалициловая кислота может быть идентифицирована при помощи различных хроматографических методов. Ацетилсалициловая кислота кристаллизуется с образованием бесцветных моноклинных многогранников или игл, немного кислых на вкус. Они стабильны в сухом воздухе, однако во влажной среде постепенно гидролизуются до салициловой кислоты и уксусной кислоты (Leeson и Mattocks, 1958; Stempel,1961). Чистое вещество представляет собой белый кристаллический порошок, почти не обладающий запахом. Запах уксусной кислоты свидетельствует о том, что вещество начало гидролизоваться. Ацетилсалициловая кислота подвергается эстерификации под действием щелочных гидроксидов, щелочных бикарбонатов, а также в кипящей воде.Ацетилсалициловая кислота оказывает противовоспалительное, жаропонижающее, а также болеутоляющее действие, и ее широко применяют при лихорадочных состояниях, головной боли, невралгиях и др. и в качестве противоревматического средства.Уксусная кислота используется в и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров), в производстве негорючих пленок, парфюмерных продуктов, растворителей, при синтезе красителей, лекарственных веществ, например, аспирина. Соли уксусной кислоты используют для борьбы с вредителями растений.
1.3 Основные способы получения уксусной кислоты
1.3.1 Получение уксусной кислоты окислением ацетальдегида
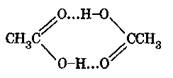
Процесс получения уксусной кислоты окислением ацетальдегида разработан фирмой Shawinigan (США). Окисление проводится кислородом в колоннах, футерованных алюминием, при 50—70°С и давлении до 0,7 МПа. В качестве растворителя используется уксусная кислота или ее водный раствор. Повышенное давление способствует поддержанию необходимой концентрации альдегида в жидкой фазе н увеличению надежности работы конденсационной системы. В качестве катализатора используется ацетат марганца. Окислительная колонна в нижней части снабжена перфорированной перегородкой для равномерного распределения кислорода по ее сечению. Процесс окисления протекает через стадию образования надуксусной кислоты, и катализатор играет активную роль в предотвращении ее накопления в значительных количествах.
Основными побочными продуктами окисления ацетальдегида являются ме-тилацетат, формальдегид, муравьиная кислота, ацетон, диацетил, этилиденди-ацетат. Это требует тщательной очистки товарного продукта от примесей.
В случае окисления ацетальдегида с использованием сложных катализаторов Со—Сu, Мn—Сu и в присутствии водоотводящих агентов (диизопропиловый эфир, этилацетат и т. д.) одновременно с уксусной кислотой образуется уксусный ангидрид.
Окисление ацетальдегида молекулярным кислородом представляет гомогенную каталитическую реакцию, протекающую в жидкой фазе и выражаемую общим уравнением:
Реакция протекает по цепному механизму через стадию образования надуксусной кислоты (НУК):
Которая, являясь сильным окислителем, окисляет ацетальдегид до уксусного ангидрида:
Источник