Нитроглицерин: получение в лаборатории
Нитроглицерин — одно из наиболее известных взрывчатых веществ, основа состава динамита. Он нашел широкое применение во многих областях промышленности благодаря своим характеристикам, однако до сих пор одна из главных проблем, связанных с ним — вопрос безопасности.
История
История нитроглицерина начинается с итальянского ученого-химика Асканьо Собреро. Он впервые синтезировал это вещество в 1846 году. Первоначально ему было дано название пироглицерина. Уже Собреро обнаружил его большую неустойчивость — нитроглицерин мог взрываться даже от слабых сотрясений или ударов.
Мощность взрыва нитроглицерина теоретически делала его перспективным реагентом в горнодобывающей и строительной промышленностях — он был гораздо эффективнее существовавших на то время видов взрывчатки. Однако упомянутая нестабильность создавала слишком большую угрозу при его хранении и транспортировке — поэтому нитроглицерин отложили в долгий ящик.
Дело чуть сдвинулось с места при появлении Альфреда Нобеля и его семьи — отец и сыновья наладили промышленное производство этого вещества в 1862 году, невзирая на все опасности, связанные с ним. Однако случилось то, что должно было случиться рано или поздно — на фабрике произошел взрыв, и младший брат Нобеля погиб. Отец после перенесенного горя отошел от дел, однако Альфред сумел продолжить производство. Для повышения безопасности он смешивал нитроглицерин с метанолом — смесь была более стабильной, однако очень пожароопасной. Это все еще не было окончательным решением.
Им стал динамит — нитроглицерин, поглощенный кизельгуром (осадочной породой). Взрывоопасность вещества уменьшилась на несколько порядков. Позже смесь совершенствовалась, кизельгур заменяли более эффективными стабилизаторами, однако суть оставалось той же — жидкость поглощалась и переставала взрываться от малейших сотрясений.
Физические и химические свойства
Нитроглицерин — это нитроэфир азотной кислоты и глицерина. В нормальных условиях это желтоватая, вязкая маслянистая жидкость. Нитроглицерин нерастворим в воде. Этим его свойством пользовался Нобель: чтобы после транспортировки подготовить нитроглицерин к применению и освободить его от метанола, он промывал смесь водой — метиловый спирт растворялся в ней и уходил, а нитроглицерин оставался. Это же свойство используют при получении нитроглицерина: водой продукт синтеза промывают от остатков реагентов.
Нитроглицерин гидролизуется (с образованием глицерина и азотной кислоты) при нагревании. Без нагревания идет щелочной гидролиз.
Взрывчатые свойства
Как уже было сказано, нитроглицерин крайне неустойчив. Однако здесь стоит сделать важное замечание: он восприимчив именно к механическому воздействию — взрывается от сотрясения или удара. Если просто поджечь его, жидкость, скорее всего, будет спокойно гореть без взрыва.
Стабилизация нитроглицерина. Динамит
Первым опытом по стабилизации нитроглицерина Нобеля был динамит — кизельгур полностью поглощал жидкость, и смесь была безопасной (до тех пор, конечно, пока ее не активируют в подрывной шашке). Причина, по которой используется именно кизельгур — капиллярный эффект. Наличие микротрубочек в этой породе обусловливает эффективное всасывание жидкости (нитроглицерина) и удержание ее там на долгое время.
Получение в лаборатории
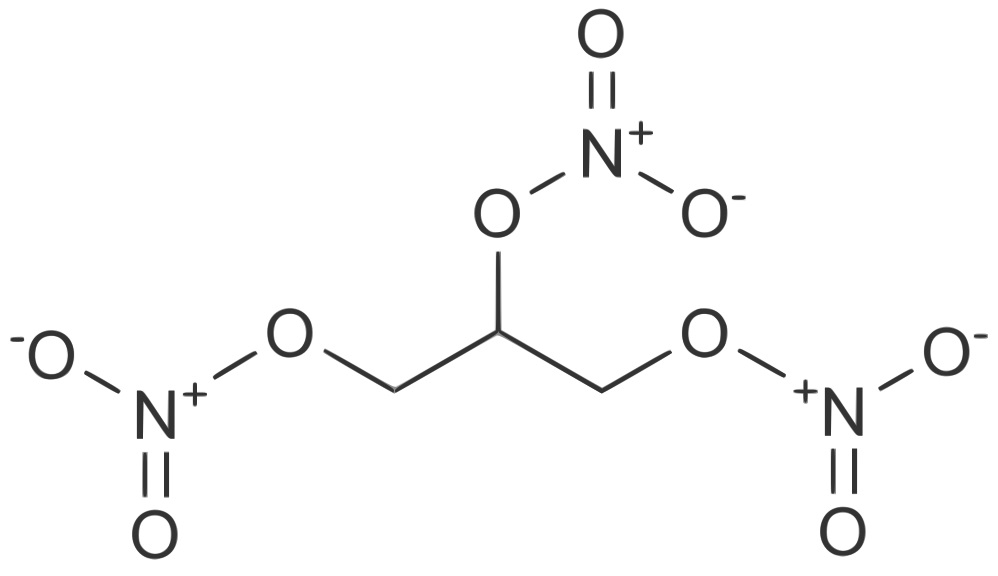
Реакция получения нитроглицерина в лаборатории сейчас все та же, которой пользовался еще Собреро — этерификация в присутствии серной кислоты. Сначала берется смесь азотной и серной кислот. Кислоты необходимы концентрированные, с малым количеством воды. Далее к смеси малыми порциями при постоянном перемешивании постепенно добавляется глицерин. Температура должна поддерживаться низкая, так как в горячем растворе вместо этерификации (образования эфира) будет происходить окисление глицерина азотной кислотой.
Но так как реакция идет с выделением большого количества тепла, смесь необходимо постоянно охлаждать (обычно это делается с помощью льда). Как правило, она держится в районе 0 °С, превышение отметки в 25 °С может грозить взрывом. Контроль температуры осуществляется постоянно с помощью термометра.
Нитроглицерин тяжелее воды, однако легче минеральных (азотной и серной) кислот. Поэтому в реакционной смеси продукт будет лежать отдельным слоем на поверхности. После окончания реакции сосуд необходимо еще охладить, подождать, пока в верхнем слое не скопится максимальное количество нитроглицерина, а потом слить его в другую емкость с холодной водой. Затем идет интенсивная промывка в больших объемах воды. Это необходимо для того, чтобы как можно лучше очистить нитроглицерин от всех примесей. Это важно, потому что в комплекте с остатками непрореагировавших кислот взрывоопасность вещества увеличивается в несколько раз.
Промышленное получение
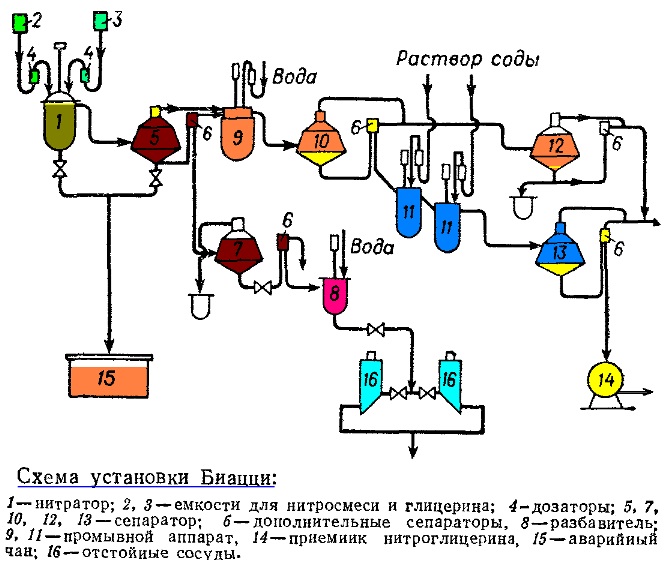
В промышленности уже давно довели до автоматизации процесс получения нитроглицерина. Система, которая используется в настоящее время, в основных своих аспектах была придумана еще в 1935 году Биацци (и так и называется — установка Биацци). Главные технические решения в ней — это сепараторы. Первичная смесь непромытого нитроглицерина сначала в сепараторе под действием центробежных сил разделяется на две фазы — ту, что с нитроглицерином, отбирают для дальнейшей промывки, а кислоты остаются в сепараторе.
Остальные этапы производства совпадают со стандартными. То есть, смешивание глицерина и нитрующей смеси в реакторе (производится с помощью специальных насосов, перемешивается турбинной мешалкой, охлаждение более мощное — с помощью фреона), несколько этапов промывки (водой и чуть подщелоченной водой), перед каждым из которых идет этап с сепаратором.
Установка Биацци достаточно безопасна и обладает достаточно высокой производительностью по сравнению с другими технологиями (однако обычно большое количество продукта теряется при промывке).
Домашние условия
К сожалению, хотя, скорее, к счастью, синтез нитроглицерина в домашних условиях связан со слишком большим количеством трудностей, преодоление которых в основном не стоит результата.
Единственный возможный способ синтеза в домашних условиях — получение нитроглицерина из глицерина (как и в лабораторном способе). И здесь основная проблема — серная и азотная кислоты. Продажа этих реактивов разрешена только определенным юридическим лицам и строго контролируется государством.
Возникает очевидное решение — синтезировать их самостоятельно. Жюль Верн в своем романе «Таинственный остров», рассказывая об эпизоде изготовления главными героями нитроглицерина, опустил конечный момент процесса, однако крайне подробно описал процесс получения серной и азотной кислот.
Действительно заинтересовавшиеся могут заглянуть в книгу (первая часть, глава семнадцатая), однако и тут загвоздка — необитаемый остров буквально изобиловал необходимыми реактивами, поэтому в распоряжении героев оказались серный колчедан, водоросли, много угля (для обжига), калийная селитра и так далее. Будет ли это у среднестатистического увлекающегося человека? Вряд ли. Поэтому домашний нитроглицерин в абсолютном большинстве случаев остается лишь мечтой.
Источник
Технология производства
Получение нитроглицерина с последующей сепарацией его от отработанной кислоты является одним из самых опасных процессов химической технологии.
Уравнение образования нитроглицерина:
Для ведения его требуется особенно тщательный контроль как сырья, так и аппаратуры. Необходимое условие безопасности производства — точное соблюдение технологии и правил работы, которая должна производиться высококвалифицированными рабочими и хорошо подготовленным инженерно-техническим персоналом. Однако возможность взрыва в производстве нитроглицерина все же полностью не исключается. Коренным решением вопроса безопасной работы обслуживающего персонала в этом производстве может быть только полный автоматический контроль и дистанционное управление. Такая организация процесса дает полную гарантию отсутствия жертв при возможном взрыве и уменьшает вероятность взрыва, так как производственный процесс будет регулироваться механизмами, В настоящее время большинство установок по получению нитроглицерина переведены на автоматический контроль и дистанционное управление.
Все технологические стадии производства нитроглицерина, благодаря жидкому агрегатному состоянию реагентов и большой скорости их взаимодействия, легко осуществляется в аппаратах непрерывного действия, которые, в свою очередь, можно легко автоматизировать.
Этерификация глицерина, проводимая серно-азотной кислотной смесью, протекает с большой скоростью. Этому способствует хорошая растворимость глицерина в кислоте и, следовательно, протекание реакции в растворе. Продукт реакции — нитроглицерин вследствие плохой растворимости выделяется в виде отдельного слоя, создавая таким образом гетерогенную среду. Нитроглицерин не растворяет глицерин, следовательно, не снижает его концентрацию и поэтому не препятствует этерификации. Однако образование слоя нитроглицерина несколько ухудшает условия этерификации, так как в нитроглицерин из кислотного слоя переходит значительная часть азотной кислоты. Это приводит к снижению этерифицирующей способности серно-азотной кислотной смеси и, кроме того, увеличивает опасность процесса. Азотная кислота, растворенная в нитроглицерине, способствует его разложению.
Периодические процессы. Более 60 лет нитроглицерин получали в малогабаритных аппаратах периодического действия, конструкция которых исключала возможность каких-либо ударов или трения. Перемешивание на стадии этерификации и промывки производили сжатым воздухом, перемещение нитроглицерина из одного аппарата в другой осуществлялось только самотеком.
Наиболее совершенный технологический процесс получения нитроглицерина был разработан Нобелем. По этому способу этерификацию проводили в цилиндрическом аппарате—нитраторе, снабженном змеевиком для подачи воды на охлаждение. Перемешивание нитромассы осуществлялось сжатым воздухом.
Разделение нитроглицерина и отработанной кислоты проводили в сепараторе — цилиндрическом сосуде, куда также был подведен сжатый воздух для перемешивания в случае подъема температуры разделяемой эмульсии. Сепарация являлась наиболее опасным звеном процесса вследствие довольно частого самопроизвольного разогрева нитромассы, особенно при задержке ее в этом аппарате. Для уменьшения продолжительности сепарации сепаратор имел небольшую высоту. Увеличение скорости разделения эмульсии путем повышения температуры или увеличения массы сепарируемой эмульсии в производстве нитроглицерина недопустимо. В начале в- Для сокращения продолжительности сепарации в нитромассу стали вводить добавки, изменяющие поверхностное натяжение капелек эмульсии: парафин, вазелин , тальк и др. Для уничтожения коллоидных силикатов (попадающих в нитромассу с азотной кислотой) стали добавлять фтористый натрий, который не только разлагает двуокись кремния по уравнению
2NaF + SiO2 + 2H2SO4 —> SiF
но и повышает скорость сепарации в результате образования пузырьков газа SiF4.
Несколько более совершенным с точки зрения техники безопасности был способ Натана, Томсона и Ринтула, принятый в производстве в 1904 г.. Основным преимуществом его была компактность установки, достигнутая благодаря совмещению функций нитратора и сепаратора в одном аппарате. Кроме того, на трубопроводах для передачи нитроглицерина вместо кранов были поставлены зажимы.
Аппарат установки Натана, Томсона и Ринтула представляет собой цилиндрический сосуд со скошенным днищем и конической верхней частью. К днищу подходит вертикальная труба для подачи кислоты. К этой трубе на расстоянии 30 см от днища подведены три патрубка. Один соединяет нитратор с напорными баками для кислотной смеси и отработанной кислоты, другой — с приемником для отработанной кислоты и третий — с аварийным чаном. Труба спущена на 30 см для того, чтобы при перемешивании нитроглицерин ни в коем случае не попадал в восходящую часть. Верхняя часть нитратора заканчивается смотровым стеклом и трубой, соединенной с баком предварительной промывки нитроглицерина. Нитратор снабжен змеевиком, термометром и трубками для подвода сжатого воздуха.
Этерификация в нитраторе проводится как обычно. В нижнюю часть его через трубу заливают нитросмесь, а сверху подают глицерин. По окончании процесса воздушное перемешивание прекращают и начинают сепарацию с помощью отработанной кислоты, подаваемой по той же трубе, через которую заливали нитросмесь. Нитроглицерин начинает постепенно выдавливаться отработанной кислотой в бак предварительной промывки. Контроль за ходом сепарации осуществляется через смотровое стекло. Такой способ сепарации лучше отвечает требованиям техники безопасности. Способ Натана, Томсона и Ринтула на некоторых заводах сохранился до сих пор.
Безопасность работы периодических установок получения нитроглицерина обеспечивалась рядом специальных правил ведения этого процесса. Основные из них: тщательный контроль за чистотой исходных материалов, точность соблюдения дозировок и температурного режима, а также хорошее перемешивание нитромассы, исключающее образование зон застоя (что вполне возможно из-за несовершенства воздушного перемешивания).
Наиболее опасным процессом была сепарация, вследствие низкой стойкости кислого нитроглицерина. Во всех случаях появления опасности разложения продукта реакционную массу спускали в аварийный чан, заполненный водой. Следует отметить, что спуск содержимого нитратора или сепаратора в аварийный чан не всегда спасает положение [50]. Из 100 случаев 20 кончается взрывом в чане, иногда остаток нитроглицерина взрывается в нитраторе. Для более безопасного и надежного спуска нитромассы аппараты (нитратор и сепаратор) снабжаются кранами, открывающимися автоматически с помощью сжатого воздуха. Пуск автомата в действие может быть произведен не только непосредственно с рабочего места, но также и из убежища. При включении автомата для спуска нитромассы в аварийный чан начинает работать сигнализация, предупреждающая об опасности всех лиц, находящихся в данном помещении.
Источник
Федеральное агентство по образованию бийский технологический институт (филиал) (2)
1.9.1 Нитроглицерин [3, 4, 10, 11]
Нитроглицерин, или тринитрат глицерина (ТНГ), получают обработкой глицерина смесью азотной и серной кислот (47–50 % НNO 3 ,
49–53 % H 2 SO 4 ). Реакция получения ТНГ следующая:

Этерификация протекает последовательно в три ступени: в первой получается мононитрат, во второй – динитрат и в третьей – тринитрат глицерина. Более 60 лет нитроглицерин получали по периодической схеме (метод Нобеля и метод Натана). При получении пери-одическими способами на фазах сепарации и очистки нитроглицерина от кислот скапливалось около 2–3 тонн нитроглицерина, что в случае аварии приводило к практически полному разрушению оборудования и производственных зданий.
В настоящее время в производстве применяются в основном непрерывные методы. При непрерывном методе в процессе находится меньшее количество ВВ, благодаря чему снижается опасность производства.
Нитрование глицерина происходит в нитраторе непрерывного действия в среде отработанной кислоты (рисунок 7).
1 – нитратор; 2, 4 − сепараторы; 3 − промывные колонны
Рисунок 7 − Технологическая схема непрерывного процесса
производства нитроглицерина
После нитрации глицерина в нитраторе получается эмульсия нитроглицерина в отработанной кислоте, которую необходимо быстро отделить от отработанной кислоты. Разделение нитроглицерина и отработанных кислот основано на различии их плотностей и осущест-вляется на фазе сепарации. Возможны два способа сепарации:
1. Из концентрированных кислотных смесей, когда плотность нитроглицерина меньше плотности кислотной смеси. В этом случае нитроглицерин собирается в верхней части сепаратора и сливается через верхнюю переливную трубу за счет притока новой порции кислотной смеси. Данный способ получения нитроглицерина назван сепарационным.
2. Из разбавленной кислотной смеси. В этом случае плотность нитроглицерина оказывается больше, чем разбавленной кислотной смеси, и нитроглицерин собирается в нижней части аппарата. Этот метод получения нитроглицерина называется бессепарационным, хотя принципиально неверно, т.к. операция сепарации имеется.
Первый метод получения нитроглицерина более экономичен, т.к. отработанная кислота может быть снова использована в производстве, а второй метод является более безопасным, т.к. разбавленная отработанная кислота менее реакционноспособна.
После отделения от кислоты нитроглицерин поступает на стабилизацию для более глубокой очистки его от кислот и примесей (сульфо- и сульфонитроэфиров, неполных нитратов), которые снижают химическую стойкость основного продукта. Стабилизация заключается в проведении многократных водных и щелочных промывок.
Существует более современный метод получения нитроглицерина, который был разработан в Швеции, это инжекторный метод.
Особенностью этой технологической схемы (рисунок 8) является проведение нитрации глицерина в инжекторе при повышенной температуре (46–48 °С) под вакуумом и отделение нитроглицерина от отработанных кислот в центрифуге.
Свойства нитроглицерина. Химически чистый нитроглицерин – это маслообразная, бесцветная, прозрачная жидкость. Плотность
1600 кг/м 3 (1,6 г/см 3 ). Затвердевая, может образовывать две формы:
лабильную, с температурой затвердевания 2,1 С, и стабильную, с температурой затвердевания 13,2 °С. Нитроглицерин частично растворим в воде: при 20 °С в одном литре воды растворяется 1,8 г нитроглицерина, а при 50 °С – 2,5 г.
Нитроглицерин хорошо растворяется во многих органических растворителях: ацетоне, диэтиловом эфире, метиловом спирте, бензоле, толуоле, ксилоле, нитробензоле и многих других. Нитроглицерин сам хорошо растворяет динитротолуол и тринитротолуол, что имеет большое значение для производства пластичных и желатинирован-
ных ВВ. В нитроглицерине растворяется нитроцеллюлоза с содержанием азота около 12 % (коллоксилин). Это свойство используется при изготовлении бездымного нитроглицеринового пороха и желатин-ди-намитов.
1 − инжектор для подачи водной эмульсии нитроглицерина на фазу
стабилизации в промывные колонны; 2 − центрифуга;
3, 22 − кожухотрубные теплообменники; 4 − холодильник;
5 − электромагнит; 6 − инжектор-нитратор; 7, 9, 11, 12 − термометры;
8 − игольчатый клапан для впуска воздуха в инжектор;
10 − вакуумметр; 13 − электромагнитное реле; 14 − сигнальный
колокол; 15 − хранилище кислотной смеси; 16 − хранилище глицерина; 17 − выключатель; 18 − ротамер для воды; 19 − ротамер для глицерина; 20 − ротамер для кислотной смеси; 21 − засасывающий бак
с постоянным уровнем для глицерина; 23 − хранилище воды
Рисунок 8 − Технологическая схема получения нитроглицерина
инжекторным методом (фаза нитрации и сепарации)
Нитроглицерин горит на воздухе зеленоватым пламенем со вспышками и треском. Горение большого количества нитроглицерина сопровождается взрывом. При быстром нагревании до 180 °С нитроглицерин взрывается. При медленном нагревании температура вспышки нитроглицерина 215–218 °С. Нитроглицерин очень чувствителен к удару и трению. При испытании на вертикальном копре при стандартных условиях дает 100 % взрывов. В этом случае нитроглицерин приближается к инициирующим ВВ, поэтому в чистом виде он не перевозится. Взрывчатое разложение нитроглицерина происходит по уравнению:
2C 3 H 5 (ONO 2 ) 3 = 6СО 2 + 5H 2 O + 3N 2 + 0,5О 2 .
Скорость детонации жидкого нитроглицерина 1100−2000 м/с. Нитроглицерин применяется в качестве пластификатора нитроцеллюлозы при изготовлении баллиститных порохов, а также для приготовления динамита, который состоит из 92−93 % нитроглицерина и 7−8 % коллоксилина. Применяется нитроглицерин для получения промышленных ВВ (угленитов). ТНГ нашел широкое применение в медицине для лечения сердечно-сосудистых заболеваний. Лекарственные препараты на его основе готовятся либо в виде таблеток, либо в виде капсул (раствор нитроглицерина в подсолнечном масле).
1.9.2 Гексоген [3,4]
Химическое название – циклотриметилентринитроамин. Химическая формула:
Получают гексоген нитрованием уротропина, причем существует несколько методов получения: окислительный, метод «К», уксусно-ангидридный.
Окислительный метод заключается в обработке уротропина концентрированной азотной кислотой, выделении гексогена из отработанной кислоты, фильтровании, промывке и сушке.
По методу «К» уротропин подвергается нитролизу раствором аммиачной селитры в концентрированной азотной кислоте.
Уксусно-ангидридный метод имеет несколько вариантов, один из которых (метод «КА») состоит из следующих операций: получение динитрата уротропина, получение тринитрата аммония и нитролиз динитрата уротропина тринитратом аммония в присутствии уксусного ангидрида.
Свойства и применение гексогена. Гексоген представляет собой кристаллическое белое вещество без запаха и вкуса. Он является сильным ядом, поэтому при работе с ним необходимо соблюдать правила техники безопасности. Плотность гексогена 1816 кг/м 3 (1,816 г/см 3 ), температура плавления 204,5–205 °С. При нагревании гексоген начинает разлагаться при 203 °С, причем при данной температуре отмечается повышенная чувствительность его к удару и трению. Поэтому снаряжение им боеприпасов производят не заливкой, а только прессованием. Для уменьшения чувствительности к удару и трению его флегматизируют парафином, воском, церезином и другими веществами.
Гексоген является мощным бризантным веществом. Скорость детонации при плотности 1700 кг/м 3 (1,7 г/см 3 ) равна 8380 м/с.
Чистый гексоген применяется для изготовления капсюлей-дето-наторов и как энергетическая добавка в некоторых составах баллиститных порохов. Гексоген в смеси с другими ВВ находит применение для снаряжения артиллерийских снарядов, авиационных бомб, морских мин, торпед.
Химическое название циклотетраметилентетранитрамин. Химическая формула:
Октоген существует в четырех кристаллических модификациях (α, β, γ, δ). Получают октоген нитролизом уротропина нитратом аммония в азотной кислоте в присутствии уксусного ангидрида и параформальдегида. Мольное соотношение компонентов подбирают так, чтобы обеспечивался максимальный выход октогена при минимальном выходе гексогена. Получают продукт, который содержит 30–40 % гексогена и 60–70 % октогена. Затем октоген отделяют от гексогена. Разделение основано на значительно большей (в четыре раза) растворимости гексогена в ацетоне, чем октогена. Проводят обработку продукта трехкратным количеством ацетона, при этом почти весь октоген отфильтровывают.
Гексоген выделяют путем разбавления ацетонового раствора водой (гексоген выпадает в осадок).
Выход чистого октогена составляет 50–55 % по уротропину.
Свойства октогена и его применение. Октоген – это высокоплавкое белое кристаллическое вещество. На практике нашла применение β-форма октогена, температура плавления которой 270 °С. По сравнению с гексогеном он более термостоек. Температура начала разложения 220 °С, поэтому октоген плавится с разложением. Скорость детонации при плотности 1900 кг/м 3 (1,9 г/см 3 ) составляет 9124 м/с.
Высокая термостойкость октогена позволяет использовать его в зарядах, подверженных воздействию высоких температур, например, при проведении взрывных работ в глубоких и сверхглубоких скважинах, в боеприпасах для сверхзвуковой авиации. По сравнению с гексогеном у октогена более высокая скорость детонации, большая бризантность и мощность.
Применяют октоген в качестве энергетической добавки в твердых ракетных топливах и артиллерийских порохах, также используют как в виде самостоятельных зарядов, так и в смеси с тротилом (октолы).
1.9.4 Нитраты целлюлозы [4, 11–16]
Нитраты целлюлозы (НЦ) получают действием на целлюлозу азотно-серной кислотной смеси с небольшим добавлением воды. Реакция протекает по следующей схеме:
[C 6 H 7 O 2 (OH) 3 ] m +mnHNO 3 
где n – степень этерификации;
m – степень полимеризации.
Серная кислота необходима для активации азотной кислоты и связывания воды, выделяющейся во время реакции.
Изменяя состав кислотной смеси, можно получить нитраты целлюлозы с разной степенью этерификации, то есть с разным содержанием азота. Важными показателями являются также растворимость нитратов целлюлозы в органических растворителях (определяет расход растворителей при их переработке) и вязкость (определяет механическую прочность пленок или каких-либо изделий).
В зависимости от содержания азота в них, растворимости в спиртово-эфирной смеси и вязкости 2%-ных растворов НЦ в ацетоне выпускают марки нитратов целлюлозы, представленные в таблице 1.
Таблица 1 − Технические характеристики нитратов целлюлозы
Вид нитрата целлюлозы
Условная вязкость, мПа·с
( о Э − градус Энглера)
Лаковый высоковязкий коллоксилин
Авиалаки, изоляционные лаки
Лаковый средневязкий коллоксилин
Лаки для дерева, искусственной кожи, клеящие составы
Лаковый низковязкий коллоксилин
Эмали, грунтовки, шпаклевки, клеящие составы
Лаковый весьма низковязкий коллоксилин
Лаки для металла, эмали для машин
Лаковый полусекундной вязкости коллоксилин
Лаки для мебели, бумаги, нитропленки
Мастика для изготовления технических тканей
Мячи для нас-тольного тенниса
Коллоксилин НХ, НД
Для баллиститных порохов
Продолжение таблицы 1
Для пироксилиновых порохов
Пироксилин 2П1, 2П2, 2П3
Для пироксилиновых порохов
1.9.4.1 Влияние некоторых факторов на процесс нитрования
целлюлозы
Влияние свойств целлюлозы на процесс этерификации. Реакционная способность полимеров в значительной мере зависит от доступности реакционноспособных функциональных групп. Для целлюлозы, ректификация которой протекает гетерогенно, определяющей ско-рость реакции стадией является проникновение нитрующего агента (азотной кислоты) внутрь волокна. Скорость реакции также зависит от величины и характера внутренней поверхности целлюлозы (от величины внутренней поверхности зависит количество сорбированной в начальный момент нитросмеси). Скорость капиллярной пропитки зависит от поверхностного натяжения нитрационной смеси, от ее способ-ности удержаться на стенках капилляров, а также от впитывающих свойств целлюлозы.
Образцы целлюлозы могут отличаться по характеру и величине своей поверхности. Целлюлоза гидрофильный материал, однако в зависимости от метода обработки (в частности, от условий сушки), а также от характера примесей она способна гидрофобизоваться. Образцы целлюлозы, высушенные при температурах более 120 °С, обладают малой реакционной способностью. При нагревании может происходить смыкание макромолекулярных цепей, особенно при наличии на поверхности гидрофобных примесей: сорбированных смол, лигнина и продуктов их распада. Этим объясняется более низкая, как правило, реакционная способность древесной целлюлозы. По сравнению с хлопковой древесная целлюлоза впитывает в начальный момент времени меньшее количество нитрационных смесей. При обработке образцов древесной целлюлозы поверхностно-активными веществами (ПАВ) улучшается ее впитывающая способность за счет экранирования ими гидрофобных участков.
На реакционную способность влияет удельная поверхность целлюлозы. При ее увеличении скорость реакции возрастает. Для образцов микрокристаллической целлюлозы (МКЦ) с развитой поверхностью этерификация заканчивается за 1,5–2,0 мин. Микрокристаллическая целлюлоза получается при кислотном гидролизе древесной и хлопковой целлюлозы. Увеличения скорости этерификации можно достигнуть, предварительно измельчив целлюлозу. Для измельченных образцов древесной целлюлозы реакция практически заканчивается через
2–5 мин. Для образцов с большой удельной поверхностью процесс этерификации можно проводить при малых модулях, поскольку для окончания реакции достаточно поглощенной за счет капиллярного впитывания кислоты.
Этерификация целлюлозы – гетерогенный процесс, скорость которого определяется массопередачей. Особенностью протекания такой реакции является увеличение диффузного сопротивления во времени. Скорость реакции зависит от толщины слоя целлюлозного материала, через который проникает нитрующий агент, особенно при этерификации образцов бумаги с различной плотностью.
Наиболее легко этерификация протекает для рыхлых бумаг, в которых целлюлозные волокна находятся на большом расстоянии друг от друга. Образцы бумаги с меньшей средней плотностью нитруются быстрее, и наиболее удобной для этерификации физической формой является папка. Однако рыхлая бумага и папка нетехнологичны: уменьшается загрузка нитрационных аппаратов, и ухудшаются расходные коэффициенты кислотных смесей из-за сложности их рекуперации. Но бумага при соответствующей плотности является наиболее удобной физической формой целлюлозы для нитрации, так как возможно более равномерное протекание реакции и получение более однородных продуктов. Существенна при этом однородность бумаги по толщине и плотности.
Источник