Этилен
| Этилен | |
 | |
 | |
| Общие | |
|---|---|
| Химическая формула | C2H4 |
| Физические свойства | |
| Молярная масса | 28.05 г/моль |
| Плотность | 0.001178 г/см³ |
| Термические свойства | |
| Температура плавления | −169.2 °C |
| Температура кипения | −103.7 °C |
| Классификация | |
| Рег. номер CAS | 74-85-1 |
| SMILES | C=C |
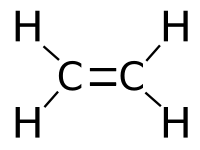
Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином), изологом этана. При нормальных условиях — бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном. Этилен — самое производимое органическое соединение в мире [1] ; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год [2] . Этилен обладает наркотическим действием. Класс опасности — четвёртый [3] .
Содержание
Применение
Этилен является ведущим продуктом основного органического синтеза и применяется для получения следующих соединений (перечислены в алфавитном порядке):
Этилен в смеси с кислородом использовался в медицине для наркоза вплоть до середины 80-х годов ХХ века в СССР и на ближнем Востоке. Этилен является фитогормоном практически у всех растений [4] , среди прочего [5] отвечает за опадание иголок у хвойных.
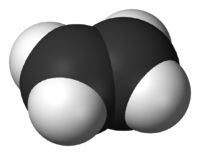
Электронное и пространственное строение молекулы
Атомы углерода находятся во втором валентном состоянии (sр2-гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три сигма-связи с углеродом и двумя атомами водорода. Р-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости -связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Основные химические свойства
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
Источник
Методы получения этилена
Техническое применение этилена и масштаб его производства
САМАРА 2013
Контрольная работа по дисциплине
Список использованных источников
1. Налоговый кодекс Российской Федерации (часть вторая) от 5 августа 2000 года N 117-ФЗ (ред. от 03.11.2010).
2. Об утверждении унифицированных форм первичной учетной документации по учету труда и его оплаты: Постановление Госкомстата РФ от 05.01.2004 N 1.
3. Вещунова Н.Л., Фомина Л.Ф. Самоучитель по бухгалтерскому и налоговому учету – СПб.: Проспект, 2010. – 560 с.
4. Радченко М.Г. 1С: Предприятие 8.1. Практическое пособие разработчика – СПб.: Питер, 2007. – 512 с.
5. 1С: Предприятие 8.1.Конфигурирование и администрирование. – М.: Фирма «1С», 2008. – 430 с.
«Теория химических процессов органического синтеза»
профессор Нестерова Т.Н.
Задание на контрольную работу
«Теоретический анализ процесса получения этилена»
1. Выполнить обзор литературы по областям технического применения этилена и масштабам его производства.
2. Выполнить обзор литературы по методам получения этилена, способам его выделения из контактного газа и перспективам развития технологий.
3. Выполнить полный теоретический анализ избранного процесса получения этилена:
§ Стехиометрия и материальные расчеты.
§ Термохимический анализ для индивидуального превращения и для процесса в целом.
§ Качественный и количественный термодинамический анализ для индивидуального превращения и для процесса в целом.
§ Качественный и количественный кинетический анализ для индивидуального превращения и для процесса в целом.
4. Дать рекомендации по условиям осуществления избранного процесса получения и выделения этилена . Предложить принципиальные технологические схемы реализации избранного процесса.
Содержание:
1. Обзор литературы …………………………………………. 3
1.1. Техническое применение этилена и масштабы его производства ..…………. 3
2. Методы получения этилена, способы выделения его из реакционных масс и перспективы развития технологий…………………………. 5
3. Полный теоретический анализ процесса получения этилена пиролизом пропана… ………………………………………………………………. 16
3.1. Стехиометрия и материальные расчеты..……………. 16
3.2. Термохимический анализ для индивидуального превращения и для процесса в целом………………………………………16
3.3. Полный термодинамический анализ получения этилена.…23
3.4. Полный кинетический анализ процесса…. ………..………32
4. Выводы и рекомендации….…. ………………………………… ………..37
Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином). В природе этилен практически не встречается.При нормальных условиях — бесцветный горючий газ со слабым запахом [1]. Его температура кипения -103,8 ˚С, а температура замерзания -169,5˚С.На воздухе он горит слегка светящимся пламенем [2]. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам [1].
Этилен играет чрезвычайно важную роль в промышленности, а также является фитогормоном.
Этилен-весьма важное сырье для получения ряда синтетических продуктов, особенно этилового спирта, этилен оксида (окиси этилена) этиленгликоля (антифриз) и др. Частично используется в автогенной сварке вместо ацетилена [2].
В Италии в 1957г было получено 100 тыс. т этилена. Производство этилена в Германии до ВОВ базировалось на пищевом сырье и продуктах переработки угля. В Германии в 1943 г выработано около 90 тыс. т этилена. В 1957 г в ФРГ было получено 100 тыс. т этилена. При этом намечалась тенденция перехода на нефтяное сырье. Производство этилена в Англии, составившее в 1957 г. Около 250 тыс. т, базируется на переработки нефтяного сырья. Во Франции в 1957 г. Было получено 32 тыс. т этилена; исходным сырьем являются коксовые газы и тяжелы продукты приработки нефти. В Японии в 1957 г. было выработано из нефтяного сырья около 40 тыс. т этилена [3].
Общее мировое производство этилена в 2005 году составило 107 миллионов тонн и продолжает расти на 4–6% в год. Источником промышленного получения этилена является пиролиз различного углеводородного сырья, например, этана, пропана, бутана, содержащихся в попутных газах нефтедобычи; из жидких углеводородов — низкооктановые фракции прямой перегонки нефти. А так же общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год [1].
Таблица 1. Крупнейшие российские компании — производители этилена и пропилена [5].
| Компания | Мощность по этилену, тыс. т/год | Мощность по пропилену, тыс. т/год |
| ОАО «Нижнекамскнефтехим» | ||
| ОАО «Казаньоргсинтез» | ||
| ООО «Ставролен» | ||
| ОАО «Салаватнефтеоргсинтез» | ||
| ОАО «Ангарский завод полимеров» | ||
| ОАО «Сибур-Нефтехим» | ||
| ОАО «Томский НХЗ» | ||
| ОАО «Уфаоргсинтез» | ||
| ЗАО «Нефтехимия» (Самарская обл.) | ||
| ЗАО «Сибур-Химпром» | ||
| ОАО «Московский НПЗ» | — | |
| ОАО «Омский каучук» | — | |
| Всего |
В промышленности тяжелого органического синтеза получили наибольшее распространение следующие процессы химической переработки этилена: полимеризация, окисление, оксосинтез, хлорирование, нитрование, гидратация, теломеризация и алкилирование [3].
Этилен впервые был получен немецким химиком Иоганном Бехером в 1680 году при действии купоросного масла на винный спирт. Вначале его отождествляли с «горючим воздухом», т.е. с водородом. Позднее, в 1795 году этилен подобным же образом получили голландские химики Дейман, Потс-ван-Труствик, Бонд и Лауеренбург и описали под названием «маслородного газа», так как обнаружили способность этилена присоединять хлор с образованием маслянистой жидкости — хлористого этилена («масло голландских химиков»).

В промышленности для получения этилена применяются разнообразные процессы: пиролиз легких и тяжелых парафиновых и нафтеновых углеводородов, гидрирование ацетилена, дегидратация этилового спирта. Кроме того, этилен получают в качестве побочного продукта при термической переработки твердого топлива, термическом и каталитического крекинга нефти и др.
2.1 Пиролиз предельных углеводородов
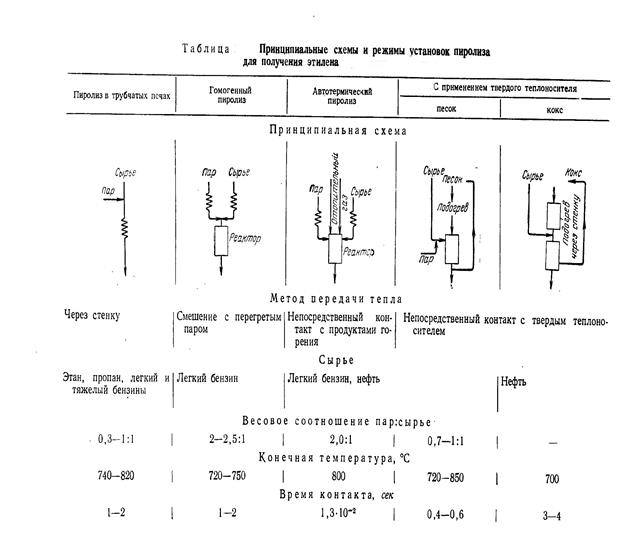
Основным промышленным методом получения этилена является высокотемпературное термическое расщепление (пиролиз) предельных углеводородов
В зависимости от метода подвода тепла различают следующие процессы: а) пиролиз в трубчатых печах; б) гомогенный пиролиз; в) автотермический пиролиз; г) с применим твердого теплоносителя.
C3H8↔C2H4+CH4 (III.2б)
Принципиальные схемы и режимы различных процессов пиролиза приведены в таблице [4].
2.2 Каталитическое гидрирование ацетилена в этилен
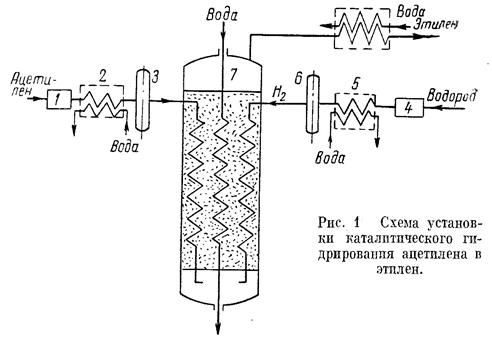
Был разработан в промышленности процесс получения этилена гидрированием ацетилена.
Оптимальная температура процесса 180-320° в зависимости от активности катализатора.
Принципиальная схема установки изображена на рис. 1
Ацетилен, полученный из карбида кальция (чистота 98-99%), сжимается в компрессоре 1 до 1,5-2 атм, охлаждается в холодильнике 2 и очищается твердым адсорбентом (алюмогелем) в адсорбере 3 от паров масла, так как последнее является ядом для катализатора. Водород, полученный из установки газоразделения (чистота 96-98%), сжимается в компрессоре 4, охлаждается в холодильнике 5, осушается и очищается от паров масла в адсорбере 6. Предварительный подогрев водорода и ацетилена осуществляется за счет тепла реакций либо в реакторе 7,либо в выносных теплообменниках. Оптимальная температура в реакторе поддерживается автоматически непрерывной подачей охлаждающей воды в трубчатый теплообменник реактора.
Процесс гидрирования ведут при значительных избытках водорода. Гидрирование ацетилена осуществляется практически полностью. В качестве катализатора используют палладий, нанесенный на силикагель. Содержание палладия в катализаторе не превышает
0,01% вес. Продолжительность непрерывной работы катализатора около одного года [3].
2.3 Дегидратация этилового спирта
Для получения относительно небольших количеств этилена (до 3000-5000 т/год) можно применять способ дегидратации этилового спирта. По этому способу в США в 1955 г. получено около 15000 т этилена [7].
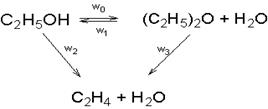
Реакция дегидратации этанола может быть выражена уравнением:
В качестве катализатора используется активированная окись алюминия и алюмокремниевые соединения. Процесс осуществляется при 300-400°.
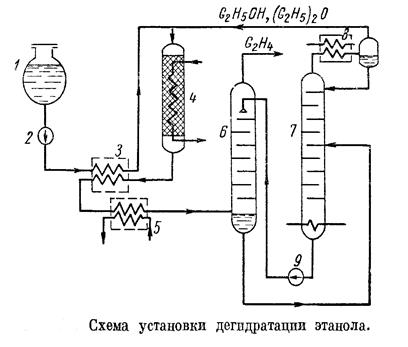
Технологическая схема установки дегидратации приведена ранее.
Этиловый спирт из емкости 1 насосом 2 через теплообменник 3 подает в реакторе 4. Необходимое тепло подводится через стенку реактора даутермом или дымовыми газами. Продукты реакции, состоящие из этилена, диэтилового эфира, этанола и воды, проходят чрез теплообменник 3 и конденсатор 5, в котором конденсируется вода, этанол и диэтиловый эфир.
В колонне 6 смесь делится на газовую и жидкую фазы; газовая фаза, состоящая в основном из этилена, направляется к потребителю чрез системы осушки и очистки твердыми сорбентами. Жидкость подается в колонну 7 с конденсатором орошения 8, в которой она разделяется на верхний продукт (смесь этанола и диэтилового эфира) и нижний (воду). Верхний продукт подается в реакторе 4, а нижний насосом 9 – в абсорбер 6. При этом достигается практически полное превращение этанола в этилен.
Экспериментально исследован процесс получения этилена дегидратацией этанола под давлением. В опытную установку этанол подавался насосом под давлением 33 атм через реактор, заполненный активированной окисью алюминия. Повышенное давление обусловлено необходимостью увеличения температуры до 425°. Выход этилена достигал 95% при чистоте полученного продукта 99%.[3]
2.4 Получение этилена из нефтезаводских газов
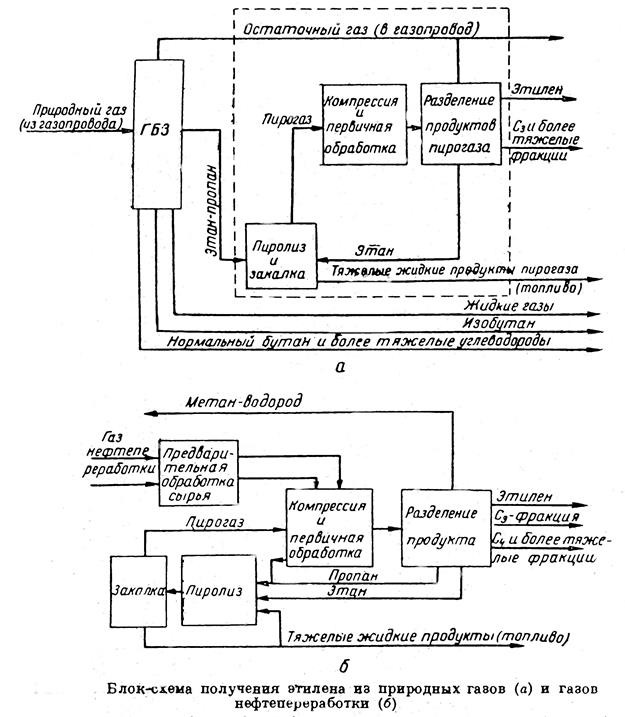
Газы термического и каталического крекинга нефтей содержат 2 – 2,5 % этилена. Количество этилена, получающегося при термическом крекинге, не превышает 0,15% вс. на переработанное сырье и при каталитическом крекинге — 0,45%. Поэтому обычно газоразделительная установка этиленового производства работает на сырье, представляющем смесь крекинг-газа и газов пиролиза некоторых компонентов этого же крекинг-газа (этана, пропана, пропилена, а иногда и бутана). Схема получения этилена из таких газов приведена далее на блок-схеме, б. Нефтезаводские газы проходят систему очистки и направляются на компрессию и предварительную осушку. Перед компрессией к этому потоку присоединяют газы пиролиза, содержащие до 30-35% объемн. Этилена. После компрессии, предварительного выделения тяжелых углеводородов и глубокой осушки смесь направляют на газоразделение. Целевым продуктом газоразделения является этилен, иногда пропилен и бутан-бутиленовые смеси, а предельны углеводороды- этан пропан- возвращают на установку пиролиза.
Одним их основных сырьевых источников получения этилена являются природные газы [3].
Блок-схема процесса получения этилена из природных газов, приведена на схеме-А:
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник