Методы получения коллоидных растворов



Методы получения и исследования дисперсных систем
Лекция 8
Для получения коллоидных растворов необходимо: 1) достичь коллоидной степени дисперсности; 2) подобрать дисперсионную среду, в которой нерастворимо вещество дисперсной фазы; 3) подобрать третий компонент — стабилизатор, сообщающий коллоидной системе устойчивость.
Образовывать коллоидные растворы в воде могут металлы, малорастворимые в ней оксиды, гидроксиды, кислоты, соли. Хорошо растворимые в воде вещества, но малорастворимые в неполярных органических растворителях не способны образовывать гидрозоли, но могут образовывать органозоли. Так, например, не возможно получить гидрозоль натрия хлорид, но возможно получение его коллоидного раствора в бензоле. И наоборот, можно легко получить гидрозоль камфоры, практически нерастворимой в воде, но невозможно получить ее коллоид в спирте, поскольку камфора хорошо растворима в этом растворителе.
В качестве стабилизаторов используют вещества, препятствующие агрегации коллоидных частиц в более крупные и выпадению их в осадок. Таким действием обладают: небольшой избыток одного из реагентов, из которых получается вещество дисперсной фазы, ПАВ, белки, полисахариды и др.
По размеру частиц дисперсной фазы коллоидные системы (d ≈10 -7 — 10 -9 м ) занимают промежуточное положение между микрогетерогенными (грубодисперсными) системами (d >10 -7 м ) и истинными растворами, (размер растворенных частиц d -9 м ) низкомолекулярных веществ. По способу достижения коллоидной степени дисперсности различают методы (рис. 12.1): диспергационные (от лат.disper-
| Грубодисперсная система | Коллоидно-дисперсная система | Истинный раствор |
| d>l(r 7 M | 10- 7 M10- 9 | d 9 M |
| ДИСПЕРГИРОВАНИЕ | КОНДЕНСИРОВАНИЕ |
Увеличение степени измельчения
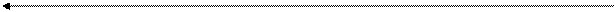
Рис.12.1 Способы достижения коллоидной степени дисперсности gire — измельчать) — получение частиц дисперсной фазы путем дробления более крупных частиц и конденсационные (от лат. condensire — укрупнять) — получение частиц дисперсной фазы путем объединения атомов, молекул, ионов
Методы диспергирования. Для измельчения жидкостей и твердых тел необходимо совершить работу. Эта работа тем больше, чем меньше размер частиц дисперсной фазы. Энергия, расходуемая при диспергировании, идет на преодоление молекулярных сил притяжения и на увеличение межфазной поверхности
Для достижения требуемой степени дисперсности применяют механическое дробление, ультразвуковое, электрическое и химическое диспергирование.
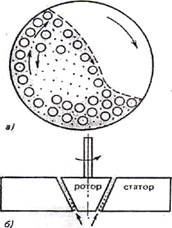
Механическое дробление осуществляют с помощью шаровых и коллоидных мельниц в присутствии жидкой дисперсионной среды и стабилизатора. Схема шаровой мельницы представлена на рис. 12.2, а. Шары измельчают материал дисперсной фазы при вращении за счет раздавливания, раскалывания и истирания.
Измельчение с помощью ультразвука происходит под действием источника ультразвуковых колебаний на смесь нерастворимых друг в друге жидкостей или твердого тела с жидкостью.
Электрическое диспергирование используют для получения золей металлов. К электродам, изготовленным из диспергируемого металла и опущенным в подщелоченную воду, подводят постоянный электрический ток и сближают электроды до образования электрической дуги. Металл, из которого изготовлены электроды, при этом превращается в пар, конденсирующийся в жидкой среде в золь. При получении органозолей (дисперсионная среда органический растворитель) применяют высокочастотный искровой заряд.
Химическое диспергирование, или пептизация, заключается в химическом воздействии на осадок.
Конденсационные методы. Взаимодействие ионов и молекул с образованием частиц коллоидных размеров может быть достигнута физическими и химическими методами.
Физическая конденсация имеет в своей основе физические методы воздействия. Чаще всего для получения золей используют метод замены растворителя. Вначале готовят истинный раствор вещества в летучем растворителе (например, канифоли в спирте) и добавляют к жидкости, в которой вещество нерастворимо (например, к воде). Летучий растворитель удаляют нагреванием. В результате происходит резкое понижение растворимости. Молекулы вещества конденсируются в частицы коллоидных размеров и образуется коллоидный раствор.

При химической конденсации для получения коллоидных растворов используют любые реакции, в результате которых образуются труднорастворимые соединения:
Источник
Диспергационные методы получения коллоидных систем
Диспергированием называют измельчение твердых или жидких тел в инертной среде, при котором резко повышается дисперсность и образуется дисперсная сис-тема, обладающая значительной удельной межфазной поверхностью. Диспергиро-вание – не самопроизвольный процесс. Оно требует затраты энергии на преодо-ление межмолекулярных сил при дроблении вещества. Диспергирование делится на физические и химические виды.
Различают 3 способа физического диспергирования.
Размалывание в коллоидных мельницах. При простом механическом дробле-нии или растирании образуются порошки с сравнительно большими размерами зёрен (т.е. грубодисперсные системы). Для получения коллоидных систем диспергирование проводят в коллоидных мельницах (первая коллоидная мельница сконструирована Плауссоном в 1920 г.).
| Лабораторные коллоидные (шаровые) мельницы (рис.1 А) представляют собой вращающий барабан, заполненный шарами из материалов с определенной твердостью (из стали, чугуна или фарфора). При враще-нии барабана шары перекатываются и своими много-кратными ударами, раскалыванием и растиранием измельчают вещество на все более мелкие частицы. Принцип действия промышленных коллоидных мель-ниц (рис.1 Б) основан на развитии достаточно больших разрывающих (истирающих) усилий в веществе под действием центробежной силы в узком зазоре между вращающим ротором и неподвижным статором. Дроб-ление осуществляют в присутствии жидкой диспер-сионной среды и стабилизатора. | 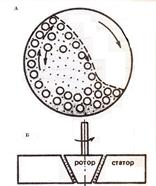 Рис.1. Схемы шаровой и коллоидной мельниц Рис.1. Схемы шаровой и коллоидной мельниц |
Коллоидные мельницы применяются для диспергирования минеральных красок, смазочных материалов (графит), пищевых веществ, фармацевтических препаратов (сера), сорбентов для хроматографии.
Дробление ультразвуком.Под действием звука большой частоты (15000-20000 Гц/с) происходит попеременное (быстро чередующееся) расширение и сжа-тие вещества, приводящее к разрушению частиц. Этот метод применим для веществ, у которых сравнительно небольшое взаимодействие между молекулами, например, для диспергирования жидкостей. Этим методом получают органозоли, коллоидные растворы серы, графит, гипс, крахмал, желатин, каучук и др. По этому способу получаются эмульсии, используемые при парэнтеральном питании больных (ожогами пищевода, раком желудка).
| Распыление электрической дугой. Для полу-чения золей металлов (серебра, золота, платины) электроды из соответствующего металла поме-щают в растворитель и пропускают ток большой силы. При этом в электрической дуге металл испаряется и его атомы, попав в окружающий чужеродный холодный растворитель, вытесняют-ся из окружения растворителя, конденсируются (объединяются) в более крупные частицы. Этот метод можно рассматривать и как конденсационный метод. | 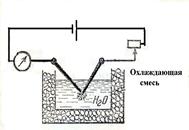 Рис.2. Схема прибора для получения золей металлов электрическим способом Рис.2. Схема прибора для получения золей металлов электрическим способом |
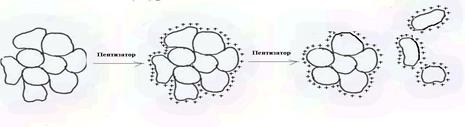
Химическое диспергирование (пептизация)
Перевод осадка, образовавшегося при коагуляции, в коллоидный раствор назы-вают химическим диспергированием. Термин был введён Т.Грэмом на основании чисто внешнего сходства процесса пептизации с растворением (перевариванием) белков под действием фермента желудочного сока пепсина.
Пептизация может происходить в результате промывания осадка растворите-лем или под действием специальных веществ – пептизаторов, которые представ-ляют собой сильные электролиты, образующиеся в результате химической реак-ции либо вводимые в раствор. При этом ионы пептизатора адсорбируются на по-верхности частиц рыхлого свежо образованного осадка, придают им определен-ный заряд. Благодаря этого частицы взаимно отталкиваются и наблюдается распад более крупных частиц осадка на мелкие. Таким образом происходит «химическое» раздробление вещества (см. рис. 3).
Рис.3. Механизм пептизации
Различают адсорбционную, химическую пептизации, промывание осадка растворителем. В случае адсорбционной пептизации осадок обрабатывают электролитом, содержащим ионы, способные к избирательной адсорбции на поверхности осадка (например, при обработке осадка Fe(OH)3 раствором FeCl3). В случае химической пептизации осадок вступает в химическое взаимодействие с небольшим количеством электролита (кислотой или щелочью), в результате которого образуется стабилизирующий электролит. Например, при частичной обработке осадка гидроксида железа (III) раствором соляной кислоты, протекает реакция Fe(OH)3 + HCl = FeOCl + 2H2O и образуется электролит, который диссоциирует на ионы: FeOCl 
| На поверхности осадка Fe(OH)3, в соответствии с правилом Панета-Фаянса (в результате химичес-кого сродства), адсорбируются ионы FeO + и при-дают ей положительный заряд. В результате элек-тростатического отталкивания одноименно заря-женных частей поверхности, наблюдается посте-пенное увеличение трещин (см. рис.4), что приво-дит к распаду агрегата осадка на более мелкие час-тицы. Процесс протекает до распада частиц на частицы коллоидных размеров. | 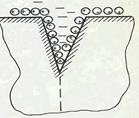 Рис.4 Схема расклинивающего действия адсорбированного слоя ионов пептизатора Рис.4 Схема расклинивающего действия адсорбированного слоя ионов пептизатора |
Промывание осадка растворителем осуществляют тогда, когда коллоидная система получена в присутствии значительного избытка одного из реагентов. Устойчивость системы достигается за счёт удаления некоторого избыточного количества электролита.
Дата добавления: 2015-11-12 ; просмотров: 2126 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Методы получения коллоидных растворов
Коллоидные растворы по размерам частиц занимают промежуточное положение между грубодисперсными и истинными. Поэтому выделяют две группы методов их получения:
1) дисперсионные (дробление грубодисперсных частиц до частиц коллоидной степени дисперсности);
2) конденсационные (укрупнение частиц истинных растворов в агрегаты коллоидных систем).
Эти группы методов, в свою очередь, делятся на физические и химические.
Самым распространённым из дисперсных химических методов получения золей является метод пептизации (процесс перевода осадка (гидроксида металла) в коллоидный раствор под действием диспергирующих средств).
В качестве пептизатора используют хорошо растворимую соль соответствующего металла. Например, мицелла золя гидроксида железа (III) Fe(OH)3 получается в присутствии пептизатора FeCl3 –сильного электролита:
nFeCl3 ↔ n Fe 3+ + 3nCl —
ядро адсорбционный слой диффузионный слой
гранула
мицелла
К конденсационным химическим методам относят:
1) метод обменной реакции, в ходе которой получается нерастворимое вещество, причём одно исходное вещество должно быть в избытке:
AgNО3 + KI → AgI ↓ + KNО3
nAgNО3 ↔ nAg + + n NO3‾
ядро адсорбционный слой дифф. слой
2) метод гидролиза, в результате которого получается нерастворимое соединение.
Fe(OH)3 + HCl → FeОCl + 2H2O
Продукт этой реакции – хлорокись железа(III) может диссоциировать и стабилизировать мицеллообразование.
FeOCl ↔ FeO + +Сl‾
3) метод окислительно-восстановительных реакций
5.4.Свойства коллоидных растворов
1. Молекулярно-кинетические свойства, общие для истинных и коллоидных растворов: осмос, осмотическое давление, диффузия, броуновское движение.
Но в коллоидных растворах эти процессы идут медленнее.
2. Оптические свойства – это специфические свойства, присущие только коллоидным растворам.
a) опалесценция — это явление рассеяния проходящего через коллоидный раствор света с изменением окраски золя.
b) эффект Фарадея-Тиндаля — явление изменения формы пучка проходящего через раствор света на конусовидную.
3. Электрические свойства
a) электрофорез — явление перемещения частиц дисперсной фазы в электрическом поле;
b) электроосмос — это явление перемещения частиц дисперсионной среды (растворителя) относительно неподвижной дисперсной фазы. Например, течение жидкости через капиллярные системы под влиянием разности потенциалов.
На этих свойствах основаны методы введения лекарственных препаратов через кожу.
4. Электрокинетические свойства характеризуют возникающие в мицелле потенциалы.
a) электротермодинамический (Е) потенциал — возникает на границе ядра и слоя потенциалопределяющих ионов. Величина этого потенциала постоянна и зависит от числа потенциалопределяющих ионов, у многих коллоидных растворов она достигает 1В.
b) электрокинетический ζ, (дзетта) потенциал — возникает на границе адсорбционного и диффузионного слоев. Величина ζ — потенциала пропорциональна числу ионов диффузионного слоя и ионной силе раствора.
Концентрация противоионов в диффузионном слое убывает от центра к периферии, ζ-потенциалв этом направлениитак же падает до нуля. Если все противоионы перейдут в адсорбционный слой, то ζ-потенциал станет равен 0.
Состояние системы, когда общий заряд её равен нулю, называется изоэлектрическим состоянием.
Коллоидные растворы являются термодинамически неустойчивыми.
Источник