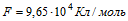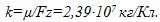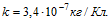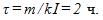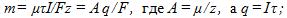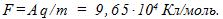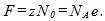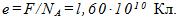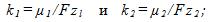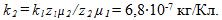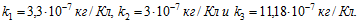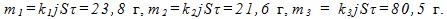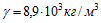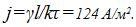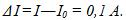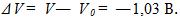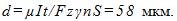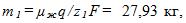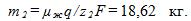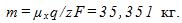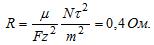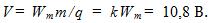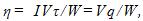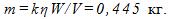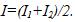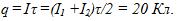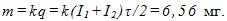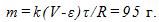Электролиз. Законы Фарадея
Дополнительно по теме
2 Электрическое поле
3 Постоянный электрический ток
Электролиз. Законы Фарадея
1 Найти электрохимический эквивалент натрия. Молярная масса натрия m = 0,023 кг/моль, его валентность z=1. Постоянная Фарадея
2 Цинковый анод массы m = 5 г поставлен в электролитическую ванну, через которую проходит ток I=2 А. Через какое время t анод полностью израсходуется на покрытие металлических изделий? Электрохимический эквивалент цинка
3 Найти постоянную Фарадея, если при прохож-дении через электролитическую ванну заряда q = 7348 Кл на катоде выделилась масса золота m = 5 г. Химический эквивалент золота А = 0,066 кг/моль.
Согласно объединенному закону Фарадея
4 Найти элементарный электрический заряд е, если масса вещества, численно равная химическому эквиваленту, содержит No=NA/z атомов или молекул.
Ионы в растворе электролита несут на себе число элементарных зарядов, равное валентности z. При выделении массы вещества, численно равной его химическому эквиваленту, через раствор проходит заряд, численно равный постоянной Фарадея, т. е.
Следовательно, элементарный заряд
5 Молярная масса серебра m1 =0,108 кг/моль, его валентность z1 = 1 и электрохимический эквивалент 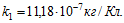
По второму закону Фарадея имеем
отсюда электрохимический эквивалент золота
Электролиз. Законы Фарадея
6 Найти массы веществ, выделившихся за время t=10ч на катодах трех электролитических ванн, вклю-ченных последовательно в сеть постоянного тока. Аноды в ваннах — медный, никелевый и серебряный — опущены соответственно в растворы CuSO4, NiS04 и AgN03. Плотность тока при электролизе j=40 А/м2, площадь катода в каждой ванне S= 500 см . Электрохимические эквиваленты меди, никеля и серебра
Ток в ваннах I=jS. По первому закону Фарадея массы выделившихся при электролизе веществ
7 При никелировании изделий в течение времени t = 2 ч отложился слой никеля толщины l=0,03 мм.
Найти плотность тока при электролизе. Электрохимический эквивалент никеля 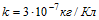
8 Амперметр, включенный последовательно с электролитической ванной, показывает ток Io=1,5А. Какую поправку надо внести в показание амперметра, если за время t=10мин на катоде отложилась масса меди m= 0,316 г? Электрохимический эквивалент меди 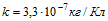
По первому закону Фарадея m = kIt, где I-ток в цепи; отсюда I=m/kt=1,6 А, т.е. в показание амперметра надо внести поправку
9 Желая проверить правильность показаний вольтметра, его подключили параллельно резистору с известным сопротивлением R= 30 Ом. Последовательно в общую цепь включили электролитическую ванну, в которой ведется электролиз серебра. За время t=5 мин в этой ванне выделилась масса серебра m = 55,6 мг. Вольтметр показывал напряжение Vo = 6 В. Найти разность между показанием вольтметра и точным значением падения напряжения на резисторе. Электрохимический эквивалент серебра 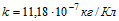
По первому закону Фарадея m = klt, где I-ток в цепи. Точное значение падения напряжения на сопротивлении V=IR = mR/kt= 4,91 В. Разность между показанием вольтметра и точным значением падения напряжения
10 Для серебрения ложек через раствор соли серебра в течение времени t=5 ч пропускается ток I=1,8 А. Катодом служат n=12 ложек, каждая из которых имеет площадь поверхности S=50 см2. Какой толщины слой серебра отложится на ложках? Молярная масса серебра m = 0,108 кг/моль, его валентность z=1 и плотность 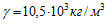
11 Две электролитические ванны включены последовательно. В первой ванне находится раствор хлористого железа (FeCl2), во второй — раствор хлорного железа (FeCl3). Найти массы выделившегося железа на катодах и хлора на анодах в каждой ванне при прохождении через ванну заряда 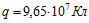
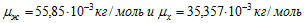
В первой ванне железо двухвалентно (z1=2), во второй — трехвалентно (z2 = 3). Поэтому при прохождении через растворы одинаковых зарядов выделяются различные массы железа на катодах: в первой ванне
во второй ванне
Так как валентность атомов хлора z=1, то на аноде каждой ванны выделяется масса хлора
12 При электролизе раствора серной кислоты (CuSO4) расходуется мощность N=37 Вт. Найти со-противление электролита, если за время t = 50 мин выделяется масса водорода m = 0,3 г. Молярная масса водорода m = 0,001 кг/моль, его валентность z=1.
13 При электролитическом способе получения никеля на единицу массы расходуется Wm= 10 кВтЧч/кг электроэнергии. Электрохимический эквивалент никеля 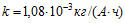
14 Найти массу выделившейся меди, если для ее получения электролитическим способом затрачено W= 5 кВтЧч электроэнергии. Электролиз проводится при напряжении V=10 В, к.п.д. установки h=75%. Электрохимический эквивалент меди 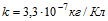
где q-заряд, прошедший через ванну. Масса выделившейся меди m=kq; отсюда
15 Какой заряд проходит через раствор серной кислоты (CuSO4) за время t=10с, если ток за это время равномерно возрастает от I1=0 до I2 = 4А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди 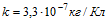
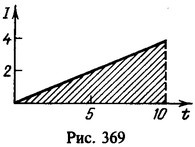
Заряд, протекший через раствор,
Нахождение заряда графическим путем показано на рис. 369. На графике зависимости тока от времени заштрихованная площадь численно равна заряду. Масса меди, выделившейся на катоде,
16 При рафинировании меди с помощью электролиза к последовательно включенным электролитическим ваннам, имеющим общее сопротивление R = 0,5 Ом, подведено напряжение V=10 В. Найти массу чистой меди, выделившейся на катодах ванны за время t=10ч. Э.д.с. поляризации e= 6 В. Электрохимический эквивалент меди 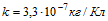
17 При электролизе воды через электролитическую ванну в течение времени t = 25 мин шел ток I=20 А. Какова температура t выделившегося кислорода, если он находится в объеме V= 1 л под давлением р = 0,2 МПа? Молярная масса воды m=0,018 кг/моль. Электрохимический эквивалент кислорода 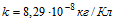
где R= 8,31 Дж/(молъ К)-газовая постоянная.
18 При электролитическом способе получения алюминия на единицу массы расходуется W1m = 50 кВтЧч/кг электроэнергии. Электролиз проводится при напряжении V1 = 16,2 В. Каким будет расход электроэнергии W2m на единицу массы при напряжении V2 = 8,1 В?
Источник
Урок физики «Электролиз. Законы Электролиз. Применение электролиза»
Описание разработки
Образовательная: ввести определения понятий: электролиты, электролитическая диссоциация, степень диссоциации; Рассмотреть явление электролиза; рассмотреть законы Фарадея; применение электролиза в технике.
Развивающая: Способствовать дальнейшему развитию логического мышления учащихся – формированию умения сравнивать, обобщать, давать творческое обоснование.
Воспитывающая: Продолжить: формирование научного мировоззрения; воспитание положительного отношения к получению знаний, уверенности в своих силах; чувства ответственности за свои действия, чувства коллективизма.
Виды самостоятельной работы на уроке:составление кластеров, решение кроссвордов и задач Сабақтың
Материально — техническое оснащение урока Интерактивная доска, электронный учебник, сборник задач по физике (многовариантный), плакаты, презентации.
Содержание и ход урока:
Урок проходит в виде заседания малого совета. Выбирается спикер. Группа делится предварительно на 3 подгруппы (фракции от партий у каждой команды – свой лидер, свои мандаты для голосования).
Организационная часть ( _5мин____ ___)
Здравствуйте, уважаемые господа депутаты я пригласила вас на свой урок по физике на тему : (написано на доске). Цель нашего с вами урока: (написано на доске).
Проверка домашнего задания: Ориентировочно — мотивационный.
Проходит в виде зарисовки кластеров и отгадывания кроссворда.
На прошлых заседаниях мы вам давали домашнее задание по темам: электрическое поле. напяженность поля, силовые линии поля, электроемкость проводника , конденсатор и виды их соединения, электрические заряды, з — н Кулона, з — н Ома для участка цепи, з — н Ома для полной (замкнутой)цепи. А теперь повторим немного из проиденных тем.
1 задание построить класстеры на выданное задание и непоказывая их конкуренту отдать другим группам для того, чтобы они по вашим кластерам отгадали данный закон:
Два точечных неподвижных зарядав вакууме взаимодействуют друг с другом с силой, прямо пропорциональной произведению модулей этих зарядов и обратно пропорциональной квадрату расстояния между ними. (закон Кулона).
Сила тока, текущего по участку цепи, прямо пропорционально напряжению на его концах и обратно пропорциональноего тэлектрическому сопротивлению. (закон Ома для участка цепи).
Сила тока в замкнутой цепи прямо пропорциональна электродвижущей силе источника тока и обратно пропорционально полному сопротивлению цепи, равному сумме сопротивлений проводникаи внутреннему сопротивлению. (закон Ома для полной цепи).
2 задание: вопросы от каждой фракции депутатов другой фракции:
Что такое электрический ток?
Что представляет собой электрический ток в металлах?
Кто и когда открыл явление сверхпроводимости?
Дать определение сверхпроводимости.
Проводники первого рода — о чем речь.
Дать формулировку закона Джоуля — Ленца?
- численная величина заряда которую необходимо сообщить проводнику, чтобы изменить его потенциал на 1 вольт (электроемкость)
- Силовые ___________(линии)
- Часто для практических целей конденсаторы соединяют в _____________. (батареи)
- _____________– это система двух или нескольких разноименно заряженных проводников с равными по величине зарядами, разделенных тонким слоем диэлектрика. (Конденсатор)
- Явления трения или соприкосновения двух разнородных тел (электризация)
- Тела, непроводящие электрические заряды (диэлектрики)
- Величина, измеряемая работой тока, совершаемой за единицу времени. (Мощность)
- ______________ электростатического поля в данной точке численно равен работе, выполняемой силами поля при перемещении положительного заряда из данной точкуи в бесконечность. (потенциал)
Источник