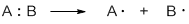- Механизмы реакций в органической химии
- Механизмы разрыва химических связей в органических реакциях
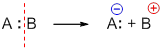
- При гетеролитическом способе разрыва ковалентной связи образуются
- Типы разрыва ковалентной связи
- Урок 6. Классификация реакций в органической химии
- Энергия связи (Eсв), ккал/моль
- Классификация по направлению реакции
- Классификация реакций по характеру изменения связей (по механизмам)
- Ответы на упражнения к теме 1
- Урок 6
Механизмы реакций в органической химии
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии.
Механизмы разрыва химических связей в органических реакциях
| Гомолитический разрыв связи – это такой разрыв химической связи, когда каждый атом получает при разрыве связи по одному электрону из общей электронной пары. |
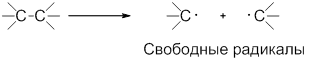
Образующиеся при этом частицы — это свободные радикалы.
| Свободные радикалы – это частицы, каждая из которых содержит один неспаренный электрон. A:B → A∙ + ∙B Гомолитический разрыв связи характерен для слабо полярных или неполярных связей. Условия протекания радикальных реакций:
Например , взаимодействие метана с хлором протекает по цепному радикальному механизму. То есть реакция протекает как цепь последовательных превращений с участием свободных радикалов. Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат один или несколько неспаренных электронов. Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом. Этапы радикально-цепного процесса: Стадия 1. Инициирование цепи. Под действием кванта света или при нагревании молекула галогена распадается на радикалы: Cl:Cl → Cl⋅ + ⋅Cl Стадия 2. Развитие цепи. Радикалы взаимодействуют с молекулами с образованием новых молекул и радикалов. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с молекулой хлора: CH4 + ⋅Cl → CH3⋅ + HCl Стадия 3. Обрыв цепи. При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами. При этом образуются молекулы, т.е. радикальный процесс обрывается. Могут столкнуться разные радикалы, в том числе два метильных радикала:
При гетеролитическом разрыве связи образуются ионы – положительно заряженный катион и отрицательно заряженный анион. A:B → A: – + B +
Гетеролитический (ионный) механизм характерен для полярных и легко поляризуемых связей. Условия протекания ионных реакций:
Присоединение галогеноводородов (гидрогалогенирование). Например, этилен взаимодействует с бромоводородом: Реакция протекают по механизму электрофильного присоединения в несколько стадий. I стадия. Электрофилом является протон Н + в составе бромоводорода. Катион водорода присоединяется к атому углерода при двойной связи и образуется карбокатион . На втором атоме углерода, который потерял электроны π-связи, образуется положительный заряд: II стадия. Карбокатион взаимодействует с анионом Br – : При присоединении галогеноводородов и других полярных молекул к симметричным алкенам образуется одно вещество. Например , при присоединении бромоводорода к этилену образуется только бромэтан. При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Например , при взаимодействии хлороводорода HCl с пропиленом атом водорода присоединяется преимущественно к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. При этом 1-хлорпропан образуется в незначительном количестве: В некоторых случаях присоединение к двойным связям происходит против правила Марковникова. Исключения из правила Марковникова: 1) Если в молекуле присутствует заместитель, который оттягивает на себя электронную плотность двойной связи. Например , при взаимодействии 3-хлорпропена с хлороводородом HCl преимущественно образуется 1,3-дихлорпропан. Атом хлора смещает к себе электронную плотность, поэтому π-электронная плотность двойной связи смещена к менее гидрогенизированному атому углерода: 2) Если в реакционной системе присутствуют свободные радикалы или источники свободных радикалов, то реакция присоединения полярных молекул вида НХ к двойной связи протекает по радикальному механизму против правила Марковникова. Например , при присоединении бромоводорода к пропилену в присутствии пероксидов (H2O2 или R2O2) преимущественно образуется 1-бромпропан: Источник При гетеролитическом способе разрыва ковалентной связи образуются
Химия3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа Типы разрыва ковалентной связиРазрыв ковалентной связи может происходить по гомолитическому или гетеролитическому механизмам. Гомолитические реакции – реакции, в которых разрыв связи происходит симметрично, так что каждому из образующихся фрагментов отходит по одному электрону: Гомолиз от греческого homos – одинаковый, lysis – разрыв. В ходе гомолитических реакций в качестве интермедиатов образуются свободные радикалы – частицы, содержащие неспаренный электрон, например: Радикал – атом или группа атомов, имеющие неспаренный электрон. Гетеролитические реакции – реакции, в которых разрыв связи происходит несимметрично, так что пара электронов связи остается у одного из образующихся фрагментов: Гетеролиз – это несимметричный разрыв ковалентной связи, в результате которого образуются разные по природе частицы: катион и анион. Если заряды в таких частицах находятся на атоме углерода, их называют – карбокатионы и карбанионы, например: Электронная пара остается у более электроотрицательного атома. Источник Урок 6. Классификация реакций |
| Разрываемая связь | Eсв при гомолизе (А : В  А• + В•) А• + В•) | Eсв при гетеролизе (А : В  А + + :В — ) А + + :В — ) |
|---|---|---|
| Н–Н | 104 | 401 |
| Н–Сl | 103 | 334 |
| Н–Вr | 88 | 324 |
| Сl–Cl | 58 | – |
| Вr–Вr | 46 | – |
| СН3–Н | 104 | 313 |
| СН3–Cl | 84 | 227 |
| СН3–Вr | 70 | 219 |
| СН3–СН3 | 88 | – |
| С6Н5–Сl | 86 | 219 |
Органические реакции классифицируют:
1) по направлению реакции (замещение, присоединение, отщепление);
2) по характеру изменения связей (по механизмам).
Классификация по направлению реакции
Реакции замещения 2 :
R–Н + Сl–Cl 
R–Cl + OH – 
Реакции присоединения (по кратным связям):
Реакции отщепления (элиминирования) с образованием кратных связей:
Каким типам реакций соответствуют изображенные ниже процессы?
 |  |
Классификация реакций по характеру изменения связей
(по механизмам)
Механизм реакции предполагает детальное постадийное описание химических реакций. При этом устанавливают, какие именно ковалентные связи разрываются, в каком порядке и каким путем. Столь же тщательно описывают образование новых связей в процессе реакции.
Рассматривая механизм реакции, прежде всего обращают внимание на способ разрыва ковалентной связи в реагирующей молекуле. Таких способов два – гомолитический и гетеролитический.
Схема гомолитического и гетеролитического
разрывов ковалентной связи
Радикальные реакции протекают путем гомолитического (радикального) разрыва ковалентной связи:
Радикальному разрыву подвергаются неполярные или малополярные ковалентные связи
(С–С, N–N, С–Н) при высокой температуре или под действием света. Углерод в радикале СН3• имеет 7 внешних электронов (вместо устойчивой октетной оболочки в СН4). Радикалы неустойчивы, они стремятся захватить недостающий электрон (до пары или до октета). Один из способов образования устойчивых продуктов – димеризация (соединение двух радикалов):
СН3 • + • СН3 
Н • + • Н 
Радикальные реакции – это, например, реакции хлорирования, бромирования и нитрования алканов:
Ионные реакции протекают с гетеролитическим разрывом связи. При этом промежуточно образуются короткоживущие органические ионы – карбкатионы и карбанионы – с зарядом на атоме углерода. В ионных реакциях связывающая электронная пара не разъединяется, а целиком переходит к одному из атомов, превращая его в анион:
К гетеролитическому разрыву склонны сильно полярные (Н–O, С–О) и легко поляризуемые (С–Вr, С–I) связи.
Различают нуклеофильные реакции (нуклеофил – ищущий ядро, место с недостатком электронов) и электрофильные реакции (электрофил – ищущий электроны). Утверждение, что та или иная реакция является нуклеофильной или электрофильной, условно всегда относится к реагенту.
Реагент – участвующее в реакции вещество с более простой структурой.
Субстрат – исходное вещество с более сложной структурой.
Уходящая группа – это замещаемый ион, который был связан с углеродом.
Продукт реакции – новое углеродсодержащее вещество (записывается в правой части уравнения реакции).
К нуклеофильным реагентам (нуклеофилам) относят отрицательно заряженные ионы, соединения с неподеленными парами электронов, соединения с двойными углерод-углеродными связями.
К электрофильным реагентам (электрофилам) относят положительно заряженные ионы, соединения с незаполненными электронными оболочками (АlCl3, ВF3, FeCl3), cоединения с карбонильными группами, галогены. Электрофилы – любые атом, молекула или ион, способные присоединить пару электронов в процессе образования новой связи.
Движущая сила ионных реакций – взаимодействие противоположно заряженных ионов или фрагментов разных молекул с частичным зарядом (

Примеры ионных реакций разных типов.
Нуклеофильное замещение:
Электрофильное замещение:
Нуклеофильное присоединение (сначала присоединяется CN – , потом Н + ):
Электрофильное присоединение (сначала присоединяется Н + , потом Х – ):
Элиминирование при действии нуклеофилов (оснований):
Элиминирование при действии электрофилов (кислот):
Упражнения.
1. Для следующих ниже реакций укажите, какие связи разрываются и какие новые связи образуются:
| № реакции | Разрываются связи | Образуются связи |
|---|---|---|
| 1 | ||
| 2 | ||
| 3 |
2. Какой состав смеси монобромидов, образовавшихся при бромировании изобутана
(СН3)2СНСН3, если известно, что отношение реакционных способностей С–Н-связей в этой реакции у первичного, вторичного и третичного атомов углерода равно 1:82:1600?
3. Какие радикалы теоретически могут образоваться при гомолитическом разрыве связей в соединениях:
4. Из предложенных ниже реакций определите реакции замещения, реакции присоединения, реакции элиминирования:
5. В приведенных ниже соединениях у элементов, разность электроотрицательностей которых равна 0,5 или более, обозначьте частичные заряды 

6. Сколько 

7. Выберите из приведенных ниже частиц карбкатионы и карбанионы:
8. Какие из приведенных частиц и молекул являются нуклеофилами (обозначьте Nu) и какие электрофилами (Е):
9. Для приведенных ниже реакций укажите: а) субстрат; б) реагент; в) продукт реакции;
г) уходящую группу. Определите реакции: нуклеофильного замещения (NuS), электрофильного присоединения (ЕАd), элиминирования под действием оснований (ЕlNu) и элиминирования под действием кислот (ЕlE).
10. Укажите, какие реакции протекают по радикальному механизму, а какие по ионному:
Ответы на упражнения к теме 1
Урок 6
1.
| № реакции | Разрываются связи | Образуются связи |
|---|---|---|
| 1 | С–Н и Cl–Cl | C–Cl и Н–Сl |
| 2 |  | C–H и C–Cl |
| 3 | C–Cl и K + OH – | C–OH и K + Cl – |
2. В молекуле (СН3)2СНСН3 девять первичных атомов Н и один третичный Н. С учетом разной реакционной способности связей С–Н соотношение продуктов монобромирования: (СН3)2СНСН2Вr/(СН3)2СВrСН3 = 9/1600 

3. При гомолитическом разрыве связей в принципе могут образоваться радикалы:
Источник