- Аналитическая химия
- Лабораторная работа № 1. Анализ катионов первой аналитической группы
- Анализ катионов I аналитической группы
- Оглавление
- 1. Общая характеристика катионов I аналитической группы
- 2. Реакции обнаружения катионов I аналитической группы
- 2.1 Реакции К + — ионов
- 2.2 Реакции Na + -ионов
- 2.3 Реакции NH4 + -ионов
Аналитическая химия
Лабораторная работа № 1. Анализ катионов первой аналитической группы
Анализ катионов I аналитической группы
Оглавление
1. Общая характеристика катионов I аналитической группы
К катионам I группы относят ионы щелочных металлов (K + , Na + , Li + ) и NH4 + .
Катионы щелочных металлов имеют законченные 2- или 8-электронные оболочки, подобные оболочкам инертных (благородных) газов. На внешнем электронном уровне находится 1 электрон, поэтому в сложных (гетероатомных) соединениях они проявляют только одну степень окисления +1. Для них характерны соединения с ионной связью (вспомните, NaCl, KNO3) хорошо растворимые в воде, поэтому I группа не имеет группового реагента.
В водных растворах ионы щелочных металлов бесцветны, поскольку они не поглощают кванты света в видимой области спектра. Другое дело атомы щелочных металлов, образующиеся из ионов при нагревании в пламени горелки. Для перехода из основного в возбужденное состояние (переход электрона на более высокий энергетический уровень) атомам щелочных металлов необходима сравнительно небольшая энергия. Примерно через 10 −8 с, происходит переход в основное состояние (электрон возвращается на нижний энергетический уровень).
За счет выделения избыточной энергии в видимой области спектра пламя становится карминово-красным (Li + ), желтым (Na + ) или фиолетово-розовым (K + ).
Большинство образуемых этими элементами солей хорошо растворимы в воде. Особенно важна для анализа растворимость в воде их сульфидов, гидроксидов, карбонатов и хлоридов, что отличает первую группу катионов от всех остальных аналитических групп. Аналогично ведут себя и соли аммония.
Водные растворы солей катионов I группы бесцветны.
2. Реакции обнаружения катионов I аналитической группы
Цель работы: Изучение реакций обнаружения катионов I аналитической группы.
В ходе работы студенты получают практические навыки выполнения аналитических реакций, характерных для катионов I аналитической группы, осуществления контроля за кислотностью реакционной среды и температурными условиями протекания реакций, правильного и безопасного использования центрифуги для отделения осадков, проведения микро- кристаллоскопического анализа.
Полученные знания и умения необходимы при проведении анализа образца неизвестного состава, в частности, при выполнении контрольной работы № 1.
Водные растворы солей катионов I группы бесцветны.
2.1 Реакции К + — ионов
1. Реакция с гексанитрокобальтиатом (III) натрия
Гексанитрокобальтиат (III) натрия (кобальтинитрит натрия) Na3[Co(NO2)6] образует с ионами калия в нейтральной или слабокислой (рН = 5) среде желтый осадок преимущественного состава K2Na[Co(NO2)6]:
Выполнение реакции:
1-2 капли раствора соли калия помещают в коническую пробирку и добавляют 1-2 капли раствора кобальтинитрита натрия и, если осадок не выпадет, дают постоять 2-3 минуты. Образуется хорошо различимый осадок желтого цвета, который отделяют от раствора на центрифуге.
ВНИМАНИЕ. Для проведения реакции следует использовать только свежеприготовленный раствор реагента (темно-желтого цвета); розовый цвет раствора свидетельствует о том, что реагент разложился и не пригоден для анализа.
При малой концентрации ионов K + осадок может не образоваться. В этом случае рекомендуется реакционную смесь охладить под струей водопроводной воды и потереть внутренние стенки пробирки стеклянной палочкой. Наличие после центрифугирования на дне пробирки желтого пятна осадка указывает на присутствие ионов калия.
Ион аммония образует аналогичный желтый осадок (NH4)2Na[Co(NO2)6], отличие его от соответствующего соединения калия заключается в том, что он разлагается при нагревании. Реакцию следует проводить при нагревании, или в присутствии NH4 + обнаружение ионов калия проводят по п.2. Остальные катионы первой и второй групп проведению этой реакции не мешают.
2. Обнаружение K + -ионов в присутствии ионов NH4 + .
При обнаружении ионов калия в присутствии ионов аммония последние необходимо удалить, переведя их в гексаметилентетрамин (уротропин) действием формальдегида в щелочной среде (рН 10):
Выполнение реакции:
В коническую пробирку помещают по 2-3 капли растворов солей калия и аммония, 5-6 капель формалина (40 % раствор формальдегида) и 1 каплю фенолфталеина. Затем осторожно по каплям добавляют раствор Na2CO3 до появления устойчивой красной окраски индикатора, что указывает на сильно щелочную среду (рН > 10), и полученную реакционную смесь около минуты нагревают на водяной бане. Затем раствор охлаждают под водопроводной водой, подкисляют уксусной кислотой до исчезновения красной окраски (рН = 5) и к 2-3 каплям полученного раствора добавляют 2-3 капли раствора кобальтинитрита натрия. Наблюдают образование желтого осадка по реакции. Если осадок не образуется, то потирают стенки пробирки стеклянной палочкой до помутнения раствора и отделяют выделившийся осадок на центрифуге.
Гидротартрат натрия, NaHC4H4O6 образует с ионом К + белый кристаллический осадок КНС4Н4О6, растворимый в НCl, КОН, в воде при нагревании и нерастворимый в СН3СООН. Мешает ион NH4 + , образующий белый осадок с аналогичными свойствами.
Выполнение реакции:
В пробирку внесите 5 капель раствора КСl, 5 капель раствора реагента. Для ускорения реакции можно потереть стенки пробирки палочкой с тупым кончиком. Убедитесь, что выпавший осадок кристаллический – быстро оседает на дно пробирки.
Разделите содержимое пробирки на 4 части, перенеся 3 части капилляром в 3 чистые пробирки, и
– к 1-ой добавьте 5 капель воды и поставьте в горячую водяную баню – осадок растворился – почему?
• растворимость большинства веществ с повышением температуры увеличивается.
– ко 2-ой добавьте 5 капель 2М НСl – осадок растворился – почему?
• HCl – кислота более сильная, чем винная H2C4H4O6. Осадок растворяется,
так из-за образования более слабой кислоты H2C4H4O6 равновесие осадок ↔ раствор смещается вправо.
– к 3-ей добавьте 5 капель 2М CH3COOH – осадок не растворился – почему?
– к 4-ой добавьте 5 капель 2 М KОН – осадок растворился – почему?
• в результате реакции
образуется слабый электролит – H2O и равновесие осадок ↔ раствор смещается вправо.
Условия обнаружения иона К + :
а) достаточно большая концентрация К + в растворе;
б) нейтральная или слабокислая (pH 4- 7) среда;
в) комнатная температура;
г) отсутствие иона NH4 + .
4. Микрокристаллоскопическая реакция.
“Тройной нитрит”, Na2PbCu(NO2)6, реагент ярко-зеленого цвета, образует с ионом К + черные кубические кристаллы. Для ускорения реакции можно добавить несколько кристалликов твердого NaNO2.
Определению мешает NH4 + , так как он образует аналогичные черные кубические кристаллы.
Выполнение реакции:
На предметное стекло поместите 1 каплю раствора KCl, на некотором расстоянии от нее 1 каплю раствора NH4Cl, подсушите на воздухе. К обеим каплям прибавьте по 1капле реагента. Рассмотрев под микроскопом края капель, убедитесь, что образовавшиеся кристаллы идентичны.
Условия обнаружения иона К + : отсутствие иона NH4 + .
Платинохлористводородная кислота H2[PtCl6] дает в достаточно концентрированных растворах солей калия желтый кристаллический осадок хлороплатината калия:
Выполнение реакции:
В пробирку внесите 5 капель раствора КСl и 5 капель раствора реагента. Для ускорения реакции можно потереть стенки пробирки палочкой с тупым кончиком. Убедитесь, что выпавший осадок кристаллический – быстро оседает на дно пробирки.
Ион аммония дает аналогичный осадок.
6. Хлорная кислота HClO4 дает белый осадок перхлората калия:
Выполнение реакции:
1-2 капли раствора соли калия помещают в пробирку, добавляют 3 капли хлорной кислоты. Наблюдают образование белого осадка.
7. Реакция окрашивания пламени.
Выполнение реакции:
Чистую нихромовую проволочку смочите раствором КСl и внесите в пламя горелки (не забудьте, горячая зона пламени находится в верхнем конусе). Пламя окрасится в фиолетовый цвет.
Мешает Na + , окрашивающий пламя в интенсивный желтый цвет, но если рассматривать окраску пламени через индиговую призму (темно-синее стекло), Na + не мешает.
2.2 Реакции Na + -ионов
1. Реакция с цинкуранилацетатом (микрокристалоскопическая).
Цинкуранилацетат (раствор Zn(UO2)3(CH3COO)8 в разбавленной уксусной кислоте) образует с ионами натрия желтый осадок натрийцинкуранилацетата тетраэдрической и октаэдрической формы:
Выполнение реакции:
На чистое и сухое предметное стекло помещают 1 каплю раствора хлорида натрия, 1 каплю воды и 1 каплю раствора цинкуранилацетата
Осторожно смешивают капли стеклянной палочкой и через 2-3 минуты рассматривают под микроскопом форму образовавшихся кристаллов, которые представляют собой правильные октаэдры или тетраэдры желтоватого цвета (рис.2).
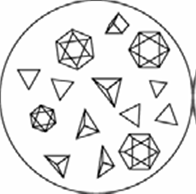
Эта реакция специфична для ионов натрия, присутствие других катионов I и II аналитических групп не мешает его обнаружению.
2. Реакция с дигидроантимонатом калия.
Дигидроантимонат калия KH2SbO4 (кислая калиевая соль ортосурьмяной кислоты H3SbO4) дает с растворами солей натрия белый кристаллический осадок дигидроантимоната натрия:
Выполнение реакции:
Для выполнения реакции к 2-3 каплям раствора соли натрия нужно прибавить равный объем раствора реагента и потереть стенки пробирки стеклянной палочкой. Убеждаются в том, что осадок кристаллический (Важный признак NaH2SbO4! По выпадению аморфного осадка нельзя делать заключения о присутствии Na + в растворе). Для этого раствор оставляют на некоторое время, чтобы осадок успел сформироваться, затем закрывают отверстие пробирки пробкой и переворачивают пробирку. На стенках будут заметны крупные кристаллы кубической формы.
При выполнении рассматриваемой реакции должны соблюдаться следующие условия:
а) достаточно большая концентрация соли натрия;
б) нейтральная реакция исследуемого раствора (рН ≈ 7);
в) ведение реакции на холоду, поскольку растворимость NaH2SbO4 сильно возрастает с повышением температуры.
г) отсутствие иона NH4 + .
3. Реакция окрашивания пламени.
Выполнение реакции:
Чистую нихромовую проволочку смочите раствором NaCl и внесите в пламя горелки. Появится интенсивная, долго неисчезающая желтая окраска.
2.3 Реакции NH4 + -ионов
1. Реакция со щелочью
Едкие щелочи (NaOH, KOH) выделяют из растворов солей аммония при нагревании газообразный аммиак:
Выполнение реакции:
2-3 капли раствора соли аммония вносят в пробирку, осторожно, не касаясь стенок пробирки, добавляют 3-4 капли раствора NaOH или KOH, закрывают пробирку ватным тампоном и кладут сверху полоску универсальной индикаторной бумаги, смоченную дистиллированной водой.
Пробирку с полученной реакционной смесью нагревают на водяной бане, и выделяющийся аммиак обнаруживают по посинению универсальной индикаторной бумаги. Обнаружить аммиак можно также по запаху.
Реакция чувствительна, специфична и позволяет дробно обнаруживать ион аммония в присутствии катионов всех аналитических групп.
2. Реакция с реактивом Несслера.
Реактив Несслера (раствор K2[HgI4] в KOH) в присутствии NH4 + -ионов образует характерный красно-бурый осадок:
Выполнение реакции:
1-2 капли раствора соли аммония помещают в пробирку, добавляют 5 капель воды и 2-3 капли реактива Несслера. Наблюдают образование красно-бурого осадка.
Проведению реакции мешают катионы других аналитических групп, образующие окрашенные осадки гидроксидов. Реакция очень чувствительная, однако, менее специфична, чем реакция со щелочью.
Изучив важнейшие качественные реакции NH4 + , выясним как он относится к действию реагентов, применяемых при обнаружении К + и Na + . Это необходимо для понимания систематического хода анализа смеси катионов I группы.
а) NaHC4H4O6, Na3[Co(NO2)6], Na2PbCu(NO2)6 дают с NH4 + соответствующие осадки, по виду неотличимые от осадков, образуемых К + . Убедитесь в этом на опыте (для выполнения реакции с NaHC4H4O6 следует брать достаточно концентрированный (насыщенный) раствор NH4Cl). Следовательно присутствие NH4 + мешает обнаружению К + .
б) KH2SbO4 при взаимодействии с растворами солей аммония вследствие присущей им (благодаря гидролизу) кислой реакции может выделить белый аморфный осадок HSbO3, образующийся по уравнениям:
Следовательно, присутствие NH4 + мешает также и обнаружению Na + этой реакцией.
Однако, применяя микрокристаллоскопическую реакцию с цинкуранилацетатом, Na + можно обнаружить в присутствии NH4 + .
Вывод: ион NH4 + мешает обнаружению К + и Na + , поэтому:
а) присутствие NH4 + в растворе следует установить, прежде чем приступить к обнаружению К + и Na + ;
б) если ион NH4 + обнаружен, он должен быть полностью удален из раствора.
Способов удаления NH4 + много. Для удаления иона аммония обычно пользуются летучестью его солей при нагревании. Рассмотрим один из них, простой и надежный.
Анализируемый раствор досуха выпаривают в фарфоровой чашечке на
песочной бане, прибавляют 2-3 капли HNO3 (1:1) и вновь выпаривают досуха.
При повышенной температуре протекает реакция,
в результате которой, NH4NO3 необратимо разлагается с образованием летучих продуктов – N2O и H2O.
Полагается проверить полноту протекания реакции. Для этого сухой остаток растворяют в небольшом количестве воды и, взяв каплю полученного раствора, выполняют реакцию обнаружения NH4 + с помощью реактива Несслера (см. ниже). Если реакция положительная, раствор в чашечке выпаривают досуха, обрабатывают cухой остаток HNO3 и вновь проверяют полноту удаления NH4 + .
Источник






