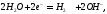- Потенциометрическое определение тиосульфата натрия
- Методика
- Расчет результатов
- Кулонометрия. Кулонометрические методы анализа
- Методы определения количества электричества
- ОПРЕДЕЛЕНИЕ ТИОСУЛЬФАТА МЕТОДОМ КУЛОНМЕТРИЧЕСКОГО ТИТРОВАНИЯ
- Условия кулонометрических определений:
- Определение тиосульфата натрия методом кулонометрического титрования
- Методика
- Контрольная задача. Определение содержания тиосульфата натрия в анализируемом образце
- Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- Оформление лабораторного журнала
- Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
Потенциометрическое определение тиосульфата натрия
Определение основано на установлении точки эквивалентности при титровании раствора тиосульфата натрия раствором йода по резкому изменению потенциала системы. В качестве индикаторного используют платиновый электрод, электрод сравнения — хлорсеребряный.
Методика
В стакан вместимостью 50 см 3 помещают 2-4 см 3 анализируемого раствора (индивидуальное задание), магнитный стержень, дистиллированную воду до объема обеспечивающего условия работы.
Бюретку заполняют 0,01 моль/дм 3 раствором йода, закрепляют штатив. Стакан с анализируемым раствором устанавливают на столик электромагнитной мешалки, погружают в раствор электроды и приступают к титрованию.
Проводят ориентировочное и точное титрования согласно общим указаниям. Результаты измерений заносят в таблицы аналогично таблицам 19 и 20. Объём раствора иода, израсходованный на титрование, определяют одним из графических способов нахождения точки эквивалентности.
Расчет результатов
Содержание вещества (г) и массовую долю (%) рассчитывают по титриметрическим формулам.
Кулонометрия. Кулонометрические методы анализа
Кулонометрические методы анализа основаны на измерении количества электричества, израсходованного при электролизе на количественное окисление или восстановление анализируемого вещества.
Метод использует объединённый закон Фарадея:
— m — масса определяемого вещества, г;
— М — молярная масса определяемого вещества, г/моль;
— Q — количество электричества, Кл (Ф);
— F — число Фарадея, 96493 Кл моль -1 ;
— n — число электронов, участвующих в реакции.
По способу выполнения различают прямую и косвенную кулонометрию, по технике выполнения – потенциостатическую (Е = const) и амперостатическую (I = const).
Методы прямой и косвенной кулонометрии отличаются по аппаратурному оформлению и технике определения. Прямую кулонометрию обычно проводят при контролируемом потенциале, косвенную – при постоянном значении тока.
Прямая кулонометрия используется в основном в потенциостатическом режиме для определения электроактивных веществ (тяжёлых металлов или анионов), и непосредственно подвергающихся электролизу на одном из электродов. Устанавливают на рабочем электроде потенциал разложения Еразл анализируемого вещества и поддерживают его постоянным. В процессе электролиза концентрация электроактивного вещества и ток в цепи экспоненциально убывают во времени.
Зависимость выражается уравнением:

где: It — ток в момент времени t;
I0 — ток в момент начала электролиза;
k — константа, зависящая от площади поверхности электрода, коэффициента диффузии вещества, объёма раствора, толщины диффузного слоя;
Электролиз ведут до остаточного тока 0,01% (погрешность 1%) или 0,001% (погрешность 0,1%).
Количество электричества определяют интегрированием
Методы определения количества электричества
Графическое интегрирование: записывают самописцем изменение тока как функцию времени и измеряют площадь под кривой – или рассчитывают по формуле:
Электрохимическое интегрирование при помощи приборов – кулонометров.
Электронное интегрирование с цифровыми счётчиками количества электричества.
Косвенная кулонометрия (кулонометрическое титрование) применяется в основном в амперостатическом режиме и заключается в тировании электроактивных или электронеактивных веществ титрантом, электроге-нерированном из вспомогательного реагента путём электролиза.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
ОПРЕДЕЛЕНИЕ ТИОСУЛЬФАТА МЕТОДОМ КУЛОНМЕТРИЧЕСКОГО ТИТРОВАНИЯ
Определение тиосульфата – традиционная кулонометрическая задача для студенческих практикумов по аналитической химии. Тиосульфат сам по себе мало кому нужен. Тем не менее данная реакция определения имеет важное значение, так как такое определение входит как составная часть в некоторые практически важные определения, например, серы в нефти или сульфит-ионов в вине.
2.1. Химический принцип определения.
При йодометрическом кулонометрическом титровании тиосульфата в электролит (ацетатный буфер и йодистый калий) добавляют аликвоту определяемого вещества (тиосульфата натрия), При электролизе в ячейке происходит анодное окисление йодид-ионов с образованием элементарного йода:
Метод определения основан на окислении тиосульфат-иона йодом до тетратионита в слабокислой среде по реакции:
Реакция (2) выбрана для титрования по трем основным признакам: во-первых, она протекает стехиометрически, то есть, на 100%, так что по количеству йода можно точно рассчитать количество тиосульфата, а во-вторых, быстро, так что можно точно установить точку эквивалентности без ошибки недотитровывания, вызванной замедленной реакцией между титрантом и определяемым веществом. И, в-третьих, существует простой способ определения точки эквивалентности: точка эквивалентности обнаруживается по появлению в ячейке элементарного йода с помощью индикаторного электрода, который в данном случае выполнен в виде специального бипотенциометрического датчика.
2.2. Как работает индикаторный электрод.
Индикаторный бипотенциометрический датчик представляет собою две платиновые иголочки, впаянные в стекло. Через них все время пропускают небольшой ток (5 мкА), а регистрируемым параметром является напряжение между этими проводочками. Рассмотрим происхождение этогонапряжения. Оно складывается из трех компонентов: напряжение на отрицательном электроде, на положительном электроде и падение напряжения в растворе. Рассмотрим вклад каждой из этих компонент. На положительном (окисляющем) электроде всегда протекает реакция окисления йодид-ионов, которые введены в ацетатный буфер в огромном избытке. Поэтому падение напряжения на этом электроде очень маленкое (менее 1 мВ). Удельное сопротивление ацетатного буфера очень низкое, поэтому при токе 5 мкА падение напряжения в растворе тоже очень маленькое. Остается падение напряжения на отрицательном платиновом игольчатом электроде..Это падение напряжения зависит от того, какая реакция на нем протекает. Если в растворе присутствует свободный йод, то это реакция восстановления йода:
Если же йода нет, то на отрицательном электроде инидкаторного электрода протекает реакция
Реакция (3) протекает при небольших напряжениях, а реакция (4) – при больших (около 1В). Поэтому если йода много, на датчике нулевое напряжение, если йода нет – напряжение 600-800 мВ (почти 1 Вольт), а если концентрация йода промежуточная, то напряжение на датчике меняется в этом диапазоне. Уменьшаясь с увеличением концентрации йода. Можно прокалибровать датчик по концентрации йода, но мы этого за ненадобностью не делаем.
2.3. Каково устройство ячейки.
 | Ячейка кулонометрическая жидкостная с фильтром 1. корпус ячейки , 2. катодная камера 3. катод 4. анод 5. индикаторные электроды 6. хлор-кальциевая трубка (если требуется) 7. порт ввода |
Для определения тиосульфата в ячейку заливают фоновый раствор, по своему составу представляющий смесь ацетатного буфера (рН 4) и избытка йодистого калия. Выбор среды не случаен: как будет ясно из раздела, где описана работа индикаторного электрода, величина рН должна быть стабилизирована, для того, чтобы показания индикаторного электрода были воспроизводимыми. В кислой среде тиосульфат разложится по реакции:
Таким образом, кислая среда неприемлема, так как не обеспечивает стабильность тиосульфата. Если взять щелочную среду, то йод, использующийся для титрования, вступит в реакцию диспропорционирования.
Продукты реакции диспропорционирования уже не способны к реакции с тиосульфат-ионом в щелочной среде, таким образом, в щелочной среде йод потеряет активность. В ацетатном буфере, который обеспечивает умеренно кислую среду с рН около 4 йод сохраняет активность, а тиосульфат – стабильность. Таким образом, ацетатный буфер обеспечивает удачный компромисс для проведения реакции. Избыток йодистого калия, с одной стороны служит как источник йода на генераторном электроде, а с другой стороны, он обеспечивает стабильную работу индикаторного электрода, так как является единственным довольно сильным восстановителем, присутствующем в растворе в избытке. Подробнее это описано в следующем разделе.
При загрузке методики, внесенной в память прибора (осуществляется клавишей Ф2) анализатор осуществляет подготовку к проведению электролиза, запускает пропускание тока постоянной силы через электролит в электрохимической ячейке и автоматически прекращает электролиз при достижении начальных условий. Эти условия заключаются в том, что устанавливается некоторая остаточная концентрация йода в растворе Сост. Когда прибор проводит процесс титрования тиосульфата, он также доводит концентрацию йода не до нуля, а именно до той же концентрации Сост. Поэтому сгенерированное прибором количество йода точно эквивалентно количеству введенного в раствор тиосульфата.
Измерив израсходованное на проведение реакции время, рассчитывают согласно закону Фарадея количество вещества n, восстанавливающееся (или окисляющееся) на электроде. Величина n прямо пропорционально количеству электричества Q, проходящего через электролит:

где М – масса моля определяемого вещества, г/моль;
tэ— время электролиза, с;
z– количество электронов, переходящего в ходе электродной реакции;
F — константа Фарадея (96485,3415 ± 0,0039), Кл/моль.
Источник
Условия кулонометрических определений:
Практически всё количество электричества должно расходоваться на превращение анализируемого вещества (100% выход по току), т.е. побочные реакции должны отсутствовать. Для этого вспомогательный реагент добавляют в большом избытке по отношению к определяемому веществу (в 100-кратном).
Точное фиксирование момента завершения реакции. С этой целью применяют визуальные (с использованием химических индикаторов) и инструментальные (оптические или электрохимические) способы.
Точное определение количества электричества и времени электролиза. Для измерения тока и времени применяют соответственно миллиамперметры и электрические хрононометры или секундомеры.
Метод косвенной кулонометрии применяется для определения неорганических и органических соединений с использованием всех методов титрования (кислотно-основного, окислительно-восстановительного, осадительного, комплексометрического).
Определение тиосульфата натрия методом кулонометрического титрования
Метод основан на измерении количества электричества, затраченного на количественное электрохимическое получение из йодида калия титранта йода, необходимого для взаимодействия с тиосульфат-ионами. Конечная точка титрования фиксируется визуально по посинению индикатора крахмала.
В ячейке протекают реакции:
Катодная реакция: (An — Pt) 2 Н + + 2е— H2
Анодная реакция: (Kt-W) 2 I — — 2е — I2
Химическая окислительно-восстановительная реакция:
Методика
Ознакомление с кулонометрической установкой, подготовка её к работе (по инструкции к прибору).
Приготовление раствора для электролиза.
В ячейку для электролиза (стакан вместимостью 100 см 3 ) помещают 10 см 3 0,1 моль/дм 3 раствора йодида калия, 10 см 3 510 -4 моль/дм 3 раствора тиосульфата натрия, 1-2 см 3 0,01 моль/дм 3 раствора серной кислоты и 1 см 3 раствора крахмала.
Проведение ориентировочного титрования с целью приблизительной оценки времени электролиза и установления постоянного строго определённого значения тока электролиза при последующем точном титровании. Титруют тиосульфат-ион в анализируемом растворе при включённой мешалке и фиксируют время от момента включения ячейки в цепь до появления синей окраски раствора. Отключают ячейку.
Проведение предэлектролиза фонового раствора при установленном постоянном значении тока для электроокисления или электровостановления примесей, содержащихся в фоновом электролите. Для этого в ячейку снова помещают все необходимые растворы, кроме анализируемого. Замыкают цепь, фиксируя по миллиамперметру значение тока и, в случае необходимости, регулируя его реостатом. Момент окончания предэлектролиза определяют по голубой окраске раствора, цепь размыкают.
Проведение точного титрования. К фоновому электролиту прибавляют несколько капель раствора тиосульфата натрия до исчезновения голубой окраски раствора при включённой электромешалке, точный объём анализируемого раствора тиосульфата натрия (индивидуальное задание), включают ячейку в цепь и одновременно включают секундомер. В процессе проведения электролиза следят за постоянством значения тока.
По достижении конечной точки титрования (появлению синей окраски раствора) одновременно размыкают цепь и останавливают секундомер.
Измерения повторяют не менее 3 раз, причём очередную порцию анализируемого раствора прибавляют в тот же стакан без удаления ранее оттитрованного раствора. Полученные результаты записывают в таблицу.
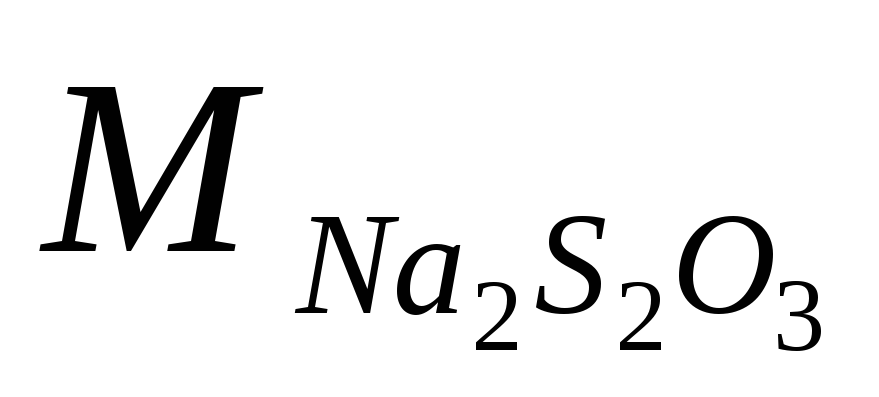
Источник
Контрольная задача. Определение содержания тиосульфата натрия в анализируемом образце
1. Собрать установку для кулонометрического титрования с потенциометрической фиксацией точки эквивалентности по схеме (см. Рис. 1.)
Рис. 1. Схема лабораторной установки.
2. В анодное пространство ячейки внести 50 см 3 , а в катодное 2,5 см 3 ацетатного буферного раствора рН=3,7.
3. Включить магнитную мешалку и кулонометр.
4. Для автоматической регистрации результатов эксперимента необходимо войти в программу «ЕХР pr2.exe».
5. Провести предэлектролиз.
6. Внести в анодное пространство ячейки аликвоту (1 или 2 см 3 ) раствора тиосульфата натрия.
7. После проведения электролиза на дисплее появится время титрования до точки эквивалентности в сек.
8. Измерения каждой аликвоты провести по 3 раза.
Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
Определение кислот основано на электрогенерации ионов 


После завершения химической реакции избыток ионов 
1. Собрать установку для кулонометрического титрования с потенциометрической фиксацией точки эквивалентности по схеме (см. Рис. 1.)
Рис. 1. Схема лабораторной установки.
2. В катодное пространство ячейки помещают 25 см 3 раствора сульфата калия и доводят объем раствора до 50 см 3 дистиллированной водой. В анодную камеру вносят 2,5 см 3 раствором сульфата калия.
3. Включить магнитную мешалку и кулонометр.
4. Для автоматической регистрации результатов эксперимента необходимо войти в программу «ЕХР pr2.exe».
5. Провести предэлектролиз.
6. Внести в анодное пространство ячейки аликвоту (1 или 2 см 3 ) раствора соляной кислоты.
7. После проведения электролиза на дисплее появится время титрования до точки эквивалентности в сек.
8. Измерения каждой аликвоты провести по 3 раза.
Оформление лабораторного журнала
Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
1. Цели и задачи работы
3. Написать уравнения реакции анодного окисления йодид-ионов с образованием элементарного йода и реакцию окисления тиосульфата натрия йодом в кислой среде. Для обеих реакций привести полное, ионное сокращенное уравнения. Написать окислительно-восстановительные процессы.
4. Привести график зависимости потенциала от времени.
5. Внести результаты измерения в Таблицу 1. и рассчитать среднее время титрования с доверительным интервалом для каждой из аликвот, массу тиосульфата натрия с помощью закона Фарадея.
Источник