Определение редуцирующих веществ.
Ряд методов определения редуцирующих сахаров основан на применении щелочного раствора меди, который получается при взаимодействии щелочного раствора сегнетовой соли с сульфатом меди (медным купоросом) – фелиговый метод (метод горячего титролвания).
Раствор сульфата меди носит название Фелинг I, щелочной раствор сегнетовой соли — Фелинг II.
В первый момент при смешивании щелочного раствора сегнетовой соли и медного купороса образуется голубой осадок гидроксида меди.
При взаимодействии Сu(ОН)2 с сегнетовой солью осадок растворяется, образуется медный комплекс, и раствор окрашивается в густой синий цвет.
Редуцирующие сахара, воздействуя на образовавшийся медный комплекс, восстанавливают медь до закиси.
При количественном определении редуцирующих сахаров пользуются таблицами, составленными на основании экспериментальных данных при определенных условиях опыта, которые необходимо соблюдать. При изменении длительности нагревания или степени щелочности раствора получаются неверные результаты. При определении общего сахара предварительно проводят инверсию сахарозы.
Методов количественного определения редуцирующих веществ и общего сахара с применением щелочных растворов меди довольно много (ГОСТ 5903-89)– йодометрический, перманганатный, феррицианидный, фотоколориметрический (с использованием фотоэлектроколориметра ФЭК-56 или ФЭК-М), поляриметрический, фелинговый и биологический. Некоторые из них основаны на определении содержания сахара по количеству выделившейся закиси меди (йодометрический), другие — по количеству израсходованного инвертного сахара на восстановление точно отмеренного объема щелочного раствора меди (методы Соксле, Лейна, Эйнона).
Определение содержания редуцирующих веществ методом титрования щелочного раствора меди раствором инвертного сиропа.
Метод предложен Лейном и Эйноном. В качестве индикатора в конце реакции используют метиленовый синий. Редуцирующий сахар придает темно-синюю окраску фелинговой жидкости. При нагревании инвертный сахар вступает в реакцию с фелинговой жидкостью, постепенно обесцвечивает ее с выделением закиси меди ярко-красного цвета. Окраска закиси меди затрудняет установление конца реакции, поэтому используют метиленовый синий. Инвертпый сахар после восстановления фелинговой жидкости восстанавливает метиленовый синий до образования бесцветного леико-соединения и обесцвечивания раствора.
Для приготовления стандартного раствора инвертного сахара навеску химически чистой сахарозы или сахара-рафинада, выдержанных в эксикаторе в течение 3 суток, в количестве 1,9 г растворяют в воде, переносят в мерную колбу на 200 мл. Количество воды, затраченное на растворение и перенесение навески, должно быть около 100 мл.
К раствору прибавляют 7—8 мл концентрированной соляной кислоты (плотн. 1,19). Погрузив термометр в колбу, ставят ее в водяную баню, нагретую приблизительно до 80° С. В течение 2—3 мин температуру жидкости доводят до 67—70°С и при этой температуре выдерживают раствор точно 5 мин, после чего содержимое колбы немедленно охлаждают под струей холодной воды до комнатной температуры и нейтрализуют раствором щелочи (25—30%-ной концентрации), прибавив 1—2 капли метилового оранжевого (зона перехода окраски рН 3,1—4,4). После этого раствор в колбе разбавляют водой до метки и взбалтывают. В 1 мл приготовленного стандартного раствора содержится 0,01 г инвертного сахара.
При установлении титра фелинговой жидкости (контрольное титрование – количество ред веществ в стандартном растворе) в коническую колбу на 100 –200 см 3 отмеривают пипетками по 10-см 3 жидкости Фелинг I и Фелинг II, прибавляют пипеткой 10 см 3 воды, нагревают до кипения, кипятят ровно 1 мин. Не прерывая кипячения, вносят три капли метиленового синего и титруют тем же раствором инвертного сахара до исчезновения синей окраски и появления красного осадка.
Величину навески сиропа g определить по формуле
где а —допустимое содержание определяемого сахара в 100 мл приготовленного раствора (0,032), г;
V — объем мерной колбы, взятой для приготовления раствора навески, мл (если навеску необходимо растворить);
р — предполагаемое содержание редуцирующих веществ в исследуемом продукте, % (в карамельном сиропе 12-14%).
В коническую колбу на 100—150 мл пипетками отмерить по 10 см 3 жидкости Фелинг I, Фелинг II и дистиллированной воды и расчетное количество сиропа (взвешенного на фильтровальной бумаге).
Если сироп имеет водонерастворимые вещества (белки и жиры), то перед проведением опыта навеску подвергают растворению дистиллированной водой в мерной колбе на 100 см 3 , которую заполняют на половину водой вводят навеску и помещают на водянуб баню температура которой не выше 60 0 С, при этой температуре, периодически взбалтывая, выдерживают в течение 15 мин. Охладив раствор до комнатной температуры, осаждают не сахара раствором ZnSO4·7H2О, взятого в количестве 10 см 3 , тщательно взбалтывают и вводят 10 см 3 гидроксида Nа или К. Осветлив жидкость, объем мерной колбы доводят до метки, взбалтывают и через 2 мин отфильтровывают, для определения редуцирующих веществ берут 10 см 3 приготовленного раствора, но из метода описанного выше исключают 10 см 3 воды.
Коническую колбу с исследуемым раствором нагреть при взбалтывании до кипения, кипятить 1 мин (время отметить по песочным часам). Не прерывая кипячения, прибавить 3 капли метиленового синего и дотитровать из бюретки стандартным раствором инвертного сахара до исчезновения синего окрашивания и выпадение красного осадка..
Количество редуцирующих веществ X (в %) определить по формуле:

где: n — объем стандартного раствора инвертного сахара, затраченный на 20 мл щелочного раствора меди, см 3 ;
m — количество стандартного раствора инвертного сахара, затраченного при дотитровывании, см 3 ;
Источник
Сахар Сокращает Методы Определения, Важность
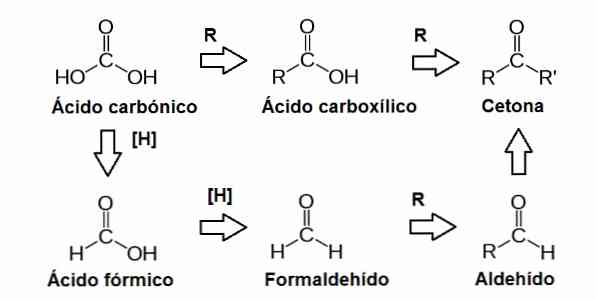
редуцирующие сахара это биомолекулы, которые действуют как восстановители; то есть они могут пожертвовать электроны другой молекуле, с которой они реагируют. Другими словами, восстанавливающий сахар представляет собой углевод, который содержит в своей структуре карбонильную группу (С = О)..
Эта карбонильная группа образована атомом углерода, присоединенным к атому кислорода через двойную связь. Эта группа может быть найдена в разных положениях в молекулах сахара, что приводит к другим функциональным группам, таким как альдегиды и кетоны.
Альдегиды и кетоны находятся в молекулах простых сахаров или моносахаридов. Эти сахара классифицируются в кетозах, если они имеют карбонильную группу внутри молекулы (кетон), или в альдозах, если они содержат ее в терминальном положении (альдегид).
Альдегиды являются функциональными группами, которые могут проводить окислительно-восстановительные реакции, которые включают движение электронов между молекулами. Окисление происходит, когда молекула теряет один или несколько электронов, и восстановление, когда молекула приобретает один или несколько электронов..
Из существующих видов углеводов все моносахариды являются восстанавливающими сахарами. Например, глюкоза, галактоза и фруктоза действуют как восстановители.
В некоторых случаях моносахариды являются частью более крупных молекул, таких как дисахариды и полисахариды. По этой причине некоторые дисахариды, такие как мальтоза, также ведут себя как восстанавливающие сахара..
- 1 Методы определения редуцирующих сахаров
- 1.1 Тест Бенедикта
- 1.2 Реагент Фелинга
- 1.3 Реагент Толленса
- 2 Важность
- 2.1 Значение в медицине
- 2.2 Реакция Майяра
- 2.3 Качество еды
- 3 Разница между восстанавливающими сахарами и невосстанавливающими сахарами
- 4 Ссылки
Методы определения редуцирующих сахаров
Тест Бенедикта
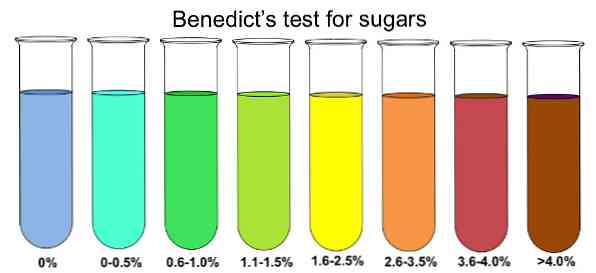
Чтобы определить наличие восстанавливающих сахаров в образце, его растворяют в кипящей воде. Затем добавляют небольшое количество реагента Бенедикта и раствору дают нагреться до комнатной температуры. В следующие 10 минут раствор должен начать менять цвет.
Если цвет меняется на синий, то редуцирующих сахаров нет, особенно глюкозы. Если в анализируемом образце присутствует большое количество глюкозы, изменение цвета будет переходить в зеленый, желтый, оранжевый, красный и, наконец, коричневый..
Реагент Бенедикта представляет собой смесь нескольких соединений: он включает безводный карбонат натрия, цитрат натрия и пентагидрат сульфата меди (II). После добавления в раствор с образцом начнутся возможные реакции восстановления оксида..
Если есть редуцирующие сахара, они уменьшат сульфат меди (синий цвет) раствора Бенедикта до сульфида меди (красноватый цвет), который выглядит как осадок и отвечает за изменение цвета.
Невосстанавливающие сахара не могут этого сделать. Этот конкретный тест обеспечивает только качественное понимание присутствия редуцирующих сахаров; то есть это указывает, есть или нет редуцирующие сахара в образце.
Реагент Фелинга
Подобно тесту Бенедикта, тест Фелинга требует, чтобы образец полностью растворился в растворе; Это делается в присутствии тепла, чтобы полностью раствориться. После этого добавляют раствор Фелинга, постоянно помешивая..
Если редуцирующие сахара присутствуют, раствор должен начать менять цвет в виде оксида или красного осадка. Если редуцирующих сахаров нет, раствор остается синим или зеленым. Раствор Фелинга также готовят из двух других растворов (А и В).
Раствор A содержит пентагидрат сульфата меди (II), растворенный в воде, а раствор B содержит тетрагидрат тартрата калия-натрия (соль Рошеля) и гидроксид натрия в воде. Два раствора смешивают в равных частях, чтобы сделать окончательное тестовое решение.
Этот тест используется для определения моносахаридов, в частности, альдоз и кетоз. Они обнаруживаются, когда альдегид окисляется до кислоты и образует оксид меди..
После контакта с альдегидной группой он превращается в ион меди, который образует красный осадок и указывает на присутствие восстанавливающих сахаров. Если бы в образце не было редуцирующих сахаров, раствор оставался бы синего цвета, что указывает на отрицательный результат для этого теста..
Реагент Толленс
Тест Толленса, также известный как тест серебряного зеркала, является качественным лабораторным тестом, который используется для различения альдегида и кетона. Он использует тот факт, что альдегиды легко окисляются, в то время как кетоны не.
В тесте Tollens используется смесь, известная как реагент Tollens, который представляет собой основной раствор, содержащий ионы серебра, координированные с аммиаком..
Этот реагент не является коммерчески доступным из-за его короткого срока полезного использования, поэтому он должен быть подготовлен в лаборатории, когда он будет использоваться.
Подготовка реагента включает в себя два этапа:
Шаг 1
Водный нитрат серебра смешивают с водным гидроксидом натрия.
Шаг 2
Водный аммиак добавляют по каплям, пока осажденный оксид серебра полностью не растворится.
Реагент Толленса окисляет альдегиды, которые присутствуют в соответствующих восстанавливающих сахарах. Та же самая реакция включает восстановление ионов серебра из реагента Толленса, который превращает их в металлическое серебро. Если испытание проводится в чистой пробирке, образуется осадок серебра.
Таким образом, положительный результат с реагентом Толленса определяется путем наблюдения «серебряного зеркала» внутри пробирки; этот зеркальный эффект характерен для этой реакции.
важность
Определение наличия редуцирующих сахаров в разных образцах важно в нескольких аспектах, включая медицину и гастрономию..
Значение в медицине
Скрининговые тесты на снижение сахара использовались в течение многих лет для диагностики пациентов с диабетом. Это может быть сделано, потому что это заболевание характеризуется повышением уровня глюкозы в крови, посредством чего определение их может быть выполнено этими методами окисления.
Измеряя количество окислителя, уменьшенного глюкозой, можно определить концентрацию глюкозы в образцах крови или мочи..
Это позволяет пациенту указывать соответствующее количество инсулина, которое необходимо ввести, чтобы уровень глюкозы в крови вернулся в нормальный диапазон..
Реакция Майяра
Реакция Майяра включает комплекс сложных реакций, возникающих при приготовлении некоторых продуктов. Когда температура пищи увеличивается, карбонильные группы восстанавливающих сахаров реагируют с аминогруппами аминокислот..
В результате этой реакции приготовления пищи образуются разнообразные продукты, и, хотя многие из них полезны для здоровья, другие являются токсичными и даже канцерогенными. По этой причине важно знать химию редуцирующих сахаров, которые включены в обычную диету..
При приготовлении продуктов, богатых крахмалоподобным картофелем, при очень высоких температурах (выше 120 ° C) происходит реакция Майяра.
Эта реакция происходит между аминокислотой аспарагин и восстанавливающими сахарами, генерируя молекулы акриламида, который представляет собой нейротоксин и возможный канцероген.
Качество еды
Качество определенных продуктов можно отслеживать с помощью методов обнаружения снижения сахара. Например: для вин, соков и сахарного тростника уровень редуцирующих сахаров определяется как показатель качества продукта..
Для определения восстанавливающих сахаров в пищевых продуктах обычно используют реагент Фелинга с метиленовым синим в качестве индикатора восстановления оксидов. Эта модификация широко известна как метод Лейна-Эйнона.
Разница между восстанавливающими сахарами и невосстанавливающими сахарами
Разница между восстанавливающими и невосстанавливающими сахарами заключается в их молекулярной структуре. Углеводы, которые восстанавливают другие молекулы, делают это, жертвуя электроны из их свободных альдегидных или кетоновых групп..
Следовательно, невосстанавливающие сахара не имеют в своей структуре альдегидов или свободных кетонов. Следовательно, они дают отрицательные результаты в тестах на обнаружение редуцирующих сахаров, как в тесте Фелинга или Бенедикта.
Восстанавливающие сахара включают все моносахариды и некоторые дисахариды, в то время как невосстанавливающие сахара включают некоторые дисахариды и все полисахариды.
Источник