Поверхностное культивирование
Культивирование микроорганизмов на твердых питательных средах -поверхностное культивирование) приблизительно можно представить в виде следующей последовательности технологических операций. Предварительно простерилизованный и измельченный твердый питательный субстрат засевается выращенной в отделении «чистой культуры» заводской лаборатории культурой соответствующего микроорганизма. Далее среду с посевным материалом направляют в раздаточное устройство где с помощью механических дозаторов осуществляется загрузка кювет (лотков) для выращивания. Перед загрузкой кюветы тщательно моют и стерилизуют острым паром. Загруженные кюветы помещают в специальные растительные камеры, где для нормального роста культур микроорганизмов поддерживаются соответствующие условия.
В качестве субстратов, используемых для культивирования микроорганизмов на твердых питательных средах, применяют, как правило, нестандартное сырье — различные отходы пищевой промышленности. Среди них наиболее часто используют пшеничные отруби, свекловичный жом, проросшие ячменные зерна (солод), шелуха от некоторых сельско- хозяйственных культур (риса, гречихи, подсолнуха). В качестве разрыхлителя субстрата часто используют древесные опилки. Все эти виды субстратов отличает низкое содержание азотсодержащих веществ, поэтому в качестве добавок к ним добавляют такие азотсодержащие соли, как сульфат аммония и различные добавки микроэлементов и ростовых факторов.
Перед использованием готовый субстрат подвергают тщательной стерили-зации, чтобы обеспечить максимально возможное подавление посторонней микрофлоры. Микробиологический контроль при этом обычно ведут по наличию спор бактерий, так как именно они наиболее устойчивы к различным методам стерилизации. Наиболее часто стерилизацию проводят обработкой острым паром (более 120 С). Однако это часто приводит к комкованию среды, что резко ухудшает процесс стерилизации таких комков на всю глубину, и кроме того, этот процесс является весьма длительным, энерго- и материалоемким. Поэтому на ряде производств в последнее время стали использовать для стерилизации принципиально другие методы, например уничтожение микроорганизмов γ— или рентгеновскими лучами.
Выращенный в отделении «чистой» культуры посевной материал перед засевом подвергают микробиологическому и биохимическому контролю на отсутствие посторонней микрофлоры и соответствие его паспортным технологическим данным. Посевной материал считается пригодным для засева основных аппаратов, если он обеспечивает при нормальной длительности культивирования на производственной среде необходимое по паспорту накопление целевого продукта или нужную ферментативную активность.
Поскольку практически все продуценты культивируемые поверх- ностным способом являются аэробами, то им для дыхания необходим интенсивный подвод воздуха.
Очистка используемого воздуха и его стерилизация осуществляется с использованием волокнистых фильтрах. Перед растительными камерами всегда устанавливают кондиционеры для поддержания необходимой температуры и влажности. В связи с использованием воздуха в качестве теплоносителя расход его достигает значительной величины. Поэтому практически любая технологическая схема подготовки и циркуляции воздушного потока предусматривает его рецикл, в котором участвует до 90% воздуха. При этом циркулирующий воздух проходит через воздухоохладитель, а часть отработанного воздуха очищается на фильтрах от пыли и микробных клеток, а затем выбрасывается в атмосферу.
Проблема регулирования теплообмена в процессе культивирования имеет не менее важное значение, чем обеспечение подвода воздуха. В ходе своего роста большинство культур выделяют значительное количество тепла. В то же время известно, что уже при температуре 38-40 С наступает угнетение вегетативного развития многих культур, а при 43-45 С может происходить полная инактивация их ферментных систем. Проблема усложняется тем, что выделение тепла в течение всего периода культивирования происходит неравномерно. В начале культивирования выделение тепла обычно в 10-20 раз больше чем в конце процесса. Поэтому необходим постоянный контроль за температурой внутри ростовой камеры и эффективный отвод избыточного тепла.
Решение проблемы теплообмена существенно упрощается благодаря тому, что так же неравномерно в ходе культивирования происходит и потребление кислорода (воздуха), при этом максимум потребления кислорода совпадает с максимумом тепловыделения. В конце культивирования потребление кислорода становится минимальным, одновременно уменьшается и выделение тепла. Это позволяет использовать холодный воздух, подаваемый в ферментер для съема и отвода выделяющегося в ходе культивирования тепла.
В процессе культивирования наблюдается непрерывное снижение влаги в твердом субстрате. В начале процесса влажность питательной среды достигает 58-60%, к моменту окончания процесса эта величина может снизиться до уровня 30%. Это отрицательно сказывается на развитии микроорганизма и как следствие на выходе целевого продукта. Поэтому для производственных условий важно в течении всего времени культивирования поддерживать величину влагосодержания на уровне не ниже 55-50%, что достигается предварительным увлажнением (кондиционированием) воздуха, подаваемого в растительные камеры..
Дата добавления: 2016-01-30 ; просмотров: 988 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Поверхностное культивирование



Культивирование микроорганизмов на твердых питательных средах -поверхностное культивирование) приблизительно можно представить в виде следующей последовательности технологических операций. Предварительно простерилизованный и измельченный твердый питательный субстрат засевается выращенной в отделении «чистой культуры» заводской лаборатории культурой соответствующего микроорганизма. Далее среду с посевным материалом направляют в раздаточное устройство где с помощью механических дозаторов осуществляется загрузка кювет (лотков) для выращивания. Перед загрузкой кюветы тщательно моют и стерилизуют острым паром. Загруженные кюветы помещают в специальные растительные камеры, где для нормального роста культур микроорганизмов поддерживаются соответствующие условия.
В качестве субстратов, используемых для культивирования микроорганизмов на твердых питательных средах, применяют, как правило, нестандартное сырье — различные отходы пищевой промышленности. Среди них наиболее часто используют пшеничные отруби, свекловичный жом, проросшие ячменные зерна (солод), шелуха от некоторых сельско- хозяйственных культур (риса, гречихи, подсолнуха). В качестве разрыхлителя субстрата часто используют древесные опилки. Все эти виды субстратов отличает низкое содержание азотсодержащих веществ, поэтому в качестве добавок к ним добавляют такие азотсодержащие соли, как сульфат аммония и различные добавки микроэлементов и ростовых факторов.
Перед использованием готовый субстрат подвергают тщательной стерили-зации, чтобы обеспечить максимально возможное подавление посторонней микрофлоры. Микробиологический контроль при этом обычно ведут по наличию спор бактерий, так как именно они наиболее устойчивы к различным методам стерилизации. Наиболее часто стерилизацию проводят обработкой острым паром (более 120 С). Однако это часто приводит к комкованию среды, что резко ухудшает процесс стерилизации таких комков на всю глубину, и кроме того, этот процесс является весьма длительным, энерго- и материалоемким. Поэтому на ряде производств в последнее время стали использовать для стерилизации принципиально другие методы, например уничтожение микроорганизмов γ— или рентгеновскими лучами.
Выращенный в отделении «чистой» культуры посевной материал перед засевом подвергают микробиологическому и биохимическому контролю на отсутствие посторонней микрофлоры и соответствие его паспортным технологическим данным. Посевной материал считается пригодным для засева основных аппаратов, если он обеспечивает при нормальной длительности культивирования на производственной среде необходимое по паспорту накопление целевого продукта или нужную ферментативную активность.
Поскольку практически все продуценты культивируемые поверх- ностным способом являются аэробами, то им для дыхания необходим интенсивный подвод воздуха.
Очистка используемого воздуха и его стерилизация осуществляется с использованием волокнистых фильтрах. Перед растительными камерами всегда устанавливают кондиционеры для поддержания необходимой температуры и влажности. В связи с использованием воздуха в качестве теплоносителя расход его достигает значительной величины. Поэтому практически любая технологическая схема подготовки и циркуляции воздушного потока предусматривает его рецикл, в котором участвует до 90% воздуха. При этом циркулирующий воздух проходит через воздухоохладитель, а часть отработанного воздуха очищается на фильтрах от пыли и микробных клеток, а затем выбрасывается в атмосферу.
Проблема регулирования теплообмена в процессе культивирования имеет не менее важное значение, чем обеспечение подвода воздуха. В ходе своего роста большинство культур выделяют значительное количество тепла. В то же время известно, что уже при температуре 38-40 С наступает угнетение вегетативного развития многих культур, а при 43-45 С может происходить полная инактивация их ферментных систем. Проблема усложняется тем, что выделение тепла в течение всего периода культивирования происходит неравномерно. В начале культивирования выделение тепла обычно в 10-20 раз больше чем в конце процесса. Поэтому необходим постоянный контроль за температурой внутри ростовой камеры и эффективный отвод избыточного тепла.

Решение проблемы теплообмена существенно упрощается благодаря тому, что так же неравномерно в ходе культивирования происходит и потребление кислорода (воздуха), при этом максимум потребления кислорода совпадает с максимумом тепловыделения. В конце культивирования потребление кислорода становится минимальным, одновременно уменьшается и выделение тепла. Это позволяет использовать холодный воздух, подаваемый в ферментер для съема и отвода выделяющегося в ходе культивирования тепла.
В процессе культивирования наблюдается непрерывное снижение влаги в твердом субстрате. В начале процесса влажность питательной среды достигает 58-60%, к моменту окончания процесса эта величина может снизиться до уровня 30%. Это отрицательно сказывается на развитии микроорганизма и как следствие на выходе целевого продукта. Поэтому для производственных условий важно в течении всего времени культивирования поддерживать величину влагосодержания на уровне не ниже 55-50%, что достигается предварительным увлажнением (кондиционированием) воздуха, подаваемого в растительные камеры..
Источник
Поверхностный метод культивирования продуцентов ферментов
При поверхностном методе культура растет на поверхности твердой увлажненной питательной среды. Мицелий полностью обволакивает и довольно прочно скрепляет твердые частицы, клетки получают питание за счет содержащихся в этих средах веществ и используют для дыхания кислород воздуха, поэтому для их нормального обеспечения кислородом приходится применять рыхлые по своей структуре среды с очень небольшой высотой слоя. Это приводит к необходимости иметь большую поверхность контакта рыхлой среды с воздухом и при отсутствии механизации придает всему процессу неинтенсивный характер, требует больших затрат ручного труда.
Так, например, для завода, вырабатывающего 1 т поверхностной культуры плесневых грибов на пшеничных отрубях, при двухсуточном росте требуется более 1000 отдельных кювет, на которых тонким слоем раскладывается засеянная конидиями гриба питательная среда. Мойка, стерилизация, перемещение кювет внутри цеха, их заполнение и освобождение составляют ту основную трудность, которая характерна для данного метода.
Выращивание производственной культуры происходит обычно в неасептических условиях, однако как сама среда, так и кюветы первоначально должны быть надежно стерилизованы. Это требование является безусловным, кроме того, перед каждой новой загрузкой должны дезинфицироваться растильные камеры, а также все мелкое оборудование и инвентарь.
Поверхностный метод имеет и преимущества, самое главное из них — значительно более высокая конечная концентрация фермента на единицу массы среды. Например, для осахаривания 100 кг крахмала в спиртовом производстве требуется 5 кг поверхностной культуры плесневых грибов или около 100 кг культуральной жидкости. Поверхностные культуры можно быстро и относительно легко высушить, их легко перевести в товарную форму и транспортировать, если не требуется дополнительной очистки фермента. Положительной стороной поверхностного метода является также меньшая потребность в электроэнергии по сравнению с глубинным методом.
На рис. 6 приведена принципиальная технологическая схема поверхностного метода выращивания.[2]
Для поверхностного метода производства он может быть подготовлен в виде культуры, выращенной на твердой питательной среде, спорового материала или мицелиальной массы продуцента, выращенной глубинным методом. Посевную культуру получают выращиванием микроорганизмов во все возрастающем количестве в три или четыре этапа.
Исходную музейную культуру продуцента, находящуюся на твердой агаризованной среде, пересевают сначала на 1 —1,5 г увлажненных стерильных пшеничных отрубей в пробирку. Выращивание проводят в термостате до обильного 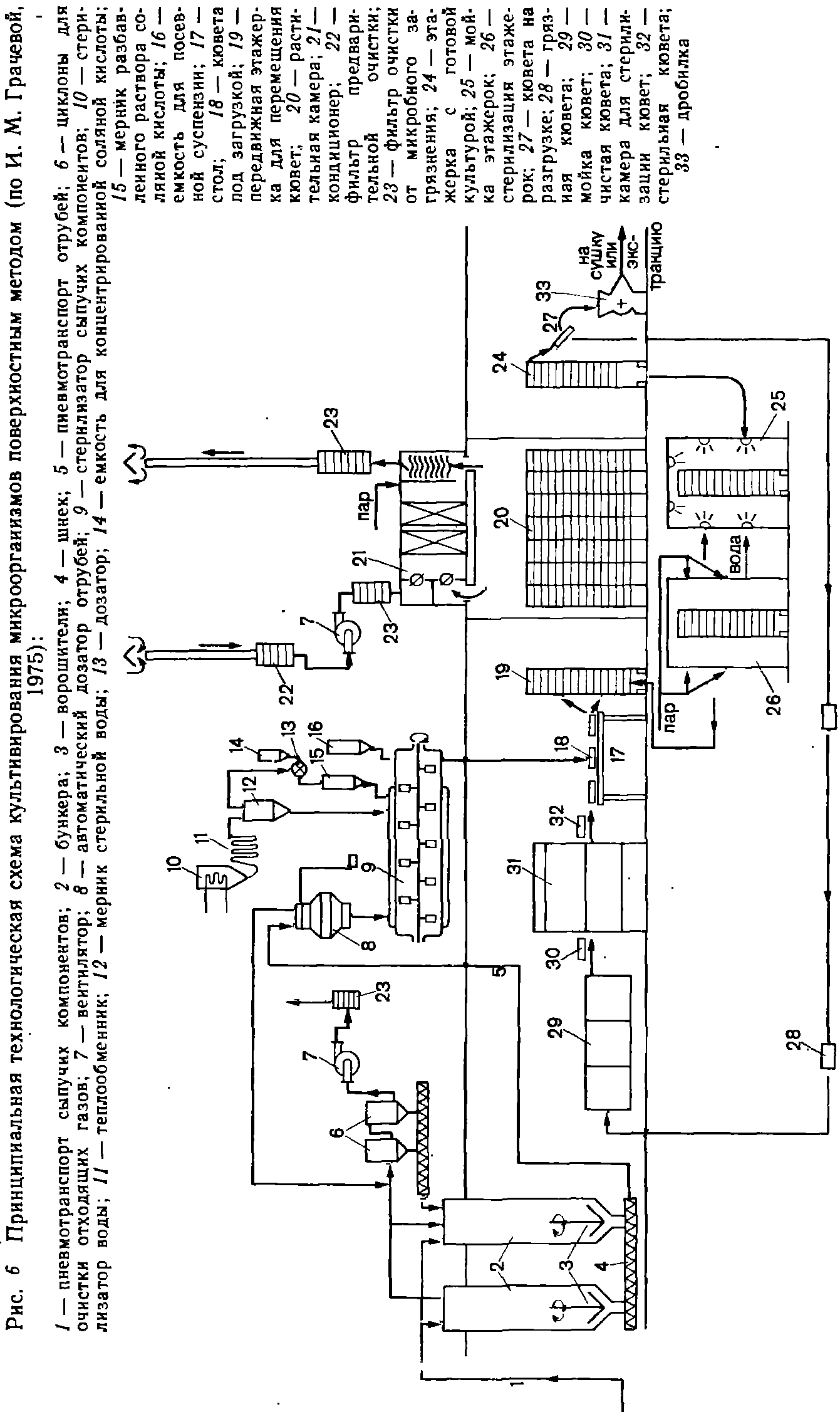
На последнем, четвертом этапе выращивание ведут на посевных кюветах, если материал нужен в виде культуры, или отделяют конидий от основной массы мицелия и субстрата на специальном вибросепараторе, если необходимы споры, или, наконец, в инокуляторе объемом 8—10 л на жидкой питательной среде, если инокулят нужен в виде мицелиальной массы.
Можно продлить срок хранения посевного материала, если спороносящую культуру подсушить до влажности 10—12%, отделенные конидии поместить в герметичную тару, а мицелиальную массу охладить до 4—6°С.
Приготовление питательных сред.
Основой почти каждой твердой среды являются пшеничные отруби как источник необходимых питательных и ростовых веществ. В увлажненном состоянии отруби создают требуемую структуру среды. Для повышения активности некоторых ферментов к отрубям добавляют свекловичный жом как материал, богатый пектином и целлюлозой, соевый шрот для повышения содержания белков и индукции протеазы, соевую муку или другие включающие жиры материалы для индукции липазы, пивную дробину, обогащенную крахмалом, для стимулирования биосинтеза амилолитического комплекса и др.
Дополнительное введение в отруби растительных отходов — овсяной или рисовой шелухи, соломы, кукурузных кочерыжек и древесных опилок — может улучшить структуру среды, особенно в случае мелких отрубей. Эти отходы вряд ли выполняют роль индукторов, так как большая часть веществ в них находится в нерастворимом состоянии и лигнифицирована. Улучшая структуру и облегчая доступ воздуха, такие материалы обедняют среду и понижают активность получающихся ферментов. Устранить это влияние можно прибавлением источников минерального азота и фосфора, а также материалов, богатых ценными органическими веществами, например солодовыми ростками, упаренным картофельным соком, кукурузным экстрактом и др.
Таким образом, как и при глубинном методе, изменяя состав среды, учитывая физиологические особенности продуцента и индуцибельность синтезируемых им ферментов, удается в известных пределах управлять процессом культивирования.
Источник







