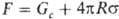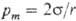Поверхностное натяжение и методы его определения
Поверхностное натяжение :сила, отнесенная к единице длины, или работа, затрачиваемая на создание единицы площади поверхности раздела фаз при постоянной температуре. (размерность Дж/м2).
Поверхностное натяжение (σ) выражает тенденцию поверхностей к стягиванию
Величина поверхностного натяжения чистой жидкости при данной температуре на данной границе раздела есть величина строго определенная.
Величина поверхностного натяжения растворов зависит от:
-природы растворенного вещества,
— от концентрации раствора
Существуют два типа методов определения поверхностного натяжения: статические и динамические.
Динамические методы, например метод колебания струи, вытекающей из отверстия неправильной формы, позволяют измерить поверхностное натяжение вновь образованной поверхности сразу после ее образования. Статическими методами измеряют поверхностное натяжение на границе раздела фаз, пришедших в равновесие. Если равновесие между фазами устанавливается достаточно быстро, то статическое поверхностное натяжение можно измерить достаточно просто. Если же равновесие устанавливается за очень длительный промежуток времени, особенно при переходе одного из компонентов системы через границу раздела фаз, то ни один из методов не дает истинного значения равновесного поверхностного натяжения. В этом случае говорят о полустатических значениях поверхностного натяжения и в обязательном порядке следует оговаривать продолжительность образования новой поверхности раздела фаз.
Наибольшее распространение получили следующие методы определения поверхностного натяжения жидких межфазовых границ:
· метод измерения массы или глубины погружения предмета в исследуемую жидкость (метод Вильгельми);
· метод измерения геометрических размеров свободных поверхностей раздела фаз (лежащая, висящая или вращающаяся капля, сидящий или висящий пузырек);
· сталагмометрический метод (метод счета капель);
· метод измерения усилия отрыва предмета от поверхности раздела фаз (отрыва цилиндра — метод Падди, отрыва кольца — метод Дю-Нуи);
· метод измерения капиллярного поднятия жидкости;
· метод измерения максимального давления в пузырьке газа или капле жидкости (метод Шредингера).
Адсорбция из раствора на твёрдом адсорбенте
Явление адсорбции из растворов твердыми адсорбентами было открыто и изучено в 1785 г. русским химиком и фармацевтом Т. Е. Ловицем. Адсорбция растворенных веществ твердыми адсорбентами — более сложный процесс, чем адсорбция газов твердыми телами. Осложняющими факторами являются: 1) присутствие третьего компонента — растворителя, молекулы которого могут конкурировать с молекулами адсорбата за места на поверхности адсорбента; 2) взаимодействие между молекулами адсорбата и растворителя; 3) электростатическое взаимодействие между поверхностью адсорбента и ионами адсорбата, если он является электролитом.
Неэлектролиты и слабые электролиты адсорбируются из растворов в виде молекул. Такой процесс называется молекулярной адсорбцией.
В результате адсорбции концентрация растворенного вещества в растворе уменьшается. Адсорбцию определяют по разности концентраций исходного и равновесного растворов адсорбата:
где с0 — исходная концентрация адсорбата; с — равновесная концентрация адсорбата; V — объем раствора адсорбата, из которого происходила адсорбция: т — масса адсорбента; а — адсорбция.
Адсорбция зависит от природы и удельной поверхности адсорбента, концентрации и природы адсорбтива, природы растворителя, а также температуры.
Удельная поверхность адсорбента обратно пропорциональна размеру частиц и зависит от их формы. Реальные частицы имеют сложную форму, поэтому для расчета величины удельной поверхности приходится учитывать так называемый коэффициент формы. Адсорбция наблюдается на всех твердых телах, но эффективные адсорбенты представляют собой вещества с сильно развитой поверхностью (пористые или порошкообразные).
При дроблении и измельчении твердых тел величина их удельной поверхности увеличивается вплоть до значений, достигающих тысячи квадратных метров на кубический сантиметр твердого тела. Чем больше удельная поверхность адсорбента, тем больше имеется активных центров и, следовательно, больше величина адсорбции.
Величина адсорбции зависит от природы адсорбента и адсорбтива: чем ближе по полярности адсорбент и адсорбтив, тем полнее происходит адсорбция. Под полярностью в данном случае понимают способность вещества к образованию водородных связей и участию в неспецифическом межмолекулярном взаимодействии за счет слабых сил без определенных центров локализации.
При адсорбции из растворов большое значение имеет и полярность растворителя. Наибольшей склонностью к адсорбции обладают вещества с полярностью, промежуточной между полярностями контактирующих фаз. Из водных растворов ПАВ хорошо адсорбируются неполярными адсорбентами (в том числе и активированным углем), а на по лярных адсорбентах (карбонаты, алюмосиликаты, оксиды) ПАВ хорошо адсорбируются из неполярных сред. В основе этих явлений лежит конкуренция между молекулами адсорбтива и растворителя за активные центры адсорбента (рис. 19.16 и 19.17).
П. Ребиндер сформулировал правило выравнивания полярностей: адсорбция идет в сторону выравнивания полярностей контактирующих фаз и тем сильнее, чем больше начальная разность полярностей. Иными словами, на полярных адсорбентах лучше адсорбируются полярные адсорбаты из менее полярных растворителей; на неполярных адсорбентах — неполярные адсорбаты из более полярных растворителей.
Влияние природы растворителя на адсорбцию может быть также сформулировано в виде правила: чем лучше в данном растворителе растворяется данный адсорбат, тем он хуже из него адсорбируется; чем хуже растворяется, тем лучше из него адсорбируется.
Адсорбция является экзотермическим процессом, поэтому с повышением температуры адсорбция из растворов уменьшается. Молекулярно-кинетические представления также подтверждают справедливость подобного заключения, однако в ряде случаев наблюдают обратную зависимость. В узком температурном интервале при достаточно большом температурном коэффициенте растворимости адсорбция с ростом температуры может увеличиваться, если при этом растворимость адсорбата в данном растворителе уменьшается.
С ростом концентрации раствора адсорбция на поверхности раздела адсорбент — раствор возрастает до некоторого предельного значения (рис. 19.18).
Анализ экспериментально наблюдаемой изотермы аналогичен анализу, приведенному выше.
Для математического описания изотермы адсорбции на границе твердый адсорбент — раствор используют уравнение Ленгмюра, которое в данном варианте имеет следующий вид:

где α — постоянная величина, равная отношению констант скоростей десорбции и адсорбции, имеющая размерность концентрации; атах — величина предельной адсорбции, она достигается при занятии всех активных центров адсорбента, dima = M ¯ ¹N , единица измерения — моль на грамм (моль/г).
Графическое определение констант уравнения Ленгмюра, которым описывается адсорбция из растворов на твердом адсорбенте, проводят так же, как и в уравнении Ленгмюра для поверхности раздела жидкость — газ. При адсорбции ПАВ на поверхности раздела твердый адсорбент — раствор так же, как и на поверхности раствор — газ, наблюдается различная ориентация молекул адсорбата. В системе полярный адсорбент — неполярный растворитель молекулы адсорбата обращены полярной частью («головой») к поверхности адсорбента, а неполярная их часть («хвост») погружена в растворитель (рис. 19.19, а). В случае полярный адсорбент — полярный растворитель, наоборот, неполярная часть молекулы обращена к поверхности адсорбента, а полярная часть погружена в растворитель (рис. 19.19, б).
В системах, состоящих из полярного растворителя и малополярного адсорбента, адсорбция ПАВ подчиняется правилу Траубе.
При адсорбции ПАВ из неполярных растворителей полярными адсорбентами наблюдается обращение правила Траубе: с ростом длины углеводородного радикала адсорбция уменьшается. Обращение правила объясняется тем, что с ростом длины углеводородной цепочки рас тет растворимость ПАВ в неполярных растворителях.
Дата добавления: 2019-02-12 ; просмотров: 623 ; Мы поможем в написании вашей работы!
Источник
Способы определения поверхностного натяжения жидкостей



Способы определения поверхностного натяжения делятся на статические и динамические. В статических методах поверхностное натяжение определяется у сформировавшейся поверхности, находящейся в равновесии. Динамические методы связаны с разрушением поверхностного слоя.
В случае измерения поверхностного натяжения растворов (особенно полимеров или ПАВ) следует пользоваться статическими методами.
Статические методы:
1. Метод поднятия в капилляре
| Основан на определении высоты столба жидкости h в капилляре радиуса r при полном смачивании; поверхностное натяжение рассчитывают по формуле: |
Высота подъема 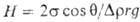
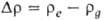
При идеальном смачивании, т. е. когда краевой угол смачивания равен нулю справедливо уравнение:

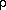
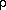
g — ускорение свободного падения.
Недостатком этого метода является зависимость высоты подъема жидкости от характера смачивания стенок капилляра исследуемой жидкостью
2. Метод Вильгельми
 | Универсальный метод, особенно подходит для измерения поверхностного натяжения в течение длительного промежутка времени. Измеряется усилие, возникающее в процессе отрыва стеклянной пластины от поверхности жидкости |
При погружении пластины с периметром сечения L в смачивающую жидкость вес пластины
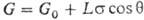
где G0— вес сухой пластины
3. Метод лежачей капли
| Метод основан на измерении формы капли, находящейся на несмачиваемой поверхности. |
4. Метод определения по форме висячей капли.
 | Измеряется возможность проводить измерения при повышенной температуре и давлении. Оптическими методами анализируют геометрию капли. |
5. Метод вращающейся капли
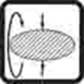 | Сущностью метода является измерение диаметра капли жидкости, вращающейся в более тяжелой жидкости. Капля жидкости плотностью r1 помещается в трубку с более тяжелой (плотность r2) жидкостью. При вращении трубки с угловой скоростью w капля вытягивается вдоль оси, принимая приближенно форму цилиндра радиуса r. Расчетное ур-ние: 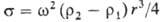 |
Этот способ измерения годится для измерения низких или сверхнизких значений межфазного натяжения.
Динамические методы:
1. Метод Дю Нуи (метод отрыва кольца).
 | Метод является классическим. Сущность метода вытекает из названия. Платиновое кольцо поднимают из жидкости, смачивающей его, усилие отрыва и есть сила поверхностного натяжения и может быть пересчитано в поверхностную энергию. Метод подходит для измерения ПАВ, трансформаторных масел и т. д. |
Для отрыва проволочного кольца радиусом R от пов-сти жидкости требуется сила
2. Сталагмометрический, или метод счета капель.
Метод основан на определении объема капли, вытекающей из капилляра с известным радиусом
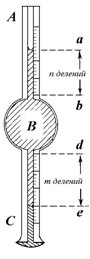 | Рис.Схема простейшего сталагмометра На рис.показана схема простейшего сталагмометра, который представляет собой сферический пузырек В известного объема Vk, ограниченный метками b и d и соединенный с двумя калиброванными капиллярами, имеющими объем каждого деления vе. Сталагмометр заполняют жидкостью, затем позволяют мениску очень медленно перемещаться по капилляру, перекрывая частично доступ воздуха в капилляр А с помощью резиновой трубки и зажима таким образом, чтобы каждая капля образовывалась за время не менее 4 с. После падения первой капли проводится отсчет деления, соответствующего верхнему мениску a в капилляре А (n делений от метки a). Скорость последующего образование капель также контролируют и устанавливают время образования капли не менее 4–5 с. После достижения мениском метки, например e в нижнем капилляре C (m делений от метки d), определяют объем одной капли при числе подсчитанных вытекших из сталагмометра капель N : 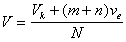 |
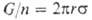
где G-общий вес n капель, оторвавшихся под действием силы тяжести от среза капиллярной трубки радиусом r. Для повышения точности правую часть умножают на поправочный коэф., зависящий от г и объема капли.
К недостаткам сталагмометрического метода можно отнести возможность испарения жидкости с поверхности капель при их длительном образовании и необходимость введения поправочных коэффициентов для точного определения поверхностного натяжения.

При учете всех поправок погрешность сталагмометрического метода не превышает 1%.
3. Метод максимального давления пузырька (метод Ребиндера).
 | Оптимально подходит для измерения величины поверхностного натяжения в зависимости от возраста поверхности. Измеряется давление, которое необходимо приложить, чтобы пузырек пробульковал из капилляра в жидкость. |
Расчет основан на ур-нии Лапласа. При выдавливании пузырька в жидкость через калиброванный капилляр радиусом г перед моментом отрыва давление
В этом случае определяется так называемое динамическое поверхностное натяжение, которое зависит от скорости пробулькавания пузырька.
4. Метод осциллирующей струи
5. Метод стоячих волн
6. Метод бегущих волн
При возмущении жидкости пластиной «лежащей» на её поверхности, по ней начинает распространяться цуг волн. Если просветить кювету с жидкостью импульсным источником света с частотой равной частоте возмущения, то на экран спроецируется «стоячая» волновая картина. Измеряя длину волны на экране и геометрически перерассчитывая её (зная расстояние от источника света до поверхности жидкости и расстояние от поверхности до экрана, а также про подобие треугольников) можно получить величину поверхностного натяжения по формуле:
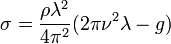
Источник