Потенциометрия и потенциометрическое титрование



Потенциометрия основана на измерении разности потенциалов между двумя электродами (индикаторным и электродом сравнения) в отсутствие тока во внешней цепи. В потенциометрии используются два приема:
а) прямая потенциометрия – измерение потенциала электрода как функции активности (концентрации) определяемого компонента;
в) потенциометрическое титрование – измерение потенциала как функции объема раствора реагента, добавляемого к пробе.
В качестве измерительного инструмента используют потенциометр или электронный вольтметр.
Раствор, содержащий определяемое вещество и индикаторный электрод образуют в потенциометрической ячейке один полуэлемент, потенциал которого линейно зависит от lg активности (концентрации) определяемого иона. Второй полуэлемент образован электродом сравнения, имеющим фиксированный потенциал, не зависящий от состава исследуемого раствора. Оба электрода идеально неполяризуемые, т.е. ток, протекающий через ячейку не вызывает отклонения потенциалов электродов от равновесных значений.
Схема ячейки для потенциометрических измерений.
Потенциал ячейки описывается уравнением:
Е = (Еинд – Еср) + Еj где Еинд –потенциал индикаторного
Еср – потенциал электрода сравнения4
Еj — потенциал жидкостного
В правильно составленной ячейке Еср постоянен, а Еj – пренебрежимо мал.
Э.д.с. ячейки определяется разностью потенциалов электродов, а полуреакции на электродах определяют их окислительно-восстановительные потенциалы, которые можно рассчитать по уравнению Нернста.
Например, в ячейке
Ag | AgCl, KCl || Ce 3+ , Ce 4+ | Pt
на левом электроде (электрод сравнения) протекает полуреакция:
AgCl (тв) + e — ↔ Ag(тв) + Cl — , E 0 = 0,222в
на правом ( индикаторном ) электроде, т.е. на Pt, — полуреакция:
Се 4+ + е — ↔ Се 3+ , Е 0 =1,44в
По уравнению Нернста потенциалы электродов равны:
Еинд = 1,44 + 0,059 lg [Ce 4+ ]/ [Ce 3+ ]
Eср = 0,222 + 0,059 lg [Cl — ];
А э.д.с. ячейки при 25 о С равна
Е = (1,44 + 0,059 lg [Ce 4+ ]/ [Ce 3+ ]) – (0,222 + 0,059 lg [Cl — ]) =
= 1,218 +0,59 lg [Ce 4+ ]∙ [Cl — ]/ [Ce 3+ ].
Поскольку [Cl — ] в электроде сравнения постоянна, потенциал ячейки зависит от соотношения концентраций окисленной и восстановленной форм определяемого иона.
А) Классические электроды.
Класс 0. Инертные металлы (Pt, Au) в контакте с раствором окислительно-восстановительной пары. Идеальные инертные материалы обратимо обмениваются электронами с компонентами электролита, при этом сами химически не изменяются
Класс 1. Обратимые: металл/ион металла, например Ag/Ag + (электроды первого рода).
Класс 2. Обратимые: металл в равновесии с насыщенным раствором соли металла и избытком аниона Х — , например, Ag/AgX, X — (электроды второго рода).
Класс 3. Обратимые: металл в равновесии с двумя малорастворимыми солями с общим анионом и избытком второго катиона. Например,
Pb|оксалат Pb || оксалат Са | Са 2+ (электроды третьего рода).
Б) Мембранные (ион-селективные ) электроды.
Стеклянный электрод – первый ион – селективный электрод. Его широко используют для измерения РН . Он состоит из стеклянной мембраны определенного состава и внутреннего электрода сравнения, погруженного в раствор с фиксированными РН и концентрацией хлорид-иона. (См.рис)
Возникновение мембранного потенциала обусловлено наличием сильно основных групп в решетке SiO2,обладающих высоким сродством к ионам Н + . Для получения стабильных потенциалов стеклянный электрод необходимо вымачивать некоторое время в разбавленном растворе HCl; поверхность стекла поглощает воду и образуется слой гидратированного геля, ионы натрия в котором способны обмениваться на ионы водорода.
В результате специфической адсорбции ионов водорода возникает разделение зарядов и межфазный скачок потенциала на каждой из поверхностей мембраны. Через слой сухого стекла ток переносят ионы натрия.
Потенциал стеклянного электрода описывается уравнением:
где const – постоянная, равная разности потенциалов между
внешним и внутренним электродами сравнения в
одинаковых по составу растворах по обе стороны стекла.
Т.к. aH+ (внутр) есть также величина постоянная, то

Е = const + 0,059 РН
Он должен быть изготовлен из фаз постоянного химического состава и потенциал его не должен зависеть от концентрации определяемого элемента
Основные требования к электроду сравнения обратимость, воспроизводимость и стабильность во времени. Обратимость означает, что направление электродной реакции можно изменить, поменяв полярность электрода. Воспроизводимость выражается стандартным отклонением потенциала ячейки при последовательных измерениях в растворе заданной концентрации. Стабильность работы оценивается по величине стандартного отклонения для заданного раствора. Электроды сравнения являются вторичными эталонами, их потенциалы определены относительно потенциала СВЭ. Обычно это электроды второго рода. Чаще всего используются хлоридсеребряный Ag|AgCl, KCl и каломельный Hg|Hg2Cl2,KCl электроды.
Прямая потенциометрия позволяет определять концентрацию или активность иона, если сеть селективный электрод. В основе метода лежит сравнение потенциала индикаторного электрода в растворе с неизвестной концентрацией определяемого иона с потенциалами в двух или более растворах с известными концентрациями его. Необходимо учитывать, что поведение ион-селективных электродов может отклоняться от предсказываемого уравнением Нернста. Поэтому перед работой необходимо проводить градуировку рабочего электрода по двум точкам. При определении РН для этого используют стандартные буферные растворы, значения РН которых охватывают РН исследуемого раствора и различаются между собой не более чем на 5 единиц. В анализе почв этот метод используется при определении РН почвенных растворов и вытяжек и при определении хлорид-ионов.
Титриметрические методы, в которых точку эквивалентности определяют по скачку потенциала на кривой титрования, называют потенциометрическим
титрованием. Этот метод установления точки эквивалентности отличается высокой точностью и воспроизводимостью и может быть использован в реакциях нейтрализации, окисления-восстановления, осаждения, комплексообразования.
В процессе титрования сначала происходит плавное изменение потенциала ячейки, а вблизи точки эквивалентности происходит его резкий скачок.
На кривой титрования точка эквивалентности является точкой перегиба.
В качестве индикаторного электрода обычно используется стеклянный электрод, в качестве электрода сравнения – хлорсеребряный или каломельный. Кривая титрования выражается зависимостью
РН = f (Vтитранта)
Вид кривой зависит от силы кислоты и основания и их концентраций в растворе.
1. Определяемое вещество – сильная кислота, титрант – сильное основание ( или наоборот)
Точка эквивалентности при РН = 7, величина скачка зависит от концентраций растворов. (см. рис)
2. Определяемое вещество – слабая кислота, титрант – сильное основание.
Точка эквивалентности при РН ≈ 8,8; скачок выражен слабее. В случае титрования слабого основания сильной кислотой значение РН точки эквивалентности сдвигается в кислую сторону.
3.Слабую кислоту раствором слабого основания эти методом оттитровать нельзя, т.к. кривая титрования не имеет выраженных скачков.
4. При титровании смеси кислот раствором сильного основания вполне удовлетворительные результаты могут быть получены, если константы диссоциации кислот отличаются друг от друга по крайней мере на три порядка. Кривая титрования имеет несколько перегибов, причем первый из них отвечает наиболее сильной кислоте.
Реакции осаждения и комплексообразования.
В качестве индикаторных используют мембранные электроды, потенциал которых является функцией концентрации (активности) ионов, принимающих участие в реакции. Величина скачка в точке эквивалентности зависит от величины произведения растворимости образующегося малорастворимого соединения или значения константы нестойкости образующегося комплексного соединения. Чем меньше эти величины, тем более резко происходит изменение потенциала в точке эквивалентности.
В качестве индикаторного используют электроды первого рода, чаще всего платиновые. Потенциал такого электрода определяется отношением концентраций окисленной и восстановленной формы одного иона:
Е = Е о + 0,059/n ∙ lg [Ox]/[Red]
При [Ox] = [Red] Е = Е о , где Е о – нормальный окислительно-восстановительный потенциал ситемы. Для стандартных термодинамических условий Е о многих окислительно-восстановительных систем – справочная величина.
Если в реакции титрования принимают участие ионы среды (Н + или ОН ─ ), то их концентрация учитывается уравнением Нернста:
a Ox + k H + +n e ─ = b Red + ½ m H2O
Е = Е о + 0,059/n ∙ lg [Ox] ∙[H + ] k /[Red]
Пусть реакция титрования описывается схемой
До точки эквивалентности потенциал индикаторного электрода определяется соотношением концентраций окисленной и восстановленной форм титруемого вещества:
Точка эквивалентности соответствует моменту, когда концентрации реагирующих веществ и продуктов реакции находятся в стехиометрическом соотношении:
После точки эквивалентности потенциал системы определяется соотношением концентраций окисленной и восстановленной форм титранта:
Величина скачка на кривой потенциометрического титрования зависит от величин стандартных потенциалов окислителя и восстановителя. Для получения аналитической точности порядка 0,1% необходимая разность потенциалов должна быть не мене 0,35в при n=1 и 0,18в при n=2.
Важным свойством кривой титрования в этом методе является ее независимость от концентраций реагирующих веществ (теоретически). Следовательно, разбавление не должно оказывать влияние на точность определения точки эквивалентности.
Способы определения точки эквивалентности.
Кривую титрования чаще всего выражают в виде графической зависимости
Е = f (Vтитранта). Точку эквивалентности находят по перегибу кривой:
Несколько более точно т.экв. находится по пересечению ветвей дифференциальной кривой титрования, построенной в координатах
∆Е /∆V = f (Vтитранта) или ∆РН / ∆V= f (Vтитранта). Оба эти метода требуют точного дозирования титранта, особенно вблизи точки эквивалентности, небольшими порциями, что весьма затрудняет титрование.
Источник
5 Потенциометрическое титрование
Потенциометрическое титрование основано на регистрации изменения потенциала индикаторного электрода в процессе титрования в соответствии с изменением концентрации титруемого вещества в процессе прибавления титранта.
В ходе потенциометрического титрования протекают две реакции: основная химическая реакция титрования и электрохимическая реакция на индикаторном электроде.
Выбор индикаторного электрода определяется типом протекающей реакции, природой определяемых ионов или ионов титранта, а также удобством работы с электродом.
Потенциал индикаторного электрода должен устанавливаться быстро, и также быстро реагировать на изменение концентрации титруемых ионов, достаточно резко изменять свою величину (скачок титрования) вблизи точки эквивалентности (ТЭ) при незначительном изменении концентрации потенциалопределяющих ионов. Это резкое изменение потенциала индикаторного электрода связано с заменой одной индикаторной реакции (до ТЭ) на другую (после ТЭ) и является признаком конца титрования. Величина скачка титрования связана с константой соответствующего химического равновесия, с условиями определения (концентрацией титруемого раствора и титранта, температурой, присутствием посторонних веществ и т.д.).
Электрод сравнения (стандартный электрод) не должен изменять свой потенциал при прохождении тока, т.е. этот электрод не должен поляризоваться.
Для проведения потенциометрического титрования создают полную электрохимическую цепь, состоящую из индикаторного электрода, помещенного в анализируемый раствор, который соединен с электродом сравнения при помощи солевого мостика. Электроды индикаторный и сравнения могут быть помещены в один анализируемый раствор (анализируемую среду). Полученный гальванический элемент подключают к потенциометру.
В потенциометрическом титровании используют следующие химические реакции: 1) кислотно-основные; 2) осаждения; 3) комплексообразования; 4) окисления-восстановления.
Во всех случаях реакция между определяемым ионом и реагентом должна идти с большой скоростью и до конца, быть стехиометрической. Должны отсутствовать также посторонние ионы, которые могут взаимодействовать с данным реагентом, т.е отсутствовать побочные химические реакции титранта с посторонними ионами.
Кислотно-основное потенциометрическое титрование – индикаторными электродами могут служить водородный, сурьмяный, стеклянный, хингидронный и др., т.е. электроды, потенциал которых является функцией концентрации ионов Н + ( [Н + ] ). Скачок потенциала тем больше, чем больше концентрация титруемой кислоты или основания и чем больше константа их ионизации.
Осадительное и комплексиметрическое потенциометрические титрования – индикаторными электродами могут быть все разновидности металлических электродов (в зависимости от природы взаимодействующих ионов). Чаще всего – это электроды I рода, также применяют электроды II рода — потенциал таких электродов определяется концентрацией аниона труднорастворимой соли, поэтому эти электроды могут быть использованы для определения таких анионов, как Сl — , Br — , I — , SCN — , S 2- . Возможно применение и ионоселективных мембранных электродов, чувствительных к одному из ионов, участвующих в титровании.
Скачок потенциала при осадительном потенциометрическом титровании тем больше, чем больше концентрация взаимодействующих веществ и чем меньше растворимость и ПР образующегося осадка.
Окислительно-восстановительное потенциометрическое титрование – индикаторными электродами служат индифферентные металлы (Pt, Pd, Au, Hg, Ag). Чаще всего используют платиновый электрод. Можно использовать и ионоселективные мембранные электроды. Величина скачка потенциала определяется разностью Δ Е 0 взаимодействующих редокс-пар.
Для определения конечной точки потенциометрического титрования можно использовать различные инструментальные, графические и расчетные методы. Выбор метода зависит от удобства его применения, характера кривой титрования, допустимой погрешности определения.
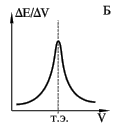
Построив график зависимости величины потенциала от количества добавляемого реагента – титранта (Е — Vтитранта) (рис. 9 А), получают характерную кривую потенциометрического титрования с максимальной крутизной в точке эквивалентности, т.е необходимо установить точку перегиба интегральной кривой.
Рисунок — 9 Формы кривых потенциометрического титрования:
А – интегральная; Б– дифференциальная; В – по второй производной.
Для более точного определения точки эквивалентности лучше использовать метод первой производной (рис.9 Б). В такой координатной системе точка эквивалентности определяется как точка максимума. Существуют устройства, автоматически вычерчивающие дифференциальную кривую, которая в точке эквивалентности имеет максимум.
Построение потенциометрической кривой можно проводить автоматически. Для этого используют записывающий милливольтметр с высоким входным сопротивлением, регистрирующим изменение потенциала, или разности потенциалов во времени. Титрант необходимо вводить в титруемый раствор с одинаковой скоростью, пользуясь бюреткой. Обычно нет необходимости в получении кривой титрования, если же надо найти только точку эквивалентности тогда достаточно отметить резкое отклонение стрелки милливольтметра и снять показания. В приборах для автоматического титрования вытекание титранта из бюретки автоматически прекращается, как только резко изменяется величина потенциала в точке эквивалентности.
Метод потенциометрического титрования особенно полезен при анализе растворов, содержащих несколько ионов без их предварительного разделения. В этом случае при определении нескольких точек эквивалентности можно обойтись без предварительного разделения ионов, что упрощает и ускоряет процедуру анализа. На рисунке 10 приведена кривая потенциометрического титрования смеси хлорида и иодида раствором азотнокислого серебра с использованием Ag — электрода. На кривой наблюдаются два перегиба: первый соответствует осаждению иодид иона (46), второй – осаждению хлорид иона (47).
J — + Ag + → AgJ (ПР = 8,3 . 10 -17 ) (46)
Cl — + Ag + → AgCl (ПР = 1,8 . 10 -10 ) (47)
Рисунок — 10 Кривая титрования смеси хлорид- и иодид- ионов раствором AgNO3
Если в реакции титрования участвует неэлектроактивное вещество, то конец титрования можно установить, используя метод обратного титрования, титруя избыток непрореагировавшего реагента раствором какого-либо электроактивного вещества. Например, при определении алюминия с помощью титрованного раствора трилона Б (ЭДТА – комплексон III – двунатриевая соль этилендиаминтетрауксусной кислоты) к анализируемому раствору, содержащему ионы алюминия, приливают трилон Б в избытке и нагревают раствор для ускорения реакции. Затем проводят потенциометрическое титрование избытка трилона Б раствором соли цинка, используя подходящий индикаторный электрод для контроля изменения концентрации ионов цинка.
Точность определения методом потенциометрического титрования выше, чем при использовании соответствующего классического химического титриметрического метода, поскольку субъективная оценка конца титрования заменяется объективными показателями чувствительных приборов. В ряде случаев потенциометрическое титрование дает возможность проводить определения в более разбавленных растворах по сравнению с химическим титрованием, и с той же погрешностью позволяет определять меньшие количества вещества.
Кроме этого, точность определения методом потенциометрического титрования выше, чем в прямой потенциометрии, так как в потенциометрическом титровании вблизи ТЭ небольшому изменению концентрации соответствует большее изменение потенциала индикаторного электрода. Если при прямом потенциометрическом измерении погрешность определения может составлять 2 – 10 %, то при проведении потенциометрического титрования — 0.5 – 1 %. Потенциометрическое титрование, однако, требует применения специальной аппаратуры (потенциометров, титраторов, рН-метров и др.) и является трудоемким. Не всегда быстрое установление потенциала после добавления титранта также ограничивает возможности метода.
При выполнении серийных анализов ручной способ титрования можно заменить полуавтоматическим, используя различные приборы – титраторы, позволяющие значительно сократить продолжительность анализа. Обычно применяют автоматические титраторы двух типов. В приборах первого типа записывают кривую титрования в координатах [E – V] или [ΔE/ΔV – V], конечную точку титрования находят затем по кривой титрования. В приборах второго типа титрование прекращается автоматически при достижении величины потенциала системы электродов, соответствующей точке эквивалентности. Объем израсходованного титранта затем считывают с прибора или печатается на ленте соответствующего устройства. Значение этой величины потенциала устанавливают предварительным титрованием в неавтоматическом режиме.
В настоящее время для титриметрических измерений используют систему для автоматического титрования, которая управляется компьютером с соответствующим программным обеспечением, который выполняет все расчеты, поиск и корреляцию данных, управление всеми частями такой интегральной системы.
В практике заводских лабораторий металлургического производства методом потенциометрического титрования определяют Mn, Cr, Co, Ni, Al, Y, Mo, W, As и углерод в рудах, концентратах и сплавах, а также Na, Cl, Br, I и цианиды в технологических растворах, сточных водах.
Источник