Постсинаптическая мембрана способ передачи нервного импульса
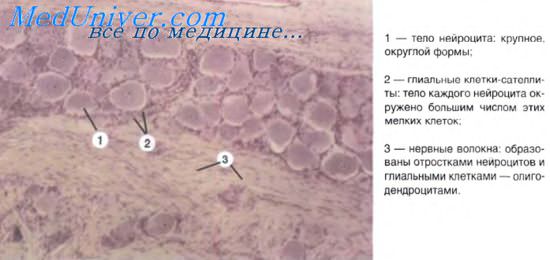
а) Высвобождение медиаторов. В состоянии покоя синаптические пузырьки накапливаются в активных зонах нервных окончаний и направляются к пресинаптическим уплотнениям при участии докинг-белков, один из которых — актин. При прохождении потенциала действия происходит открытие потенциалозависимых кальциевых (Са 2+ ) каналов, расположенных в непосредственной близости к активной зоне пресинаптической мембраны, что приводит к быстрому заполнению этой области ионами Са 2+ . Ионы Са 2+ связываются с определенными белками, расположенными в области скопления синаптических пузырьков и в активной зоне, в результате чего происходят слияние синаптических пузырьков с клеточной мембраной и высвобождение нейромедиаторов.
Процесс слияния синаптических пузырьков с клеточной мембраной начинается с образования плотного комплекса между везикулярными белками SNARE (v-SNARE) и белками пресинаптической мембраны (t-SNARES). Метаболические компоненты, необходимые для осуществления слияния синаптических пузырьков с мембраной клетки, расположены в активной зоне. Наиболее важный крупный мультидоменный белок RIM соединяется с ГТФ-связывающим белком синаптических пузырьков Rab3. Остальные белки обеспечивают слияние синаптических пузырьков с мембраной клетки и высвобождение нейромедиаторов. К синаптическим компонентам относят синаптические везикулярные белки (синаптотагмин, синаптобревин, синаптофизин и синапсины), везикуло-ассоциированные белки (амфифизин, динамин и СаМ-киназы), синаптические белки плазматической мембраны (синтаксины, нейрексины и SNAP-25), а также цитозольные белки (комплексины, различные виды белков SNAP и NSF-белки).
Многие из перечисленных синаптических белков выполняют специфические функции по обеспечению единства процессов возбуждения клетки и высвобождения нейромедиаторов, а также механизмов восстановления синаптических пузырьков, что лежит в основе синаптической передачи сигнала. Молекулярные процессы, обеспечивающие взаимосвязь возбуждения клетки и высвобождения нейромедиаторов, представляют собой сложные модели, осуществляемые различными механизмами. Белки сразу же формируют ответную реакцию на поступление ионов Са 2+ в клетку, в связи с чем временной промежуток между входом ионов и высвобождением нейромедиаторов составляет менее 1 мс.
Для высвобождения некоторого количества нейромедиаторов из синаптических пузырьков небольшого размера [например, содержащих глутамат или у-аминомасляную кислоту (ГАМК)] достаточно единичных потенциалов действия. В это же время для запуска медленного (с задержкой 50 мс и выше) высвобождения медиаторов из гранулярных везикул большого размера, характерных для пептидергических нейронов, минимальная частота импульсов составляет 10 Гц. Таким образом, количество высвобождаемого медиатора не является постоянной величиной и может изменяться под влиянием внутренних и внешних факторов.
(1) При открытии кальциевых каналов (Са 2+ ) (указано стрелкой) за счет актиновых филаментов синаптические пузырьки приближаются к пресинаптической мембране.
Парные макромолекулы белков слияния (FPMS), расположенные на синаптическом пузырьке, совмещаются с соответствующими белками на пресинаптической мембране.
(2) Макромолекулы белков слияния разделяются (указано стрелками, направленными в разные стороны), тем самым обеспечивая выход молекул нейромедиатора в синаптическую щель.
(3) Мембрана синаптического пузырька встраивается в пресинаптическую мембрану, и нейромедиаторы активируют специфические рецепторы.
(4) Молекулы белка клатрина участвуют в перемещении мембраны синаптического пузырька внутрь клетки. Молекулы белка динамина (выделены зеленым цветом) участвуют в сближении пар макромолекул белков слияния (указано стрелками, направленными навстречу друг другу) и замыкают формирующийся синаптический пузырек.
(5) Синаптический пузырек не содержит медиатора и может быть использован повторно.
б) Связывание медиатора с рецептором клетки-мишени. Молекулы нейромедиатора связываются с молекулами белков-рецепторов на постсинаптической мембране. Выделяют ионотропные и метаботропные рецепторы. Каждая группа включает рецепторы, активация которых приводит к открытию ионных каналов, а также рецепторы, обеспечивающие закрытие этих каналов.
1. Ионотропные рецепторы. В каждой макромолекуле ионотропных рецепторов присутствует ионный канал. Медиатор связывается со специфическим рецептором в синаптической щели, вызывая ее конформационное преобразование, что приводит к открытию ионного канала. Считают, что ионотропные каналы являются медиаторозависимыми (или лиганд-зависимыми), что указывает на их способность связываться с молекулой медиатора или лекарственного вещества. После отсоединения молекулы нейромедиатора или его разрушения ионный канал, закрываясь, возвращается в исходное состояние.
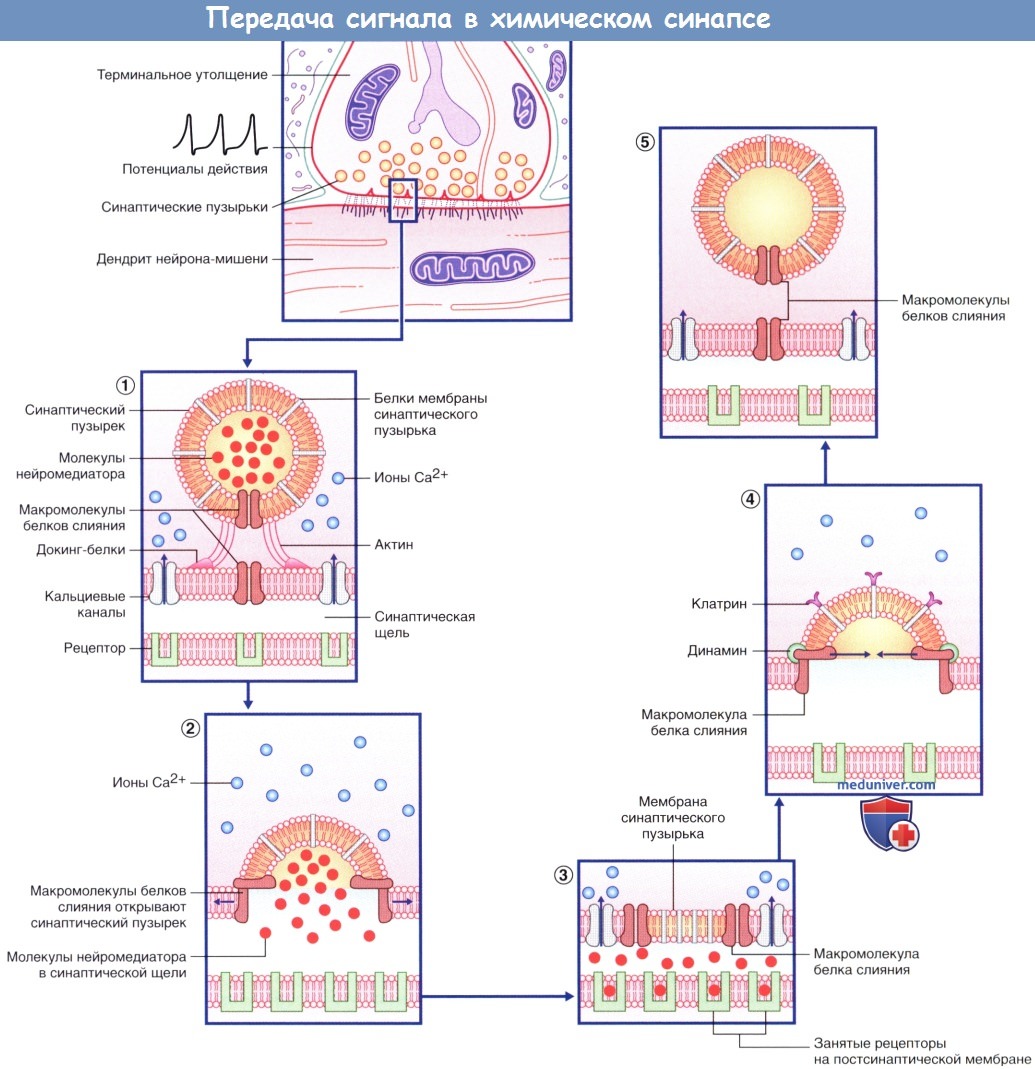
Нейромедиатор вызывает открытие возбуждающего ионного канала, в результате чего происходят значительное поступление ионов натрия (Na + ) в клетку и незначительный выход ионов калия (К + ) из клетки. Эти процессы приводят к образованию возбуждающего постсинаптического потенциала (ВПСП), вызывающего деполяризацию мембраны. При открытии множества медиаторозависимых каналов происходит суммирование возбуждения и возникает деполяризация большей силы, которая может достигать пороговых значений и вызывать образование потенциала действия. Тормозной постсинаптический потенциал (ТПСП), следующий за ВПСП, вызывает гиперполяризацию мембраны до -70 мВ, что служит равновесным потенциалом для ионов хлора (Cl — ). При открытии калиевых каналов, равновесный потенциал ионов которых составляет -80 мВ, происходит гиперполяризация большей силы.
Ионотропные рецепторы получили название «быстрых», поскольку они оказывают быстрое, но непродолжительное действие на ионные каналы.
Присоединение нейромедиатора (в данном случае изображен глутамат, выделен красным цветом; возбуждающий синапс) приводит к открытию «смешанного» натрий-калиевого канала.
При большом поступлении ионов Na + в клетку происходит незначительный выход ионов К + из клетки, что приводит к деполяризации мембраны и возникновению возбуждающего постсинаптического потенциала (ВПСП).
(Б) Медиаторозависимый тормозной ионотропный рецептор. Последующее присоединение тормозного нейромедиатора (в данном случае изображен ГАМКA, выделен синим цветом; возбуждающий синапс) приводит к открытию хлорного ионного канала.
Ионы Cl — поступают внутрь клетки, и под действием тормозного постсинаптического потенциала (ТПСП) происходит гиперполяризация мембраны.
2. Метаботропные рецепторы. Метаботропные рецепторы получили свое название благодаря способности оказывать в цитоплазме нейрона многочисленные метаболические действия. Макромолекула рецептора представляет собой трансмембранный белок, в котором отсутствует ионный канал. Рецептор активируется посредством присоединения медиатора к его активному центру, в результате чего происходит конформационная перестройка белка, что, в свою очередь, активирует одну из закрепленных субъединиц (α- или β-субъединицу). После активации субъединица открепляется и направляется вдоль внутренней поверхности клеточной мембраны. Субъединицы являются G-белками за счет преимущественного связывания с гуанинтрифосфатом (ГТФ) или гуаниндифосфатом (ГДФ).
В большинстве случаев эти белки оказывают непрямое действие через систему вторичных посредников. Однако некоторые G-белки активируют ионные каналы напрямую. G-белок, оказывающий возбуждающее действие, называют Gs-белком, а белок, оказывающий тормозное действие,— Gi-белком. За счет многостадийного функционирования метаботропные рецепторы, как правило, являются «медленными»; после единичного стимула влияние мембранного канала может продолжаться сотни миллисекунд. Кроме того, образование вторичных посредников может привести к снижению способности нейрона к возбуждению.
В настоящее время выделяют три системы вторичных посредников.
1. Система циклического аденозинмонофосфата (цАМФ), осуществляющая фосфорилирование белков.
2. Инозитолфосфатная система, обеспечивающая высвобождение ионов Са2+ из эндоплазматических депо.
3. Система арахидоновой кислоты, за счет которой осуществляется образование метаболитов арахидоновой кислоты.
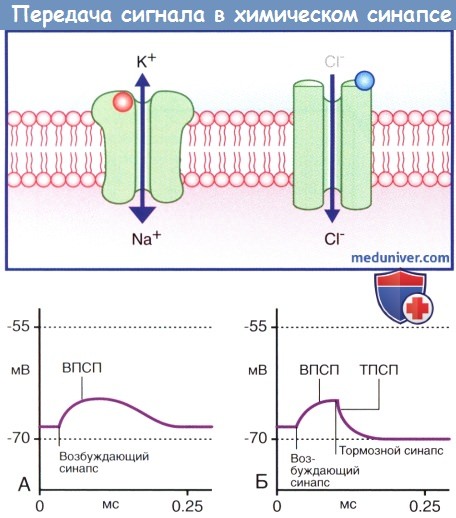
— Система цАМФ. Связывание нейромедиатора с рецептором приводит к отделению а-субъединицы от Gs-белка, за счет чего становится возможным присоединение ГТФ к освободившемуся белку, который, в свою очередь, способствует превращению аденозинтрифосфата (АТФ) в цАМФ под действием аденилатциклазы (рис. 8.4). Синтезированный цАМФ, расщепляясь, выполняет в клетке функцию вторичного посредника. Под воздействием цАМФ протеинкиназа А переносит фосфат-ионы от молекулы АТФ в ионный канал, что приводит к его открытию и поступлению ионов Na + внутрь клетки, за счет чего происходит деполяризация нейрона-мишени. При инактивации Gs-белка под действием прикрепленного к мембране фермента протеинфосфатазы происходят выход фосфат-ионов из клетки и закрытие ионного канала.
На рисунке изображена последовательность процессов, происходящих в клетке, начиная от Gs-белок-связанного рецептора к ионному каналу через образование цАМФ.
(1) Медиатор активирует макромолекулу рецептора.
(2) α-Субъединица Gs-белка отщепляется и связывается с гуанозинтрифосфатом (ГТФ).
(3) ГТФ связывается с аденилатциклазой.
(4) Под действием аденилатциклазы происходит синтез цАМФ из АТФ.
(5) цАМФ активирует протеинкиназу А (ПКА).
(6) ПКА перемещает фосфатные группы АТФ на натриевый (Na + ) канал, за счет чего канал открывается, и ионы Na + -поступают в цитозоль, вызывая деполяризацию клетки.
(7) Вслед за инактивацией Gs-белка под действием фермента фосфотазы происходят дефосфорилирование ионного канала и его закрытие.
— Инозитолфосфатная система. Эффекторный фермент — фосфолипаза С — под влиянием другой активированной а-субъединицы G -белка расщепляет фосфолипид мембраны PIP, с образованием двух вторичных посредников; диацилглицерола (ДАГ) и инозитолтрифосфата (ИТФ). ДАГ активирует протеинкиназу С, которая запускает процесс фосфорилирования белков. ИТФ, проникая в цитозоль, открывает кальций-зависимые ионные каналы преимущественно вблизи мембран гладкой эндоплазматической сети. Ионы Са 2+ запускают Са 2+ -зависимый каскад ферментов, осуществляющих открытие и/или закрытие ионных каналов, а также, вероятно, изменяющих экспрессию генов и синтез белков при прохождении через ядерную оболочку (см. далее — транскрипция генов).
Система арахидоновой кислоты. Описана далее (в связи с гистамином).
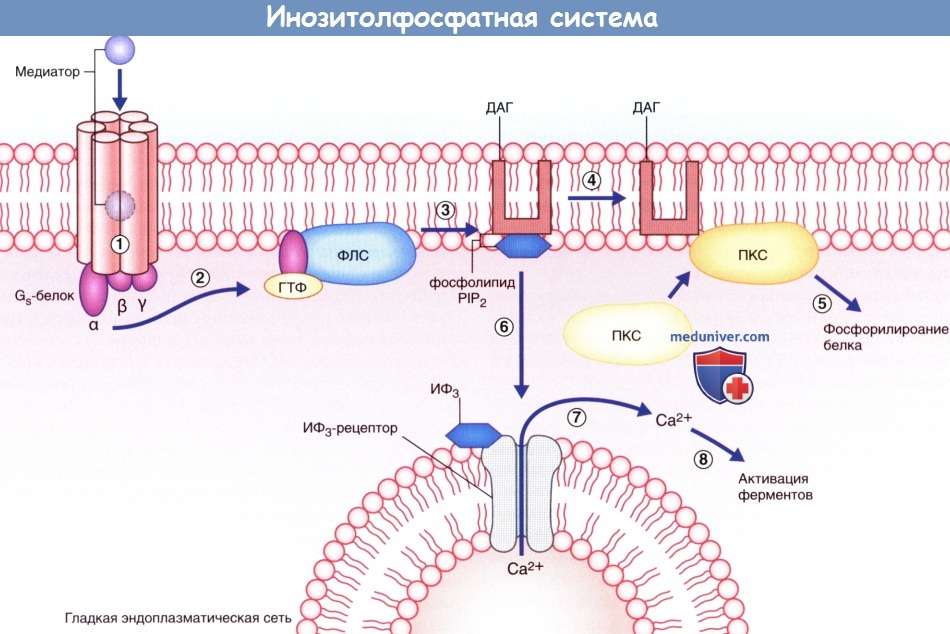
Продемонстрирована двойная функция этой системы.
(1) Медиатор активирует макромолекулу рецептора.
(2) α-Субъединица выбелка отщепляется и связывается с гуанозинтрифосфатом (ГТФ), который обеспечивает ее связывание с фосфолипазой С (ФПС).
(3) ФПС перемещается вдоль клеточной мембраны и расщепляет фосфолипид РIР2 на диацил-глицерол (ДАГ) и инозитолтрифосфат (ИФ3).
(4) ДАГ вызывает перемещение протеинкиназы С (ПКС) к мембране клетки, в результате чего происходит (5) фосфорилирование некоторых белков, в том числе и белков ионных каналов.
(6) ИФ3 активирует кальциевые (Са 2+ ) каналы гладкой эндоплазматической сети.
(7) Ионы Са 2+ -поступают в цитозоль. (8) Происходит активация Са 2+ -зависимых ферментов.
— Транскрипция генов. В настоящее время установлено, что рефлекторный ответ на повторяющиеся воздействия способен либо прогрессивно увеличиваться при формировании сенсибилизации, что в большинстве случае происходит под влиянием вредоносных стимулов, либо уменьшаться при формировании приспособления, что чаще встречается при воздействии безвредных стимулов. В ходе экспериментов на животных, изучались рефлекторные дуги, в которых были задействованы чувствительные, двигательные и ассоциативные нейроны, было показано, что для развития сенсибилизации характерно образование новых синаптических контактов между ассоциативными и двигательными нейронами; это сопровождается дополнительным синтезом и высвобождением медиаторов. Для развития приспособления, напротив, характерно снижение синтеза и высвобождение медиаторов. Данные процессы обусловлены изменением транскрипции генов.
Повторяющиеся вредоносные стимулы оказывают влияние на цАМФ, в результате чего происходит чрезмерная активация протеинкиназ, участвующих в фосфорилировании белков, регулирующих транскрипцию генов. При этом увеличивается синтез белков (в том числе и ферментов), необходимых для синтеза медиаторов и построения новых ионных каналов и цитоскелета синапса. Действие повторяющихся безвредных стимулов заключается только в снижении синтеза и высвобождения медиаторов.
Влияния транскрипции генов играют особенно значимую роль в процессе формирования долгосрочной памяти.
Видео физиология синапса и нерва — профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата публикации: 11.11.2018
Источник
Постсинаптическая мембрана способ передачи нервного импульса
Механизм химической передачи нервных импульсов через синапс сводится к тому, что содержимое синаптических пузырьков (медиатор) поступает в виде небольших порций (квантов) в синаптическую щель и взаимодействует затем с рецепторными белками постсинаптической мембраны. Это вызывает деполяризацию мембраны и возбуждение следующего нейрона. Ультраструктурные особенности синапса и механизм передачи импульсов определяют строгую однонаправленность передачи импульсов, что лежит в основе проведения импульсов по рефлекторным дугам.
В зависимости от того, какое вещество выполняет роль нейромедиатора, синапсы подразделяются на холинергические (медиатор — ацетилхолин), адренергические (адреналин и норадреналин), дофаминергические (дофамин), серотонинергические (серотонин), пептидергические (медиаторы — пептиды и аминокислоты, например, мет-энкефалин, гамма-аминомасляная кислота, глицин и др.).
Нейрохимические синапсы подразделяются в функциональном отношении на две противоположные по своему значению группы — возбуждающие и тормозные. Свойства этих синапсов зависят как от медиаторов, так и от ультраструктурных особенностей синапсов. Так, некоторые медиаторы (например, глутамат) характерны для возбуждающих синапсов, а в тормозных синапсах медиатором является гамма-аминомасляная кислота. Предполагают, что в возбуждающих синапсах к постсинаптической мембране прилежит электронно-плотное вещество, в связи с чем синапс приобретает асимметричное строение.
В пресинаптических частях таких соединений содержатся круглые синаптические пузырьки. Тормозные синапсы имеют симметричное строение. Синаптическая щель у них сужена и в пресинаптической части содержатся уплощенные синаптические пузырьки.
Кроме нейрохимических синапсов между нервными клетками (преимущественно между дендритами или телами нейронов) возникают электротонические синапсы. Последние у млекопитающих встречаются редко и по строению соответствуют щелевым контактам. Они проводят возбуждение благодаря формированию трансмембранных каналов — коннексонов.
Каждый нейрон на своей поверхности имеет огромное количество (до 10000) синапсов. Интеграция импульсов в пределах отдельного нейрона происходит так: от синапсов, расположенных на дендритах и теле, по его плазмолемме передается импульс к аксонному холмику (генераторному пункту нейрона), где путем суммирования всех возбуждающих и тормозных импульсов возникает результирующий потенциал действия.
Синаптические структуры обладают высокой чувствительностью к действию токсических факторов, в том числе психотропных отравляющих веществ. Их изменения играют важную роль в механизмах реактивности нервных тканей.
Рецепторные нервные окончания подразделяются на две группы: экстерорецепторы, воспринимающие раздражения из внешней среды, и интерорецепторы, служащие для восприятия раздражений из внутренней среды организма. В зависимости от специфичности раздражения, воспринимаемого рецептором, различают следующие чувствительные нервные окончания: механорецепторы, барорецепторы, хеморецепторы, терморецепторы, болевые рецепторы (ноцицепторы). Все рецепторы по особенностям их строения подразделяют на свободные и несвободные нервные окончания.
Первые из них состоят только из конечных разветвлений периферического отростка чувствительного нейрона; вторые — имеют в составе рецептора кроме нервного отростка глиальный компонент, а нередко и соединительнотканную капсулу. В последнем случае несвободные рецепторные окончания называют инкапсулированными. К числу таких рецепторов относятся пластинчатые, осязательные тельца, концевые колбы, мышечные веретена и др.
Эффекторные нервные окончания подразделяются на двигательные и секреторные. Двигательный, или моторный, эффектор передает нервные импульсы на рабочие органы и ткани. В скелетных мышцах они называются нервно-мышечными (аксомышечными) окончаниями. Терминальное разветвление аксона двигательного нейрона заканчивается булавовидным расширением. Оно соответствует пресинаптической части нервно-мышечного синапса, содержит скопление синаптических пузырьков и митохондрий, ограничено пресинаптической мембраной характерного строения.
Плазмолемма мышечного волокна в этой области образует многочисленные складки и углубления. В постсинаптической части волокна находится зернистая саркоплазма с большим количеством митохондрий и овальных ядер. Синаптическая щель имеет ширину 50-100 нм. У человека медиатором в нервно-мышечных синапсах является ацетилхолин. Моторные окончания в гладкой мышечной ткани, а также секреторные эффекторы имеют вид тонких пучков аксонов или их одиночных терминалей, прилежащих к клеткам иннервируемых тканей.
Возрастные изменения нервных тканей связаны с постепенным уменьшением запаса нервных клеток, особенно — чувствительных нейронов, а также снижением уровня метаболических процессов, что выражается в закономерном накоплении включений липофусцина («пигмент изнашивания») в нейроплазме.
Источник