Сульфид калия: способы получения и химические свойства
Сульфид калия K2S — белое вещество, плавится без разложения. Термически устойчивый. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 110,26; относительная плотность для тв. и ж. состояния d = 1,74; tпл = 912º C.
Способ получения
1. Сульфид калия можно получить путем взаимодействия калия и серы при температуре 100 — 200º C:
2K + S = K2S
2. При взаимодействии с углеродом (коксом) сульфат калия при температуре 900º C образует сульфид калия и угарный газ:
3. При температуре 600º C в присутствии оксида железа (III) сульфат калия реагирует с водородом . Взаимодействие сульфата калия с водородом приводит к образованию сульфида калия и воды:
Качественная реакция
Качественная реакция на сульфид калия — взаимодействие его с хлоридом меди, в результате реакции происходит образование черного осадка:
1. При взаимодействии с хлоридом меди , сульфид калия образует осадок сульфид меди и хлорид калия:
CuCl2 + K2S = CuS↓ + 2KCl
Химические свойства
1. Сульфид калия может реагировать с простыми веществами :
Твердый сульфид калия реагирует с кислородом при температуре выше 500º C. При этом образуется сульфат калия:
2. Сульфид калия вступает в реакцию со многими сложными веществами :
2.1. Сульфид калия способен реагировать со многими кислотами :
2.1.1. Сульфид калия реагирует с разбавленной хлороводородной кислотой . Взаимодействие сульфида калия с хлороводородной кислотой приводит к образованию хлорида калия и газа сероводорода:
K2S + 2HCl = 2KCl + H2S↑
2.1.2. Сульфид калия взаимодействует с концентрированной серной кислотой . При этом образуются гидросульфат калия, газ оксид серы, осадок сера и вода:
2.1.3. При взаимодействии сульфида калия с концентрированной азотной кислотой выделяются нитрат калия, газ оксид азота, сера и вода:
2.1.4 . Взаимодействуя с насыщенной сероводородной кислотой холодный сульфид калия образует гидросульфид калия:
Источник
Сульфид калия
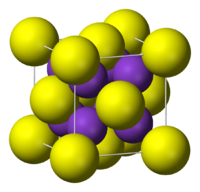
Соединение сульфид калия представляет собой кристаллы сингони́ческой формы, не имеющие цвета. Его температура плавления равняется 948 °С, при удельной плотности вещества 1,805 г/см3 (плотность задается при стандартной температуре 14 °С). Кристаллы хорошо растворимы в водном растворе и обладают высокой гигроскопичностью. Кроме того, сульфид калия подвергается гидролизу, хорошо растворим в глицерине и этаноле. При взаимодействии с ними в ходе реакций образуются дигидраты и пентагидраты, представляющие собой бесцветные кристаллы, характеризующиеся величиной H0обр, соответственно, -984,5 и -1880,0 кДж/моль.
Вещество очень легко поддается окислению на открытом воздухе, при этом образуется K2S2O3, а при горении выделяется SO2. Получают сульфид калия, формула которого K2S, взаимодействием К2СО3 с серой, при этом необходимо обеспечить течение реакции, исключающей приток воздуха. Можно получить вещество и путем восстановительной реакции, воздействуя углеродом на соль K2SO4.
Калия сульфид широко используется как необходимый компонент в составе светочувствительных эмульсий и покрытий в промышленности и фотографии. В химическом производстве его применение основано на способности выступать реагентом при осуществлении разделения различных сульфидов металлов. Применение в текстильной промышленности и кожевенном производстве состоит во включении калия сульфида в состав средств для первичной обработки кож.
В виде гидросульфида KHS или полисульфидов вещество используют в технологиях сульфидирования металлосплавов, чугуна и стали. Оно очень широко применяется при изготовлении лекарственных препаратов для лечения различных кожных заболеваний. Сельскохозяйственное назначение калия сульфида – применение в качестве пестицида.
Как правило, сульфид калия получают довольно простым способом. Для этого смешивают негашеную известь с серой и поташом. Затем эту смесь растворяют в воде и кипятят несколько часов. В результате такой процедуры образуется полисульфид калия. Затем из полученного раствора через фильтр удаляют осадок карбоната кальция, а сам раствор упаривают до достижения им удельного веса 1,25-1,30. Наконец, в раствор еще подмешивают небольшое количество серы, вновь кипятят, а после охлаждения сливают.
Образование калия сульфида происходит количественно, однако для такого течения реакции необходимо обеспечивать очень медленное испарение паров NH3 через специальную трубку, которая предварительно должна заполняться гидроксидом калия. В результате правильно проведенной реакции должен получиться бесцветный раствор аммиака и осадок белого цвета, которым и является сульфид калия.
Полученное вещество необходимо довольно длительное время откачивать специальным масляным насосом, а затем следует прокалить при температуре 400-500 °С. Как правило, после этого полученные кристаллы измельчают и очищают азотом в пробирках под вакуумом.
Получаемый в результате гидролиза дисульфид калия представляет собой порошок желтого цвета, его формула — K2S2. Молекулярная масса вещества составляет 142,327 а.е.м. При температуре 477 °C дисульфид начинает плавиться, а при 600 °C он разлагается.
Калия сульфид взаимодействует с различными веществами. Например, при реакции с первичными алкилгалогенидами получаются симметричные диалкилсульфиды. Также смешивают растворы калия сульфида с растворами различных (прежде всего — хромокалиевых и алюмокалиевых) квасцов.
Для медицинских целей используется калия сульфид высокой степени очистки. В этой отрасли он представлен различными углями, которые получают из смеси собственно самого вещества, его гидроксида и серы. Активирование медицинских углей происходит в специальных печах при температуре не ниже 800 — 900 °С. Затем происходит очистка от сернистых соединений и отмывание от иона хлора соляной кислотой.
Источник
Сульфид калия
| Сульфид калия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Общие | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Систематическое наименование | калия сульфид | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Традиционные названия | калий сернистый, сульфид калия, калия моносульфид | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая формула | K2S | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Состояние (ст. усл.) | бесцветный порошок с запахом тухлых яиц | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная масса | 110,262 г/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность | 1,805 г/см³ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Термические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 471; 948 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоёмкость (ст. усл.) | 76,15 Дж/(моль·К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энтальпия образования (ст. усл.) | −387,3 кДж/моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Растворимость в воде | растворяется с образованием KSH, KOH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Растворимость в остальных веществах | растворяется в этаноле и глицерине | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Структура | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | кубическая сингония | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Классификация | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рег. номер CAS | 1312-73-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RTECS | TT6000000 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Безопасность | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Токсичность | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Wikimedia Foundation . 2010 . ПолезноеСмотреть что такое «Сульфид калия» в других словарях:сульфид калия — сернистокислый калий, сернистый калий … Cловарь химических синонимов I Сульфид золота(I) — Общие Систематическое наименование Сульфид золота(I) Традиционные названия сернистое золото Химическая формула Au2S Физические свойства Состояние … Википедия Сульфид золота(II) — Общие Систематическое наименование Сульфид золота(II) Традиционные названия Сернистое золото Химическая формула AuS Физические свойства Состояние ( … Википедия Сульфид золота(III) — Общие Систематическое наименование Сульфид золота(III) Традиционные названия Сернистое золото Химическая формула Au2S3 Физические свойства … Википедия Сульфид платины(II) — Общие Систематическое наименование Сульфид платины(II) Традиционные названия Сернистая платина Химическая формула PtS Физические свойства Состояние ( … Википедия Сульфид железа(II) — Сульфид железа(II) … Википедия Сульфид платины(III) — Общие Систематическое наименование Сульфид платины(III) Традиционные названия Сернистая платина Химическая формула Pt2S3 Физические свойства … Википедия Сульфид платины(IV) — Общие Систематическое наименование Сульфид платины(IV) Традиционные названия Сернистая платина Химическая формула PtS2 Физические свойства Состоя … Википедия Сульфид меди(I) — Кристалличесая структура халькозина … Википедия Сульфид рения(VII) — Общие Систематическое наименование Сульфид рения(VII) Традиционные названия Сернистый рений Химическая формула Re2S7 Физические свойства … Википедия Источник | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|









 500^oC> \ K_2SO_4>» border=»0″/>
500^oC> \ K_2SO_4>» border=»0″/>






