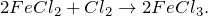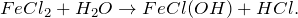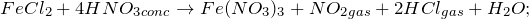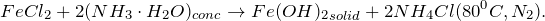Как получить FeCl3
Содержание статьи
Зачем нужен хлорид железа?
Хлорид железа (FeCl₃ , хлорное железо, трихлорид железа) – это соль трехвалентного железа и соляной кислоты. Представляет собой мягкое вещество красно-коричневого, зеленоватого или фиолетового оттенка с характерным металлическим блеском. При контакте с воздухом хлорид железа приобретает желтый оттенок и по цвету и консистенции становится похожим на влажный песок.
Целый ряд свойств, которыми обладает хлорид железа благодаря своему химическому составу, делает это вещество незаменимым в промышленности. Так, хлорное железо используется в радиоэлектронике для потравы плат; в пищевой промышленности участвует в процессе пивоварения и выпечки хлебобулочных изделий; входит в состав реактивов, которые используются при печати фотографий; в текстильной промышленности участвует в производстве тканей; при помощи хлорного железа очищают воду в промышленных масштабах; хлорид железа является важным элементом в металлургической и химической промышленности.
Кроме этого, хлорное железо необходимо человеку для нормальной жизнедеятельности организма. Оно помогает организму восполнить нехватку железа, связанную с потерей крови или при нарушении усвояемости железа. Поскольку нехватка хлорного железа может негативно отразиться на работе организма, в фармакологии существует множество препаратов, в состав которых входит FeCl₃.
Способы получения
Существует несколько способов получения трихлорида железа. Так, хлорид железа образовывается в результате взаимодействия одновалентного железа с чистым хлором: 2Fe + 3Cl2 = FeCl₃.
Кроме того, хлорид железа можно получить путем окисления двухвалентного хлорида железа хлором: 2FeCl2 + Cl2 = 2FeCl₃.
Также хлорид железа получается в процессе окисления хлорида железа (II) сернистым газом. В этом случае происходит более сложная химическая реакция: 4FeCl2 + SO2 + 4HCl = 4FeCl3 + S + 2H2O.
В домашних условиях можно провести несколько интересных экспериментов, в ходе которых удастся получить хлорид железа.
Эксперимент 1.
Потребуется сильно проржавевшая железная стружка (подойдет обычная ржавчина со старой трубы) и раствор соляной кислоты в пропорциях 1:3. Железо необходимо положить в стеклянную емкость и залить соляной кислотой. Поскольку химическая реакция в данном случае протекает достаточно медленно, придется подождать несколько дней. Когда реактив приобретет характерных желто-коричневый оттенок, жидкость из емкости сливается, а полученный осадок фильтруется.
Эксперимент 2.
В стеклянной емкости в пропорциях 2:2:6 смешать 30-процентный раствор перекиси водорода, соляную кислоту и воду. В результате химической реакции образуется раствор хлорида железа.
Эксперимент 3.
Хлорид железа также можно получить в результате реакции соляной кислоты и оксида железа Fe2O3. Для этого соляная кислота помещается в стеклянную емкость. Осторожно, маленькими порциями в нее добавляется оксид железа (железный сурик).
Важно помнить, что соляная кислота очень токсична и при попадании на кожу вызывает серьезные ожоги. Кроме того, в ходе химических реакций выделяются пары железа, которые могут вызвать поражения дыхательных и зрительных органов. Резиновые перчатки, защитная маска и очки помогут предотвратить эти негативные последствия.
Источник
как из FeCl2 получить FeCl3
Кто знает, как из FeCl2 получить FeCl3? Запишите уравнения всех возможных реакций. Приведите основные физические параметры хлорида железа (II), расскажите о химических свойствах и способах получения этой соли.
Хлорид железа (III) можно получить, пропуская через раствор хлорида железа (II) газообразный хлор (как из FeCl2 получить FeCl3). Молекулярное уравнение реакции имеет вид:
Безводный хлорид железа (II) представляет собой кристаллы белого цвета (в виде кристаллогидрата – зеленые), которые плавятся и кипят без разложения. Летуч в потоке НС1 при нагревании, в газе — димер 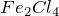
Разлагается кипящей водой, кислотами, щелочами, гидратом аммиака:
Типичный восстановитель, при стоянии раствора окисляется растворенным в воде кислородом. Восстанавливается водородом. Вступает в реакции обмена и комплексообразования.
Хлорид железа (II) получают растворением железа в соляной кислоте
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |