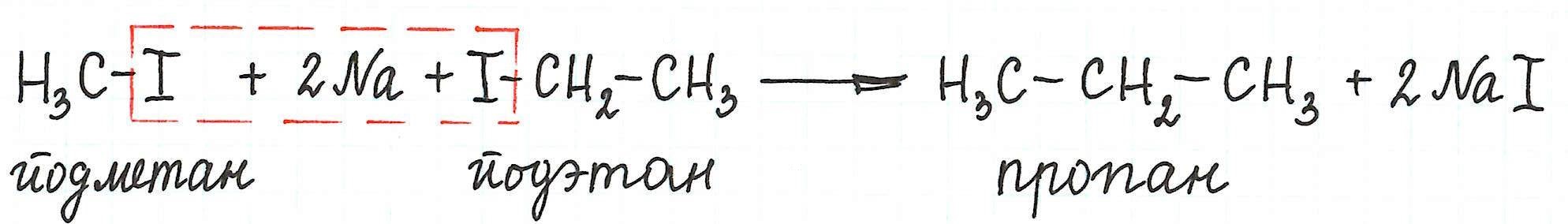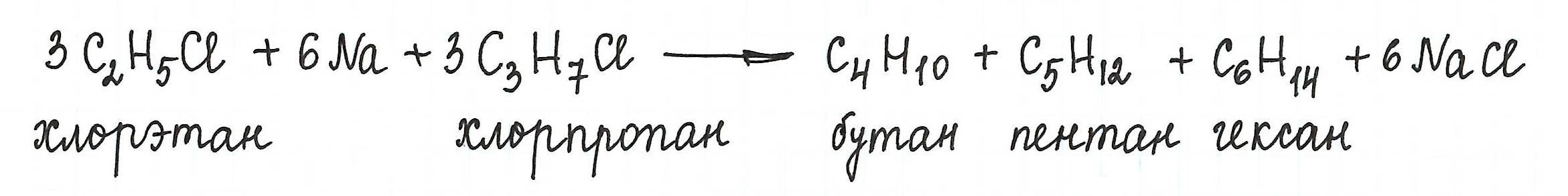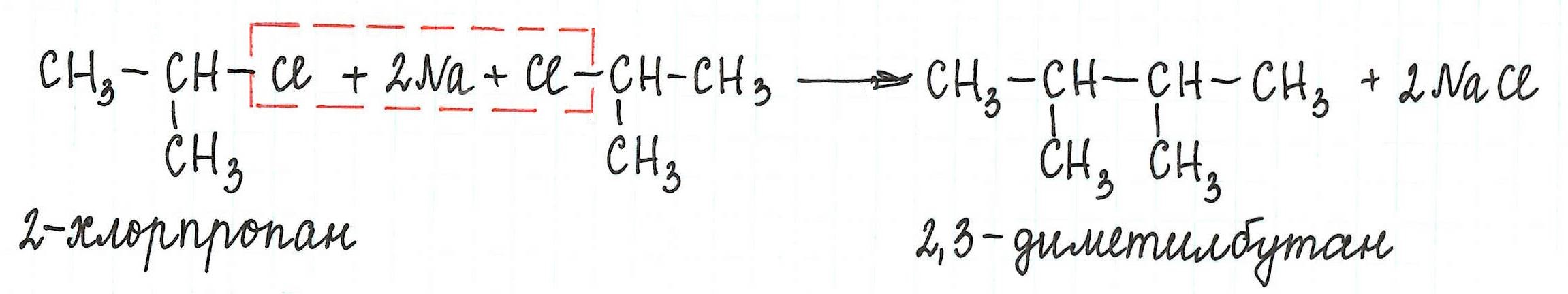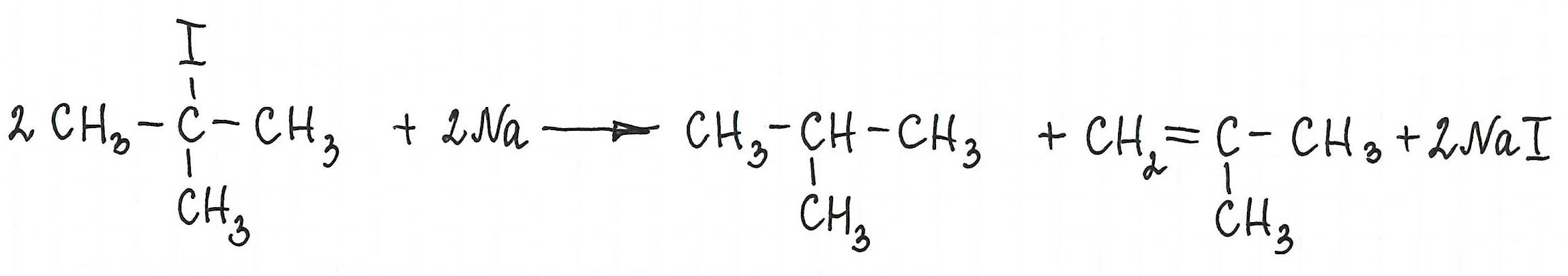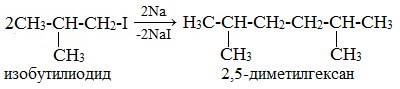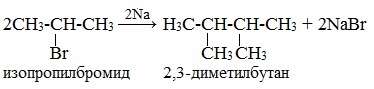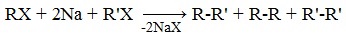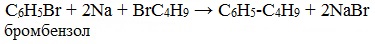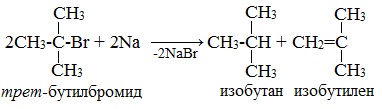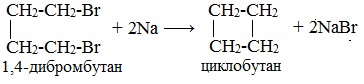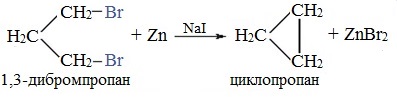- РЕАКЦИЯ ВЮРЦА
- Примеры межмолекулярной реакции Вюрца
- Примеры внутримолекулярной реакции Вюрца
- Основные способы получения углеводородов
- Выделение углеводородов из природного сырья
- Изомеризация углеводородов
- Гидрирование (присоединение водорода) алкенов
- Декарбоксилирование натриевых солей карбоновых кислот
- Синтез Вюрца
- Гидролиз карбидов
- Получит углеводороды по способу вюрца
- Внутримолекулярная реакция Вюрца
- Способы получения алканов
РЕАКЦИЯ ВЮРЦА
Примеры реакции Вюрца очень популярны в задачах на цепочки превращений веществ.
Вюрц, Шарль Адольф (1817 – 1884), Франция.
Химик-органик, был у истоков создания органического синтеза.
1855г – открыл метод получения предельных углеводородов действием металлического натрия (или калия) на галогеналканы.
Этот метод носит имя ученого. Он известен под названием «реакция Вюрца» (или «синтез Вюрца»).
Подробнее об ученом здесь
Примеры межмолекулярной реакции Вюрца
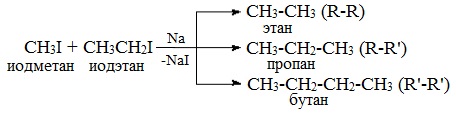
* Реакцией Вюрца обычно получают алканы с четным числом атомов углерода в цепи. Причем количество углеродных атомов удваивается по сравнению с исходным веществом.
* Однако, при взаимодействии разных галогеналканов можно получить предельный углеводород с нечетным количеством атомов углерода в цепи:
* А вот взаимодействие галогеналканов с более длинной углеродной цепью приводит к образованию смеси алканов:
Отметим, что подобную смесь чрезвычайно трудно разделить на отдельные вещества.
* В результате взаимодействия галогеналканов с галогеном у вторичного атома углерода можно получить предельный углеводород разветвленного строения (однако, такие реакции используют редко):
* Примеры реакции Вюрца, в которой участвуют галогенопроизводные с галогеном у третичного атома углерода, привести не возможно: таковая не существует. В результате их взаимодействия с металлическим натрием (или калием) образуются алкан и алкен с изначальной углеродной структурой :
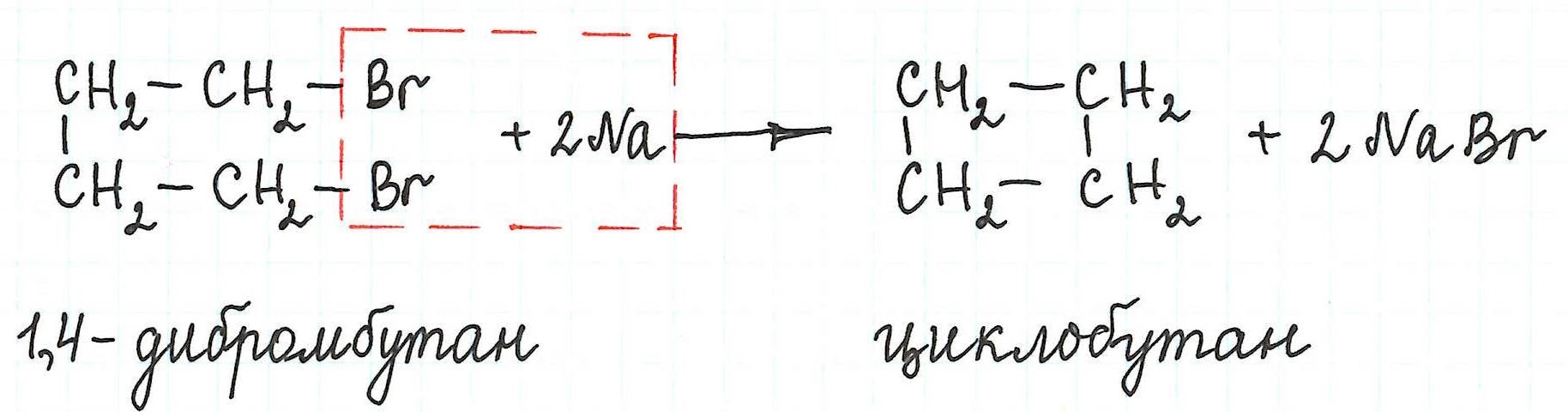
Примеры внутримолекулярной реакции Вюрца
Внутримолекулярная реакция Вюрца приводит к образованию циклоалканов :
Реакция Вюрца обычно проходит при невысоких температурах и в среде эфира (например, диэтилового). Лучше, если в качестве галогеналкана будет вещество, содержащее бром или йод. Галогеналкан, в составе которого присутствует хлор, хуже вступает в подобные взаимодействия.
Источник
Основные способы получения углеводородов
Выделение углеводородов из природного сырья
Источниками предельных углеводородов являются нефть и природный газ. Основной компонент природного газа – простейший углеводород метан, который используется непосредственно или подвергается переработке. Нефть, извлеченная из земных недр, также подвергается переработке, ректификации, крекингу. Больше всего углеводородов получают при переработке нефти и других природных ресурсов. Но значительное количество ценных углеводородов получают искусственно, синтетическими способами.
Изомеризация углеводородов
Наличие катализаторов изомеризации ускоряет образование углеводородов с разветвленным скелетом из линейных углеводородов. Добавление катализаторов позволяет несколько уменьшить температуру, при которой протекает реакция. 
Гидрирование (присоединение водорода) алкенов
В результате крекинга образуется большое количество непредельных углеводородов с двойной связью — алкенов. Уменьшить их количество можно, добавив в систему водород и катализаторы гидрирования — металлы (платина, палладий, никель):
Крекинг в присутствии катализаторов гидрирования с добавлением водорода называется восстановительным крекингом. Основными его продуктами являются предельные углеводороды. Таким образом, повышение давления при крекинге (крекинг высокого давления) позволяет уменьшить количество газообразных (CH4 – C4H10) углеводородов и повысить содержание жидких углеводородов с длиной цепи 6-10 атомов углерода, которые составляют основу бензинов.
Это были промышленные способы получения алканов, которые являются основой промышленной переработки основного углеводородного сырья — нефти.
Теперь рассмотрим несколько лабораторных способов получения алканов.
Декарбоксилирование натриевых солей карбоновых кислот
Нагревание натриевой соли уксусной кислоты (ацетата натрия) с избытком щелочи приводит к отщеплению карбоксильной группы и образованию метана:

Если вместо ацетата натрия взять пропионат натрия, то образуется этан, из бутаноата натрия — пропан и т. д.
Синтез Вюрца
При взаимодействии галогеналканов со щелочным металлом натрием образуются предельные углеводороды и галогенид щелочного металла, например:
Действие щелочного металла на смесь галоген углеводородов (например, бромэтана и бромметана) приведет к образованию смеси алканов (этана, пропана и бутана).
. Реакция синтеза Вюрца ведет к удлинению цепи предельных углеводородов.
Реакция, на которой основан синтез Вюрца, хорошо протекает только с галогеналканами, в молекулах которых атом галогена присоединен к первичному атому углерода.
Гидролиз карбидов
При обработке некоторых карбидов, содержащих углерод в степени окисления -4 (например, карбида алюминия), водой образуется метан:
Источник
Получит углеводороды по способу вюрца
Реакция Вюрца — конденсация алкилгалогенидов под действием Na (реже — Li или К) с образованием предельных углеводородов.
Реакция Вюрца — метод синтеза симметричных насыщенных углеводородов действием металлического натрия на алкилгалогениды (галогеналканы).
Легче реакция происходит с алкилиодидами и алкилбромидами, труднее – с алкилхлоридами.
В результате образуется алкан с более сложной углеродной цепью.
Реакцию обычно проводят в диэтиловом эфире.
В процессе реакции Вюрца происходит удвоение углеводородного скелета молекулы и образуется насыщенный углеводород (алкан). Эта реакция находит ограниченное применение, поскольку таким путем можно получать только симметричные алканы.
В основном с ее помощью получают предельные углеводороды с длинной углеродной цепью, особенно она полезна при получении индивидуальных углеводородов большой молекулярной массы (например, гептаконтана C70H142).
Реакцию используют для получения углеводородов с четным числом С-атомов. Если ввести в реакцию два различных галогеналкана, то образуется смесь трех продуктов.
Например, при взаимодействии метил- и этилиодидов с натрием наряду с пропаном образуется этан и бутан:
Эта реакция была открыта французким химиком Ш. Вюрцем в 1855 г. при попытке получения этилнатрия из хлористого этила и металлического натрия.
В 1864г. немецкий химик Р. Фиттиг предложил реакцию, подобную реакции Вюрца, для синтеза жирноароматических углеводородов (реакция Вюрца-Фиттига).
Реакция Вюрца используется для первичных алкилгалогенидов. Для вторичных алкилгалогенидов не имеет практического значения, т.к выход целевого продукта составляет всего 10-15%.
Реакцию Вюрца невозможно использовать для третичных алкилгалогенидов, т.к. вместо алкана с удвоенным числом атомов углерода образуется смесь алкана и алкена с исходным углеродным скелетом.
Внутримолекулярная реакция Вюрца
Реакция Вюрца успешно применяется для внутримолекулярных конденсаций. Этим путем можно получать циклоалканы заданного строения.
При взаимодействии 1,4-дибромбутана с металлическим натрием можно получить циклобутан:
Из 1,3-дибромпропана под действием металлического цинка и йодида натрия, как активатора, может быть получен циклопропан:
Источник
Способы получения алканов
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
| Например, хлорметан реагирует с натрием с образованием этана:
Хлорэтан взаимодействует с натрием с образованием бутана: Реакция больше подходит для получения симметричных алканов. При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
|