Нитрат железа(III)
| Нитрат железа(III) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат железа(III) |
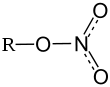
| Химическая формула | Fe(NO3)3 |
| Физические свойства | |
| Состояние (ст. усл.) | гигроскопичные кристаллы |
| Молярная масса | (ангидрид) 241.86 г/моль |
(нонагидрат) 403.999 г/моль
Нитрат железа(III) — неорганическое химическое соединение, соль азотной кислоты и железа III с формулой 
Содержание
Физические свойства
Нонагидрат нитрата железа(III) Fe(NO3)3·9H2O — очень гигроскопичные светло-фиолетовые кристаллы с моноклинной решёткой (a = 0,140 нм, b = 0,970 нм, c = 1,103 нм, β=95,52°, пространственная группа P21/с). Хорошо растворяются в воде. При нагревании плавится при 50,1 °C с частичным разложением и выделением HNO3.
Гексагидрат нитрата железа(III) Fe(NO3)3·6H2O — бесцветные гигроскопичные кристаллы с кубической решёткой. Образуется при кристаллизации из раствора с содержанием HNO3 около 50%.
Безводный нитрат железа(III) получить не удалось.
Получение
Нитрат железа(III) получают взаимодействием железной стружки с 20-30% раствором азотной кислоты:
В производстве этот процесс проводят продувая через раствор воздух:
В лабораторной практике нитрат железа(III) можно получить обменной реакцией:
Добавив к гидроксонитрату церия азотную кислоту и сульфат железа(II) получим следующие продукты реакции:
Химические свойства
В водных растворах нитрат железа(III) подвергается сильному гидролизу:
равновесие можно сместить в обратную сторону сильно подкислив раствор HNO3.
Разрушается разбавленными щелочами:
При нагревании разлагается:
Применение
Применяется как коагулянт при очистке сточных вод.
При окраске тканей используют нитрат железа(III) как протраву.
Нитрат железа(III) является катализатором для синтеза амида натрия из раствора натрия в аммиаке:
Некоторые глины, пропитанные нитратом железа(III), являются полезными окислителями в органическом синтезе. Также он используется ювелирами и кузнецами для протравки серебра и его сплавов.
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Нитрат железа(III)» в других словарях:
Нитрат актиния(III) — Общие Систематическое наименование Нитрат актиния (III) Традиционные названия Нитрат актиния Химическая формула Ac(NO3)3 Эмпирическая формула Ac(NO3)3 … Википедия
Нитрат железа(II) — Нитрат железа (II) это соль образованная реакцией нейтрализации гидроксида железа(II) и азотной кислоты с общей молекулярной формулой Fe(NO3)2. Насыщенность его водного р ра составляет 86,95г при температуре 24 °С (при t=0°С равна 71,03г,… … Википедия
железа(III) нитрат — geležies(III) nitratas statusas T sritis chemija formulė Fe(NO₃)₃ atitikmenys: angl. ferric nitrate; iron(III) nitrate rus. железа(III) нитрат; железо азотнокислое окисное ryšiai: sinonimas – geležies tris(trioksonitratas) … Chemijos terminų aiškinamasis žodynas
Сульфат железа(III) — У этого термина существуют и другие значения, см. Сульфат железа. Сульфат железа(III) … Википедия
Хлорид железа(III) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(III) … Википедия
Оксид железа(III) — Оксид железа(III) … Википедия
Бромид железа(III) — У этого термина существуют и другие значения, см. Бромид железа. Бромид железа(III) Общие Традиционные названия Трибомид железа Химическая формула FeBr3 Физические свойства Сос … Википедия
Фторид железа(III) — У этого термина существуют и другие значения, см. Фторид железа. Фторид железа(III) Общие Систематическое наименование Фторид железа(III) Традиционные названия Фтористое железо Химическая формула FeF3 … Википедия
Гидроксид железа(III) — Общие Систематическое наименование Гидроксид железа(III) Традиционные названия Гидроокись железа Химическая формула Fe(OH)3 Физические свойства Состояние ( … Википедия
Фосфат железа(III) — Фосфат железа(III) … Википедия
Источник
Нитрат железа (III)
| Нитрат железа (III) | |
|---|---|
| Систематическое наименование | Нитрат железа (III) |
| Хим. формула | Fe(NO3)3 |
| Состояние | гигроскопичные кристаллы |
| Молярная масса | |
| Энтальпия | |
| • образования | (нонагидрат) -3338,8 кДж/моль |
| Растворимость | |
| • в воде(0°C) | 40,2% |
| • в воде (20°C) | 45,2% |
| • в воде (25°C) | 46,6% |
| • в воде (40°C) | 51,2% |
| Координационная геометрия | октаэдрическая |
| Рег. номер CAS | |
| PubChem | 168014 |
| Рег. номер EINECS | 233-899-5 |
| SMILES | |
| RTECS | NO7175000 |
| ChemSpider | 23584 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат железа (III) — неорганическое химическое соединение, соль азотной кислоты и трехвалентного железа.
Содержание
Физические свойства
При обычной температуре в зависимости от концентрации и содержания в растворе кислоты нитрат железа (III) кристаллизуется в виде почти бесцветных кубиков, имеющих состав Fe(NO3)3·6H2O, или в моноклинных кристаллах состава Fe(NO3)3·9H2O.
Гексагидрат нитрата железа (III) Fe(NO3)3·6H2O — светло-фиолетовые гигроскопичные кристаллы с кубической решёткой. Образуется при кристаллизации из водных растворов с содержанием HNO3 не менее 57 % и 28 % Fe(NO3)3.
Нонагидрат нитрата железа (III) Fe(NO3)3·9H2O — очень гигроскопичные светло-фиолетовые кристаллы с моноклинной решёткой (a = 0,140 нм, b = 0,970 нм, c = 1,103 нм, β=95,52°, пространственная группа P21/с). Хорошо растворяются в воде. При нагревании плавится при 50,1 °C. Процесс сопровождается частичным разложением исходного продукта с выделением HNO3 и последующим кипячением раствора при 125 °C.
Таблица растворимости нитрата железа (III) в воде (в пересчете на безводную соль):
| Температура, °С | Концентрация, г/100 г воды | Концентрация, % |
| 0 | 67,08 | 40,15 |
| 20 | 82,48 | 45,2 |
| 40 | 104,83 | 51,18 |
Растворяется также в ацетоне, эфире, этаноле.
Безводный нитрат железа (III) получить не удалось.
В растворе бледно-фиолетовый гексааквакатион [Fe(H2O)6] 3+ преобладает только в том случае, если pH
0. При более высоких значениях pH раствор желтеет из-за гидролиза, а если pH выше 2-3, происходит дальнейшая конденсация и начинается образование коллоидных гелей, и в конечном итоге образуется красновато-коричневый осадок гидратированного оксида железа (III).
Получение
- Нитрат железа (III) получают взаимодействием железной стружки с 20-30 % раствором азотной кислоты:
Fe + 4HNO3 ⟶ Fe(NO3)3 + 2H2O + NO↑
- В производстве этот процесс проводят, продувая через раствор воздух:
4Fe + 12HNO3 + 3O2 ⟶ 4 Fe(NO3)3 + 6H2O
- В лабораторной практике нитрат железа (III) можно получить обменной реакцией:
Fe2(SO4)3 + 3Ba(NO3)2 ⟶ 2 Fe(NO3)3 + 3BaSO4↓
- Добавив к гидроксонитрату церия (IV) азотную кислоту и сульфат железа (II), получим следующие продукты реакции:
Ce(NO3)3OH + 3HNO3 + FeSO4 ⟶ Ce(NO3)3 + Fe(NO3)3 + H2SO4 + H2O
Химические свойства
- В водных растворах нитрат железа (III) подвергается сильному гидролизу:
Fe(NO3)3 + 2H2O ⇄ Fe(OH)2NO3 + 2HNO3
Равновесие можно сместить в обратную сторону сильно подкислив раствор HNO3.
— Выступает в роли окислителя с металлами, например, с медью:
Источник