Молочная кислота
Молочная кислота СН3—СН(ОН)—СООН (α-оксипропионовая, этилиденмолочная) содержит асимметрический атом углерода и поэтому может существовать, в оптически изомерных формах.
Молочная кислота может быть получена различными синтетическими способами, но при всех этих синтезах кислота получается в виде оптически недеятельной, т. е. всегда получаются равные количества правого и левого изомеров. То же наблюдается и во всех других случаях, когда путем синтетических реакций получаются вещества, содержащие асимметрический атом углерода.
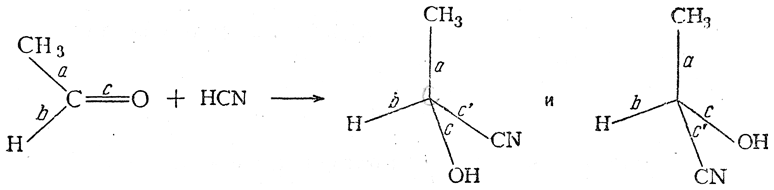
Причина обязательного образования оптически недеятельных соединений при синтетических реакциях может быть показана на следующих примерах:
Как видно из приведенной схемы, при действии цианистоводородной кислоты на уксусный альдегид анион CN – может атаковать π-связь карбонильной группы равновероятно как с одной, так и с другой стороны плоскости, в которой расположены σ-связи а, b и с молекулы кетона. В результате должны образоваться равные количества оптически изомерных молекул оксинитрилов.
Точно так же в тех случаях, когда асимметрический атом углерода появляется в результате реакций замещения
вероятности образования молекул оптических антиподов совершенно одинаковы, что и должно вести к образованию оптически недеятельных смесей или рацемических соединений.
Значительные количества молочной кислоты образуются при действии щелочей на водные растворы простейших сахаристых веществ (моноз). Так, например, из смеси глюкозы и фруктозы («инвертный» сахар) можно получить до 60% молочной кислоты. И в этом случае образуется недеятельная молочная кислота.
Наиболее важным источником получения молочной кислоты является процесс молочнокислого брожения, которому легко подвергаются растворы многих сахаристых веществ (молочного сахара, тростникового сахара, виноградного сахара и др.). Брожение является результатом жизнедеятельности бактерий молочнокислого брожения, зародыши которых всегда находятся в воздухе. Протеканием этого процесса и объясняется наличие молочной кислоты в кислом молоке, откуда она была впервые выделена Шееле (1780). Молочнокислое брожение сахарных растворов лучше всего протекает под действием чистых культур молочнокислых бактерий (Bacillus Delbrückii) при температуре 34—45° С, с добавкой необходимых для жизни бактерий минеральных веществ, а также мела или карбоната цинка. Последние добавки вводятся для нейтрализации свободной кислоты, так как при сколько-нибудь значительной концентрации кислоты бактерии погибают и брожение прекращается.
Молочнокислое брожение является одним из процессов, протекающих при изготовлении масла (из скисшего молока), при созревании сыра, квашении капусты, при силосовании кормов и пр. Уравнение процесса молочнокислого брожения имеет вид:
Для молочнокислого брожения, как и для спиртового, доказано существование особого энзима, зимазы молочнокислого брожения, могущего вызывать брожение и без живых бактерий (Бухнер и Мейзенгеймер).
Обычно молочнокислое брожение приводит к образованию оптически недеятельной молочной кислоты, однако часто при этом получается кислота, обладающая слабым правым или левым вращением.
Чистая левовращающая молочная (D-молочная) кислота может быть получена брожением сахаристых веществ при посредстве особого возбудителя брожения (Bacillus acidi laevolactici). Правовращающий изомер молочной кислоты (L-молочная) был открыт Либихом (1847) в мясном экстракте и получил названиемясомолочной кислоты. Правовращающая молочная кислота всегда содержится в мышцах животных.
Обыкновенная (недеятельная) молочная кислота, часто называемая «молочной кислотой брожения», долгое время была известна лишь в виде густой жидкости. Осторожным выпариванием в высоком вакууме (0,1—0,5 мм рт. ст.) можно получить ее в безводном состоянии в виде кристаллической массы, плавящейся при 18° С. Из солей i-молочной кислоты характерной является хорошо кристаллизующаяся цинковая соль, содержащая три молекулы воды (С3Н5О3)2Zn ∙ 3Н2О.
Различие свойств недеятельной молочной кислоты и оптически деятельных кислот и их солей показывает, что недеятельное вещество представляет собой не смесь, а рацемическое соединение обеих (D— и L-) кислот или их солей (лактатов).
Правовращающая (L-молочная) и левовращающая (D-молочная) кислоты представляют собой расплывающиеся на воздухе призмы с т. пл. 25—26° С. Они обладают равным, но противоположным оптическим вращением (в 10%-ном растворе [α]D 15°C =±3,82° и в 2,5%-ном [α]D 15°C =±2,67°). При продолжительном нагревании до 130—150°С оптически деятельные изомеры рацемизуются и дают ангидриды недеятельной молочной кислоты. Цинковые соли оптически деятельных изомеров молочной кислоты кристаллизуются только с двумя молекулами воды (C3H5O3)2Zn ∙ 2H2O и обе обладают совершенно одинаковой растворимостью в воде (1 : 175 при 15° С), отличной от растворимости недеятельной соли (1 : 50 при 10° С).
Оптически недеятельная молочная кислота может быть разделена на оптически деятельные изомеры с помощью плесневых грибков, а также кристаллизацией молочнокислых солей оптически деятельных алкалоидов: стрихнина, хинина или морфина.
Особенно легко (даже при высушивании в вакууме) идет выделение воды с превращением в лактид, являющийся гомологом гликолида.
Молочная кислота брожения находит значительное применение в технике, например в протравном крашении, в кожевенном производстве, в бродильных производствах (для предохранения от попадающих из воздуха посторонних бактерий), а также в медицине (80%-ный сироп; относительная плотность 1,21 — 1,22).
Источник
Получить молочную кислоту всеми способами
Молочная (2-гидроксипропионовая, α-гидроксипропионовая) кислота является простейшей гидроксикислотой, имеющей асимметричный атом углерода, обеспечивающей существование двух оптических изомеров, т. е. D (или R) и L (или S) форм. L-Молочная кислота усваивается организмом, а D-изомер — нет.
Молочная кислота в промышленности производится химическим (50 %) и ферментативным (50 %) синтезами [179].
Химический синтез основан на реакции ацетальдегида с цианистым водородом, приводящим к получению лактонитрила, гидролиз которого дает молочную кислоту.
При получении молочной кислоты с помощью молочнокислых бактерий и химическим синтезом образуется оптически недеятельная D,L-молочная кислота.
L(+)-Молочную кислоту образуют молочнокислые стрептококки (S. termophilus, S. lactis, Leuconostoc cremoris), а Lb. lactis и Lb. bukgaricus продуцируют около 90 % D(–)-молочной кислоты [104].
Возбудителем молочнокислого брожения в производстве молочной кислоты является культура Lactobacillus delbrukii.
Свойства молочнокислых бактерий [104]
Lactobacillus delbrüeckii — термофильная зерносусловая бактерия. Эти бактерии хорошо сбраживают глюкозу, мальтозу, фруктозу, галактозу и сахарозу.
Молочнокислые бактерии являются грамположительными, неподвижными, факультативными анаэробами. Они имеют форму крупных палочек длиной 7–8 мкм, толщиной 0,5–0,8 мкм и образуют, как правило, короткие цепочки из 2–4 клеток.
Молочнокислым бактериям необходимы следующие аминокислоты: аргинин, цистеин, глутаминовая кислота, лейцин, фенилаланин, триптофан, тирозин, лизин и, возможно, некоторые другие.
Из витаминов продуцент нуждается в рибофлавине, никотиновой и фолиевой кислотах; тиамин ингибирует образование молочной кислоты.
Из минерального питания для молочнокислых бактерий нужны: натрий, калий, фосфор, медь, железо, сера, магний и, особенно, марганец. Поэтому к сахаросодержащим средам необходимо добавлять сухие ростки ячменного, ржаного или пшеничного солода, солодовый экстракт, осадочные винные или спиртовые дрожжи, дрожжевой автолизат, пшеничные зародыши.
Оптимальной температурой для развития продуцента является 48–50 °С; брожение осуществляется в слабокислой среде (рН » 5,5), но при рН = 3,0 развитие бактерий прекращается. При рН выше 7 питательная среда легко инфицируется.
Вследствие чувствительности к кислотности среды образующуюся молочную кислоту нейтрализуют мелом, поддерживая кислотность на уровне 0,3–0,4 %:
Растворимость лактата кальция при 50 °С составляет 15–16 %.
Сырье для производства молочной кислоты [104, 173]
В отечественном производстве молочной кислоты сырьем служит смесь тростникового сахара-сырца, рафинадной патоки и свекловичной мелассы. Источником необходимых органических и минеральных веществ служат солодовые ростки.
Тростниковый сахар-сырец содержит, %: СВ — 99,4–99,6 (в том числе сахарозы — 96,5–98), РВ — 0,6–0,9, органических несахаров — 0,7–1.
Применение мелассы позволяет ускорить процесс брожения из-за наличия в ней необходимых для молочнокислого брожения веществ. Однако из-за интенсивной окраски мелассы применение большого ее количества приводит к затруднениям при очистке молочной кислоты.
Рафинадная патока представляет собой вязкую коричневую жидкость, содержащую не менее 72 % СВ, в том числе 49 % сахарозы, величина рН не ниже 5,5.
По сравнению с мелассой она имеет большую доброкачественность, примерно вдвое меньшую цветность, содержит меньше коллоидов (1,3–3,0 %), золы (3–5 %) и азота (0,25 %), больше инвертного сахара (10–20 %), но в ней отсутствуют витамины.
Солодовые ростки содержат до 30 % азотистых веществ, около половины которых растворяются в воде. В ростках заключена основная масса витаминов и биостимуляторов проросшего зерна: рибофлавин, пиридоксин, цианокобаламин, никотиновая кислота, пантотеновая кислота, токоферол, инозит, биотин. Ростки должны быть желтого или коричневого цвета; допускается присутствие 5–6 % зерновой примеси; минеральных веществ — не более 0,5 %.
Для получения молочной кислоты можно использовать ультрафильтраты молока и сыворотки, отходы производства фруктового сока.
Однако лучшим субстратом является D-глюкоза (выход молочной кислоты 86 %), которую можно заменить, например, гидролизатами древесины, осуществляя конверсию с помощью иммобилизованных в альгинате кальция клеток Lb. plantarum ETH B-4258.
Технология производства молочной кислоты [15, 173]
Основные стадии процесса производства молочной кислоты показаны на рис. 15.7.55 [66].
Рис. 15.7.55. Технологическая схема производства молочной кислоты
Получение посевного материала производится также в несколько стадий.
Чистую культуру рассевают в три пробирки со свежеприготовленной питательной средой. Культуру из одной пробирки (другие являются «музейной» и запасной) пересевают в колбу (500 мл), а затем в бутыль (10 л) и наконец — в культиватор. Объем засевной культуры должен быть до 30 об. % от вместимости бродильного аппарата.
Первые две стадии проводят на питательной среде из солодового сусла, третью — на среде из сусла и производственной среды (1:1) и последнюю — на производственной среде. Продолжительность каждой стадии — 20–24 ч (48–50 °С).
Показателем зрелости и активности культуры бактерий в каждой стадии размножения является плотность популяции, которая должна составлять 700–800 клеток/мл. Активная культура через 10–15 ч накапливает до 0,5 % молочной кислоты.
При подготовке инокулята бактерии пассируют несколько раз в среде с небольшим избытком мела, выдерживая при 45–55 °С; каждая стадия длится 16–18 ч.
Питательную среду готовят непосредственно в бродильном аппарате. Бродильный аппарат наполняют водой и промывными водами на 2/3 вместимости, нагревают до 70 °С, подают в него мелассу, рафинадную патоку и растворенный сахар-сырец. В среду вносят (NH4)2SO4 и NH4HPO4, а также солод или кукурузный экстракт. Массовая доля сахара в растворе должна быть 3–4 масс. %. Раствор нагревают до 70 °С и пастеризуют при этой температуре в течение 1 ч. После охлаждения до температуры 48–50 °С в раствор добавляют 15 масс. % от массы сахара солодовых ростков.
Молочнокислое брожение — образование молочной кислоты — может быть описано уравнением:
В соответствии с уравнением из 100 г глюкозы получается 100 г молочной кислоты; практический выход составляет 90–91 масс. % от массы сахара.
Поскольку при температуре ниже 45 °С развивается посторонняя микрофлора, брожение проводят при температуре 48–50 °С. Повышение температуры выше 55 °С снижает активность молочнокислых бактерий.
Сбраживание ведут в аппаратах (чанах) вместимостью 25–45 м 3 .
После приготовления питательной среды в аппарат вносят КЖ (20 об. % от его вместимости) с молочнокислыми бактериями. Через 6 ч начинают перемешивание смеси барботированием воздуха. По достижении массовой доли молочной кислоты 0,5–0,6 масс. % (примерно через сутки после засева) начинают добавлять меловое молоко, поддерживая массовую долю кислоты в растворе на уровне 0,3–0,4 масс. %.
Для нейтрализации 1 кг молочной кислоты требуется 0,55 кг карбоната кальция. В результате нейтрализации образуется 120 масс. % лактата кальция от массы сброженной гексозы или 125 масс. % от массы дисахарида.
При нормальном брожении за сутки сбраживается до 2 % сахара, убыль которого компенсируют внесением 50% раствора сахара-сырца с добавлением в него рафинадной патоки, поддерживая массовую долю сахара в среде на уровне 3–4 %. Брожение осуществляют до концентрации лактата кальция около 15 % (6–8 суток).
Для очистки культуральную жидкость, в которой находятся твердые примеси — мел, солодовые ростки, а также коллоидные частицы, обрабатывают известковым молоком температурой 70–80 °С, при этом осаждаются ионы железа, коагулируют белки, разрушается несброженный сахар. Для отделения взвешенных частиц культуральную жидкость отстаивают в течение 6–12 ч при температуре выше 48 °С. После отстаивания (6–12 ч) смесь фильтруют, и фильтрат с первой порцией промывной воды направляют на кристаллизацию лактата.
При кристаллизации лактата кальция около 2/3 соли остается в маточном растворе, поэтому, наряду с очисткой молочной кислоты кристаллизацией лактата, используется очистка и ионообменными смолами.
Растворимость лактата кальция (у) описывается следующими уравнениями [28]:
в области температур 12–35 °С: y = 1,9 exp(0,035T),
в диапазоне 40–80 °С: y = 1,4exp(0,0435T).
При кристаллизации лактата кальция начальная концентрация его в растворе составляет 14,5–15,5 %; при большей концентрации затрудняется отделение кристаллов из-за их малых размеров. Оптимальная начальная температура раствора составляет 30 °С. После заполнения кристаллизатора вносят затравку (6–7 масс. % от массы лактата) в виде сырых кристаллов от предыдущей кристаллизации. Конечная температура раствора не должна превышать 10 °С; общая продолжительность кристаллизации — 10–12 ч.
В процессе кристаллизации температуру снижают за первый час с 30 до 23 °С, за последующие 1,5 ч — с 23 до 16 °С (начинается массовая кристаллизация). Далее температуру снижают со скоростью 2 град./ч, и затем смесь выдерживают 3 ч при 10 °С. После отделения кристаллов фильтрованием или центрифугированием и их промывки выход лактата составляет 80 масс. % от массы кристаллов, содержащихся в утфеле, при доброкачественности 96 %.
Из маточного раствора после разложения лактата, отделения гипса и осветления раствора активным углем получают молочную кислоту второго сорта.
Зная содержание лактата в начальном (Сн) и конечном (См) растворах (масс. %), можно вычислить его выход в процентах к массе раствора (K, безводное вещество) или в процентах к содержанию лактата в начальном растворе (А):
Очищенный раствор лакатата кальция разлагается серной кислотой:
Сульфат кальция выделяется из раствора в виде осадка (гипса). Для получения крупнокристаллического осадка гипса необходимы следующие условия: коэффициент пересыщения 1,3–1,4; массовая доля лактата кальция не выше 18 масс. %; температура 80 °С; избыток серной кислоты 0,5 %; продолжительность созревания кристаллов гипса 1 ч.
Полноту разложения лактата кальция контролируют с помощью цветной реакции с 0,1% раствором метилового фиолетового, который должен иметь васильковый цвет, при избытке серной кислоты — зеленый, лактата кальция — фиолетовый.
Соединения железа осаждают желтой или красной кровяной солью, причем применение последней предпочтительней, поскольку образующийся лактат кальция разлагается далее с образованием нерастворимого сульфата кальция:
Соединения тяжелых металлов и мышьяка осаждают сульфидом бария. Для осветления раствора его обрабатывают активным углем, осадок отделяют фильтрованием.
Осветление и упаривание раствора молочной кислоты проводят с помощью активного угля (ОУ-А) либо до отделения гипса, либо после отделения шлама. Осветленный раствор подвергают концентрированию до массовой доли молочной кислоты 40 масс. % на выпарных вакуумных аппаратах (80 кПа). После выпаривания раствор снова обрабатывают активным углем (исправление) и после фильтрования разливают в тару.
Свойства молочной кислоты [173]
Пищевая молочная кислота выпускается в виде водного раствора концентрацией 40 %, качество которой регламентируется ГОСТ 490–79 (табл. 15.7.143).
Таблица 15.7.143
Химические показатели пищевой молочной кислоты [173]
| Показатели | Сорт | ||
|---|---|---|---|
| высший | первый | второй | |
| Массовая доля общей молочной кислоты, масс. % | 40±1 | ||
| Массовая доля прямо титруемой молочной кислоты, масс. %, не менее | 37,5 | 35,0 | |
| Массовая доля, масс. %, не более | |||
| ангидридов | 2,5 | 5,0 | |
| золы | 0,6 | 1,0 | 4,0 |
| железа | 0,007 | 0,014 | 0,020 |
| сульфатов | 0,3 | Не нормируется | |
| хлоридов | 0,1 | ||
| редуцирующих веществ | 0,1 | ||
| Цветность, град, не более | 6,5 | 10 | 30 |
| Массовая доля мышьяка, мг/кг, не более | 0,3 | ||
| Соли тяжелых металлов | Должна выдерживать испытание | ||
| Ферроцианиды | |||
| Цианистоводородная кислота | |||
| Свободная серная кислота | |||
| Барий | Не допускается | ||
Молочную кислоту получают также и 70% концентрации, для чего проводят вторичное упаривание в вакуум-аппаратах с последующим фильтрованием на фильтр-прессах. Продукт выпускается в жидком виде или в виде пасты, которую получают добавлением к концентрированной кислоте небольшого количества мела.
D-Молочная кислота имеет Тплав 53 °С, Ткип 103 °С (2 мм рт. ст.); D,L-молочная кислота — 18 и 85 °С (1 мм рт. ст.) соответственно [155] (см. разд. 15.7.10).
Динамическая вязкость растворов молочной кислоты при температуре 25 °С приведена в табл. 15.7.144.
Таблица 15.7.144
Динамическая вязкость водных растворов молочной кислоты [28]
| Концентрация, масс. % | Вязкость, мПа × с | Концентрация, масс. % | Вязкость, мПа × с |
|---|---|---|---|
| 6,29 | 1,04 | 54,94 | 4,68 |
| 9,16 | 1,15 | 64,89 | 6,96 |
| 12,19 | 1,21 | 75,33 | 13,03 |
| 24,35 | 1,67 | 85,32 | 28,50 |
| 37,50 | 2,45 | 88,60 | 36,90 |
| 45,48 | 3,09 |
Применение молочной кислоты [28, 155]
Молочную кислоту применяют в пищевой промышленности [102], в медицине и ветеринарии [173] и для разнообразных технических целей.
Молочная кислота сдерживает развитие гнилостных бактерий, но не действует на микроскопические грибы и дрожжи. Молочная кислота и ее соли в присутствии воды являются сильными пластификаторами почти всех белков. В хлебопечении молочная кислота и лактаты увеличивают объем мякиша и улучшают корочку хлеба.
Молочную кислоту добавляют в затор в пивоварении для снижения жесткости воды и достижения величины рН, близкой к оптимальной для действия амилолитических и протеолитических ферментов. Молочную кислоту применяют при производстве пекарных дрожжей для очистки засевных дрожжей от посторонней микрофлоры, в том числе от лактобацилл, а также для очистки мелассы, стимулируя размножение дрожжей.
Для использования в пищевых продуктах разрешены лактаты натрия (Е325), калия (Е326), кальция (Е327), аммония (Е328) и магния (Е329). Используются они в производстве безалкогольных напитков, карамельных масс, кисломолочных продуктов.
Лактат натрия повышает объем и стабильность пены в белково-сбивных массах кондитерских изделий, мороженого.
Эфиры молочной кислоты — лактилаты [102] (Е481, Е482) — относятся к группе анионоактивных ПАВ.
В эту подгруппу пищевых ПАВ входят производные молочной кислоты с высшими жирными кислотами (стеариновой или олеиновой) в виде натриевых или кальциевых солей. Структуру вещества можно описать следующей формулой:
где R — ацил стеариновой или олеиновой кислоты; Me — Na или Ca; n — степень полимеризации молочной кислоты (от 1 до 4).
Критерии чистоты лактилатов представлены в табл. 15.7.145.
Таблица 15.7.145
Характеристика лактилатов [102]
| Критерий | Е 481 | Е 482 |
|---|---|---|
| Содержание, масс. %: | ||
| натрия | 2–5 | — |
| кальция | — | 1–5 |
| Эфирное число, мг KОН/г: | ||
| не менее | 90 | 125 |
| не более | 190 | 190 |
| Общее содержание молочной кислоты (свободной и связанной), масс. %: | ||
| не менее | 15 | 15 |
| не более | 40 | 40 |
| Кислотное число, мг KОН/г: | ||
| не менее | 60 | 50 |
| не более | 130 | 130 |
| ГЛБ | 10–12 | 5–6 |
Лактат кальция [173] — важный терапевтический препарат при лечении кальциевой недостаточности (рахит) в медицине и ветеринарии.
Применяется он как кровеостанавливающее средство при легочных, желудочно-кишечных, носовых и других кровотечениях, в хирургической практике — для повышения свертываемости крови, для снятия зуда при аллергических заболеваниях.
Лактат магния обладает послабляющим действием, лактат закисного железа применяют при остром и хроническом малокровии.
В ветеринарии молочную кислоту используют для подавления развития вредных кишечных микробов у поросят, только что отнятых от материнского молока; при воспалении желудка, кишечника; при гинекологических заболеваниях; при язвенных поражениях кожи.
Добавление 1% раствора лактата кальция в корм кур повышает яйценоскость на 15 % вследствие уменьшения в кишечнике птиц количества микробов, разрушающих белок.
Молочная кислота находит применение в кожевенной промышленности для декальцинации голья и пушнины; в текстильной промышленности молочная кислота и ее сурьмяная соль применяются в протравном крашении и отделке тканей (аппретуре). Лактаты используют в качестве антикоррозионных агентов в растворах антифризов.
Этил- и бутиллактаты (табл. 15.7.146) [155] применяют в качестве растворителей эфиров целлюлозы, олиф, растительных масел; бутиллактат используется также как растворитель некоторых синтетических полимеров. Важное значение молочная кислота приобретает и как мономер при получении биоразлагаемых полимеров.
Таблица 15.7.146
Свойства некоторых лактатов [155]
| Показатель | Метиллактат | Этиллактат | Бутиллактат |
|---|---|---|---|
| Тплав, °С | –66 | — | –28 |
| Ткип, °С | 144,8 | 154 | 187 |
.files/image008.gif) | 1,0939 | 1,0348 | 0,9837 |
.files/image017.gif) | 1,4139 | 1,4132 | 1,4217 |
| h , МПа × с | 2,92 (25 °С) | 2,681 (20 °С) | — |
| g , мН/м | — | 29,2 | 28,8 |
Получение полилактидов [180–182]
Полилактиды являются алифатическими полиэфирами, синтезируемыми из молочной (2-гидроксипропионовой) кислоты.
Полилактид является поликристаллическим полимером с температурой стеклования (Тс), равной 55±5 °С, и температурой размягчения (Тр) 170±10 °С. Типичные значения предела прочности и относительного удлинения равны 50 МПа и 2 % соответственно.
Полилактиды используются главным образом в медицине, где не требуются высокие прочность и жесткость. Промышленный полилактид называется EcoPla.
Низкомолекулярные полилактиды можно рассматривать как продукты поликонденсации молочной кислоты. Более высокая степень полимеризации достигается при использовании в качестве мономера циклического димера (лактида, 121, — 3,6-диметил-1,4-диоксан-2,5-диона), изображенного на рис. 15.7.56. Поэтому для получения полимеров (122) в основном используется лактид.
Рис. 15.7.56. Строение L-лактида (121) и поли-L-лактида (122)
Получение лактида. Циклический димер имеет два стереоцентра и, следовательно, три стереоизомера (два энантиомера и мезоформу). Энантиомеры называют L-лактид (получают из L-молочной кислоты) и D-лактид (из D-молочной кислоты). мезо-Лактид содержит один атом в L-форме, а другой в D-форме.
Производство лактида заключается в дистилляции молочной кислоты. Сначала отгоняется вода, а затем лактид. Процесс протекает в две стадии. На первой стадии образуется олигомерный линейный лактид при дегидратации молочной кислоты (СП 10–30). На второй стадии олигомер деполимеризуется и при пониженном давлении дает лактид. Лактид отгоняется при 200–240 °С и давлении 5 мм рт. ст.
Из 200 г молочной кислоты получается 125 г лактида, Тплав 128 °С.
Выход можно повысить добавлением катализатора: порошок цинка, оксид цинка, титанаты, порошок олова.
Оптически чистые L- или D-лактид (Тплав 96–98 °С) можно получить из чистых энантиомеров.
Поликонденсация молочной кислоты является наиболее простым способом получения полилактида. При удалении воды из раствора молочной кислоты образуется полимер с увеличивающейся СП. Таким образом можно получить полимер с молекулярной массой в несколько тысяч.
При использовании твердых кислотных катализаторов, подобных силикату алюминия или иониту, можно получить полимер с М 30 000 Да.
Используя дегидратирующие агенты, можно получить полимер с М до 36 000 Да. В качестве таких агентов предлагаются: бис-(трихлорметил)-карбонат <(Cl3CO)2CO>; N,N‘-карбонилдиимидазол <(C3H3N2)2CO> и дициклогексилкарбодиимид
Из лактида могут быть получены полимеры с различной молекулярной массой. Наибольшая молекулярная масса полимера получается при блочной полимеризации, проводимой при низкой температуре с использованием очень чистого лактида и небольшой концентрации катализатора [бис(2-этилгексаноат) олова(II)]. Контролировать молекулярную массу можно добавлением инициатора, в качестве которого используются вода, спирты или амины.
В качестве катализатора предлагается также использовать бис(2,2-диметил-3,5-гептандионато-О,О‘)цинка [(Zn(DMH)2], бис(2,4-пентандионато-О,О‘)олова [(Sn(Acac)2].
Физические свойства полилактидов сильно зависят от стереохимического состава или тактичности.
Температура размягчения Тр изотактического L-полилактида и D-полилактида сильно зависит от молекулярной массы и степени кристалличности и может колебаться в диапазоне от 131 до 207 °С. Наиболее часто Тр находится в области 180 °С. Атактические полилактиды являются аморфными веществами. Для полимера, содержащего 85 мол. % L-лактида и 15 мол. % D-лактида, Тр составляет 125 °С.
Подобно температуре размягчения температура стеклования Тс увеличивается с повышением степени кристалличности и молекулярной массы. В большинстве случаев Тс как для изотактического, так и для атактического полимера лежит в области 60 °С.
Источник

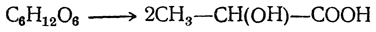
.files/image014.gif)
.files/image015.gif)
.files/image018.gif)



