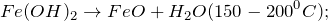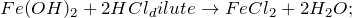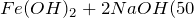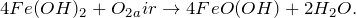Fe -> FeSO4 уравнение реакции
Здесь есть кто-нибудь, кто хорошо разбирается в химии? Мне нужна помощь: каким образом из железа можно получить сульфат железа (II) (Fe -> FeSO4). Дайте краткую характеристику основных физических и химических свойств сульфата железа (II), приведите способы получения этого вещества.
Сульфат железа (II) представляет собой кристаллы белого (иногда с зеленоватым оттенком), термически неустойчивые. Легко окисляется на воздухе, особенно быстро — во влажном состоянии. Не растворяется в воде. Не реагирует с гидратом аммиака. Проявляет амфотерные свойства (основные свойства преобладают), реагируют с разбавленными кислотами, концентрированными щелочами. Переводится в раствор хлоридом аммония. Типичный восстановитель.
Основной способ получения гидроксида железа (II) – обменные реакции между растворимыми солями железа (II) и разбавленными растворами щелочей. Кроме этого сульфат железа (II) можно получить из металлического железа (Fe -> FeSO4) путем растворения последнего в разбавленной серной кислоте в атмосфере диоксида углерода (1) или же по реакции замещения между железом и сульфатом меди (II) (2). Молекулярные уравнения реакций имеют вид:
Источник