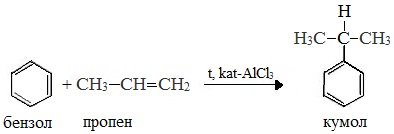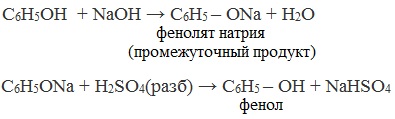- Получить фенол кумольным способом
- Получение фенола в промышленности
- фенол, физические, химические свойства и применение фенола
- Получение, производство фенола
- Кумольный метод получение фенола
- Окисление толуола, с промежуточным образованием бензойной кислоты
- Физические свойства
- Химические свойства
- По гидроксильной группе:
- Взаимодействие с металлическим натрием:
- Образование простых эфиров.
- Во втором случае получают чисто-ароматические простые эфиры:
- По ароматическому кольцу:
- Взаимодействие с концентрированной азотной кислотой:
- Реакция присоединения
- Биологическая роль и значение
- Применение
- Токсические свойства
- Предельно допустимые концентрации (ПДК) фенола:
- Фенольная катастрофа в Уфе
- Получение фенола из гидропероксида кумола
- 1,2-Перегруппировка
- Готовые работы на аналогичную тему
- Механизм получения фенола из гидропероксида кумола
- Синтез фенолов с помощью борорганические соединений из реактивов Гриньяра
Получить фенол кумольным способом
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь).
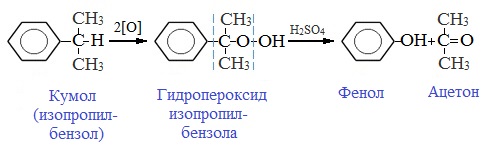
Промышленный способ получения самого фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4. Реакция проходит с высоким выходом и позволяет получить сразу два технически ценных продукта – фенол и ацетон.
Получение фенола в промышленности
1. Кумольный способ
(СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
В качестве исходного сырья используют бензол и пропилен, из которых получают изопропилбензол (кумол), подвергающийся дальнейшим превращениям:
1 стадия – получение кумола
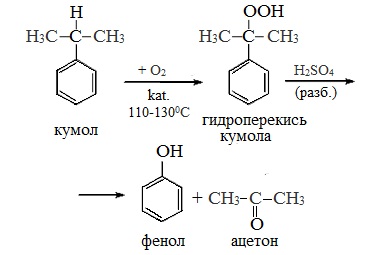
2 стадия – каталитическое окисление
2. Из каменноугольной смолы (как побочный продукт – выход небольшой)
Каменноугольную смолу, содержащую в качестве одного из компонентов фенол, обрабатывают вначале раствором щелочи (образуются феноляты), а затем – кислотой:
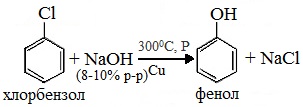
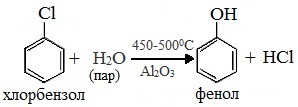
3. Взаимодействие галогенпроизводных ароматических УВ со щелочами
или с водяным паром
4. Сплавлением солей аренсульфокислот с твёрдыми щелочами
Источник
фенол, физические, химические свойства и применение фенола
Фенол (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов. Мировое производство фенола на 2006 год составляет 8,3 млн тонн/год. По объёму производства фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ.
Получение, производство фенола
В настоящее время производство фенола в промышленном масштабе осуществляется следующими способами способами:
Кумольный метод получение фенола
Кумольный метод. Этим способом получают более 95 % всего производимого в мире фенола. В каскаде барботажных колонн кумол подвергают некаталитическому окислению воздухом с образованием гидропероксида кумола (ГПК). Полученный ГПК, при катализе серной кислотой, разлагают с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол.
Окисление толуола, с промежуточным образованием бензойной кислоты
Около 3 % всего фенола получают окислением толуола, с промежуточным образованием бензойной кислоты.
Весь остальной фенол выделяют из каменноугольной смолы.
Ведутся пилотные испытания установок получения фенола прямым окислением бензола закисью азота и кислотным разложением гидропероксида втор-бутилбензола.
Фенол также можно получить восстановлением хинона.
Физические свойства
Представляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ (это связано с промежуточным образованием хинонов). Обладает специфическим запахом (таким, как запах гуаши, так как в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Химические свойства
Из-за наличия ароматического кольца и гидроксильной группы фенол проявляет химические свойства, характерные как для спиртов, так и для ароматических углеводородов.
По гидроксильной группе:
Обладает слабыми кислотными свойствами (более сильными, чем у спиртов), при действии щелочей образует соли — феноляты (например, фенолят натрия — C6H5ONa):
Фенол — очень слабая кислота; даже угольная кислота вытесняет его из фенолятов:
Более интенсивно феноляты разлагаются под действием сильных кислот, например, серной:
Взаимодействие с металлическим натрием:
Фенол непосредственно не этерифицируется карбоновыми кислотами, эфиры можно получить при взаимодействии фенолятов с ангидридами или галогенангидридами кислот:
Образование простых эфиров.
Для получения простых эфиров фенола действуют галогеналканами или галогенпроизводными аренов на феноляты. В первом случае получают смешанные жирно-ароматические простые эфиры:
Во втором случае получают чисто-ароматические простые эфиры:
Реакция проводится в присутствии порошкообразной меди, которая служит катализатором.
При перегонке фенола с цинковой пылью происходит замещение гидроксильной группы водородом:
По ароматическому кольцу:
Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
Взаимодействие с бромной водой (качественная реакция на фенол):
образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
Взаимодействие с концентрированной азотной кислотой:
Взаимодействие с хлоридом железа(III) (качественная реакция на фенол):
Реакция присоединения
Гидрированием фенола в присутствии металлических катализаторов получают циклогексанол и циклогексанон:
Вследствие наличия гидроксильной группы в молекуле фенола устойчивость к окислению намного ниже, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
Так, под действием пероксида водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Биологическая роль и значение
Протеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы. В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает фермент тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Применение
Ммировое потребление фенола имеет следующую структуру (данные 2006 г.):
44 % фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбонатов и эпоксидных смол;
30 % фенола расходуется на производство фенолформальдегидных смол;
12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона;
в России большое количество фенола используется в нефтепереработке, в частности для селективной очистки масел на технологических установках типа 37/1 и А-37/1. Фенол проявляет высокую селективность и эффективность при удалении из масел смолистых веществ, различных полициклических ароматических углеводородов с короткими боковыми цепями, а также соединений, содержащих серу;
остальной фенол расходуется на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт) как обезболивающее и антисептическое средство.
Фенол и его производные обусловливают консервирующие свойства коптильного дыма. Также фенол используют в качестве консерванта в вакцинах. Пример использования, в качестве антисептика — препарат «Орасепт» и «Фукорцин». В косметологии как химический пилинг (токсично).
в скотоводстве: дезинфекция животных растворами фенола и его производных.
в косметологии для проведения глубокого пилинга.
Токсические свойства
Фенол ядовит. Относится к высокоопасным веществам (Класс опасности II). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют.
Предельно допустимые концентрации (ПДК) фенола:
- ПДКр.з. = 1 мг/м³
- ПДКр.с. = 0,3 мг/м³
- ПДКм.р. = 0,01 мг/м³
- ПДКс.с. = 0,003 мг/м³
- ПДКв. = 0,001 мг/л.
Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Смертельная доза для человека при попадании внутрь 1—10 г, для детей 0,05—0,5 г[9].
Фенольная катастрофа в Уфе
Наглядный пример воздействия фенола на окружающую среду был продемонстрирован весной 1990 года в Уфе. В результате техногенной аварии на предприятии ПО «Уфахимпром» произошла утечка большого количества фенола в речку Шугуровка, впадающую в более крупную реку Уфу, являющуюся источником хозяйственно-питьевого водоснабжения города Уфы. Загрязнение воды в районе Южного водозабора превышало ПДК более чем в 100 раз.
Опасность загрязнения питьевой воды фенолом проявляется в том, что при очистке вод использовался хлор, который, взаимодействуя с фенолом, образовывал хлорпроизводные (смесь хлорфенолов) — более токсичные вещества (некоторые в 100—250 раз превышают токсичность самого фенола). Было оповещено население Уфы об опасности употребления водопроводной воды для питья. Общая численность населения, потреблявшего питьевую воду, загрязненную фенолом из Южного водозабора Уфы, составила 672 876 человек
Источник
Получение фенола из гидропероксида кумола
Вы будете перенаправлены на Автор24
Кислотно-катализируемая реакция разложения гидропероксида кумола является современным промышленным методом получения фенола
Кумол получают алкилированием бензола пропиленом или пропан-пропиленовой фракции продуктов крекинга нефти.
Далее кумол окисляют молекулярным кислородом в присутствии катализатора в соответствующий гидропероксид:
Данный гидропероксид, в свою очередь, под действием разбавленной серной кислоты разлагается на конечные фенол и ацетон в результате таких преобразований. Общая схема превращений была открыта Р. Удрисом, П. Сергеевым и Б. Кружаловым в 1942 году:
Разложение гидропероксида кумола до фенола и ацетона проводят в присутствии 1% водной серной кислоты при 50-90$^\circ$С.
1,2-Перегруппировка
Готовые работы на аналогичную тему
Протонированный гидропероксид, как неустойчивый оксониевий ион, расщепляется до катиона І, который имеет электронно-дефицитный (секстет электронов) атом кислорода. Далее проходит 1,2-перегруппировка (1,2-змещение) фенильной группы с парой электронов к этому кислороду с образованием термодинамическиустойчивого карбонат иона II, который взаимодействует с молекулой воды и дает гидроксисоединение III. Оно представляет собой полуацеталь или полукеталь и в кислой среде разлагается на ацетон и фенол:
Приведенная перегруппировка относится к нуклеофильным или секстетным, и 1,2-смещение фенильной группы происходит в электронно дефицитном атоме кислорода, который имеет секстет из шести электронов. Это напоминает нуклеофильное перемещение к электронно-дефицитному углероду для карбокатионов или к электронно дефицитному азоту.
Кумольный метод получения фенола считается одним из самых экономичных, поскольку наряду с фенолом образуется и ацетон.
Механизм получения фенола из гидропероксида кумола
Эта реакция разложения гидропероксида кумола имеет цепной, радикальный механизм, в котором участвует кумильный радикал.
Инициаторы радикальных превращений отщепляют атомы водорода по бензильному положению кумола с образованием достаточно стабильных третичных кумильных радикалов.
Эти радикалы далее реагируют с кислородом с образованием новых перекисных радикалов, которые отщепляют атомы водорода от исходного кумола с образованием (регенирацией) кумильных радикалов.
На третьей, заключительной стадии всего процесса, происходит перегруппировка карбкатионов. Эта стадия аналогична механизму перегруппировки в реакции Байера-Виллигера. Различие же заключается в том, что миграция фенила происходит к положительно заряженному атому кислорода.
Синтез фенолов с помощью борорганические соединений из реактивов Гриньяра
При взаимодействии триалкилового эфира борной кислоты с реактивом Гриньяра образуется фенилдиалкиловий эфир этой кислоты, который в кислой среде гидролизуется до фенилборной кислоты. При воздействии на последнюю пероксида водорода синтезируется фенол с выходом свыше 70%, например:
Источник