- Получить этен всеми возможными способами
- Характеристики и физические свойства этена
- Получение этена
- Химические свойства этена
- Применение этена
- Примеры решения задач
- Этан: способы получения и свойства
- Гомологический ряд этана
- Строение этана
- Изомерия этана
- Химические свойства этана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование этана
- 2. Дегидрирование этана
- 3. Окисление этана
- 3.1. Полное окисление – горение
- Получение этана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 3. Гидрирование алкенов и алкинов
- 4. Синтез Фишера-Тропша
- 5. Получение этана в промышленности
- Этилен (этен), получение, свойства, химические реакции
- Этилен (этен), получение, свойства, химические реакции.
- Этилен (этен), формула, газ, характеристики:
- Физические свойства этилена (этена):
- Химические свойства этилена (этена):
- Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
- Применение и использование этилена (этена):
Получить этен всеми возможными способами
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Характеристики и физические свойства этена
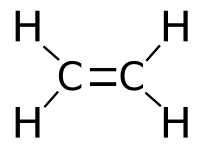
Этен (этилен) – бесцветный горючий газ (строение молекулы показано на рис. 1), обладающий слабым запахом. Мало растворим в воде. Хорошо растворяется в диэтиловом эфире и углеводородах.
Рис. 1. Строение молекулы этилена.
Таблица 1. Физические свойства этена.
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Температура кипения, o С
Получение этена
В промышленных объемах этен получают при переработке нефти: крекингом и дегидрированием этана. Лабораторные способы получения этилена представлены
— неполное гидрирование ацетилена
Химические свойства этена
Этен весьма реакционноспособоное соединение. Все химические превращения этилена протекают с расщеплением:
- p-связи С-С (присоединение, полимеризация и окисление)
- гидрирование
Применение этена
Основное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров.
Примеры решения задач
| Задание | В результате присоединения йода к этилену получено 98,7 г иодопроизводного. Рассчитайте массу и количество вещества этилена, взятого для реакции. |
| Решение | Запишем уравнение реакции присоединения йода к этилену: |
В результате реакции образовалось иодопроизводное – дийодэтан. Рассчитаем его количество вещества (молярная масса равна – 282 г/моль):
Согласно уравнению реакции n(C2H4I2) : n(C2H4) = 1:1, т.е. n(C2H4I2) = n(C2H4) = 0,35 моль. Тогда масса этилена будет равна (молярная масса – 28 г/моль):
| Задание | Рассчитайте объем этилена, приведенный к нормальным условиям, который можно получить из технического этилового спирта C2H5OH массой 300 г. Учтите, что технический спирт содержит примеси, массовая доля которых равна 8%. |
| Решение | Запишем уравнение реакции получения этилена из этилового спирта: |
Найдем массу чистого (без примесей) этилового спирта. Для этого сначала рассчитаем его массовую долю:
Определим количество вещества этилового спирта (молярная масса – 46 г/моль):
Согласноуравнениюреакцииn(C2H5OH) : n(C2H4) = 1:1, т.е. n(C2H5OH) = n(C2H4) = 3,83 моль. Тогда объем этилена будет равен:
Источник
Этан: способы получения и свойства
Этан C2H6 – это предельный углеводород, содержащий два атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Гомологический ряд этана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение этана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :

При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:

При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:

Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:

Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле этана C2H6 атомы водорода располагаются в пространстве в вершинах двух тетраэдров, центрами которых являются атомы углерода |
Изомерия этана
Для этана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства этана
Этан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для этана характерны радикальные реакции.
Этан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Этан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании этана сначала образуется хлорэтан:
Хлорэтан может взаимодействовать с хлором и дальше с образованием дихлорэтана, трихлорэтана, тетрахлорметана и т.д.
1.2. Нитрование этана
Этан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в этане замещается на нитрогруппу NO2.
Например. При нитровании этана образуется преимущественно нитроэтан: 2. Дегидрирование этанаДегидрирование – это реакция отщепления атомов водорода. В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др. При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
3. Окисление этанаЭтан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеЭтан горит с образованием углекислого газа и воды. Реакция горения этана сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении этана в недостатке кислорода может образоваться угарный газ СО или сажа С. Получение этана1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения этана из хлорметана или бромметана. При этом происходит удвоение углеродного скелета.
|