- Сульфат бария: способы получения и химические свойства
- Способ получения
- Химические свойства
- Сульфат бария
- Содержание
- Получение
- Свойства
- Химические свойства
- Токсичность
- Применение
- Аналитическая химия
- Рентгеноконтрастное вещество
- Пигмент-наполнитель
- Другие применения
- Какими способами можно получить сульфат бария
- Сульфид бария: способы получения и химические свойства
- Способ получения
- Химические свойства
Сульфат бария: способы получения и химические свойства
Сульфат бария BaSO4 — соль металла бария и серной кислоты. Белый, тяжелый, при сильном нагревании плавится и разлагается.
Не растворяется в воде. Малореакционноспособный.
Относительная молекулярная масса Mr = 233,39; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 1580º C (разлагается).
Способ получения
1. В результате взаимодействия хлорида бария и сульфата натрия образуется сульфат бария и хлорид натрия:
2. Гидроксид бария вступает в реакцию с разбавленной серной кислотой и образует сульфат бария и воду:
Химические свойства
1. Сульфат бария реагирует с простыми веществами :
1.1. Сульфат бария взаимодействует с углеродом (коксом) при 1100 — 1200º С и образует сульфид бария, угарный газ или углекислый газ:
BaSO4 + 4C = BaS + 4CO
1.2. Хлорид бария вступает в реакцию с водородом при 900 — 1000º С с образованием сульфида бария и воды:
2. Сульфат бария вступает в реакцию со сложными веществами :
2.1. Сульфат бария взаимодействует с оксидами:
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид бария и углекислый газ:
BaSO4 + 4CO = BaS + 4CO2
2.2. Сульфат бария может реагировать с концентрированной серной кислотой. При этом сульфат бария образует гидросульфат бария:
3. Сульфат бария разлагается при температуре выше 1580º С, образуя оксид бария, оксид серы (IV) и кислород:
Источник
Сульфат бария
| Сульфат бария | |
|---|---|
 | |
 | |
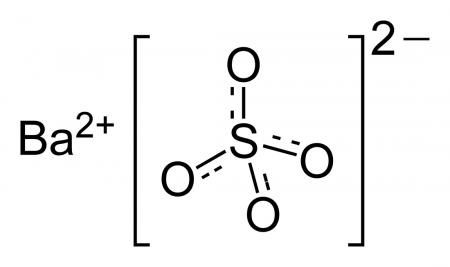
| Систематическое наименование | Сульфат бария |
| Хим. формула | BaSO4 |
| Рац. формула | BaSO4 |
| Состояние | твёрдый |
| Молярная масса | 233.43 г/моль |
| Плотность | 4.5 г/см³ |
| Температура | |
| • плавления | 1580 °C |
| • разложения | 2912 ± 1 °F |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0,0002448 г/100 мл (20 °C) 0,000285 г/100 мл (30 °C) |
| Рег. номер CAS | 7727-43-7 |
| PubChem | 24414 |
| Рег. номер EINECS | 231-784-4 |
| SMILES | |
| RTECS | CR0600000 |
| ChEBI | 133326 |
| ChemSpider | 22823 |
| Токсичность | не токсичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат бария (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
Содержание
- 1 Получение
- 2 Свойства
- 3 Химические свойства
- 4 Токсичность
- 5 Применение
- 5.1 Аналитическая химия
- 5.2 Рентгеноконтрастное вещество
- 5.3 Пигмент-наполнитель
- 5.4 Другие применения
Получение
Сульфат бария получают взаимодействием растворимых солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами:
Последняя реакция используется также для получения пероксида водорода.
В промышленности большие объёмы сульфата бария получают из природного минерала тяжелого шпата, при этом исходное сырьё измельчается и декантируется.
Свойства
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Химические свойства
Сульфат бария нерастворим в щелочах и большинстве кислот, однако растворим в хлорной воде, бромистоводородной и йодистоводородной кислотах, растворах гидрокарбонатов щелочных металлов.
Вступает во взаимодействие с концентрированной серной кислотой, которая переводит нерастворимый сульфат в хорошо растворимый гидросульфат бария:
При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
BaSO4 + 4C → BaS + 4CO
При температурах выше 1600 °C разлагается:
2BaSO4 → 2BaO + 2SO2 + O2 
Токсичность
Сульфат бария в силу низкой растворимости в воде не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и поэтому возможно его применение в качестве рентгеноконтрастного вещества.
Применение
Аналитическая химия
В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество
Часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в соляной кислоте, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («баритовую кашу») с содержанием бария 58,7 %.
Пигмент-наполнитель
Сульфат бария является одной из составляющих смесей, используемых в качестве белых пигментов:
- Смесь сульфата бария с сульфидом цинка, получаемая взаимодействием растворов сульфида бария и сульфата цинка, — литопон.
- Мелкокристаллический сульфат бария, получаемый осаждением сульфатом натрия из раствора сульфида бария, — бланфикс (фр. Blanc fixe ).
Употребляется как клеевая краска, так как нерастворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сероводорода.
Другие применения
Сульфат бария используется для различных промышленных целей:
- В качестве наполнителя для фото- и писчей бумаги, для линолеума и для некоторых лако-красочных материалов.
- Как белый наполнитель для пластмасс.
- В фотометрии: для окраски фотометрических шаров
- В электрохимической промышленности при изготовлении свинцовых аккумуляторов как расширитель активной массы отрицательного электрода.
- При производстве пасты для травления стекла.
- При производстве некоторых огнеупорных материалов.
- Протектор для рентгеновского излучения (бариевая штукатурка рентгеновских кабинетов).
- Добавление в продукцию Lego для обеспечения рентгеноконтрастности на случай, если ребёнок проглотит деталь (это был эксперимент, который закончился неудачно в 1996 году, из-за снижения прочности деталей и токсичности сульфата бария промышленного качества).
- Как основной компонент циммерита — обмазки брони немецких танков и САУ периода Второй мировой войны.
- В виде баритового концентрата при бурении скважин для утяжеления глинистых буровых растворов.
Источник
Какими способами можно получить сульфат бария
Сульфа́т ба́рия (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
——————-
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Плотность: 4,5 г/см³
Молекулярный вес: 233,43 г/моль
Температура плавления: 1580 °C
Коэффициент преломления: 1,63
——————-
Сульфат бария не растворим в щелочах и большинстве кислот, однако растворим в хлорной воде, бромистоводородной и йодистоводородной кислотах, растворах гидрокарбонатов щелочных металлов. Вступает во взаимодействие с концентрированной серной кислотой, которая переводит нерастворимый сульфат в хорошо растворимый гидросульфат бария:
BaSO4 + H2SO4 → Ba(HSO4)2
При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
BaSO4 + 2C → BaS + 2CO2
При температуре свыше 1600 °C разлагается:
2BaSO4 → 2BaO + 2SO2 + O2
——————-
Получение:
1. Взаимодействием солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3
BaO + H2SO4 → BaSO4↓ + H2O
2. В промышленности большие объёмы сульфата бария получают из природного минерала тяжелого шпата, при этом исходное сырьё измельчается и отмучивается.
Источник
Сульфид бария: способы получения и химические свойства
Сульфид бария BaS — соль щелочноземельного металла бария и сероводородной кислоты. Белый, термически устойчивый. Хорошо растворяется в большом количестве воды (сильный гидролиз по аниону). Восстановитель.
Относительная молекулярная масса Mr = 169,34; относительная плотность для тв. и ж. состояния d = 4,36, tпл = 2000º C разлагается.
Способ получения
1. Сульфид бария можно получить путем взаимодействия бария и серы при температуре 150º C:
Ba + S = BaS
2. При взаимодействии с сероводородной кислотой барий при температуре выше 350º C образует сульфид бария и водород:
Ba + H2S = BaS + H2
3. При температуре 1000º C карбонат бария реагирует с сероводородной кислотой . Взаимодействие карбоната бария с сероводородной кислотой приводит к образованию сульфида бария, углекислого газа и воды:
4. Сульфат бария при 1100 — 1200º С реагирует с углеродом и образует сульфид бария и угарный газ или углекислый газ:
BaSO4 + 4C = BaS + 4CO
5. В результате реакции между сульфатом бария и угарным газом при 600 — 800º С происходит образование сульфида бария и углекислого газа:
BaSO4 + 4CO = BaS + 4CO2
6. Сульфат бария вступает в взаимодействие с водородом при 900 — 1000º С с образованием сульфида бария и воды:
Химические свойства
1. Сульфид бария может реагировать с простыми веществами :
1.1. Сульфид бария реагирует с кислородом при температуре 1000 — 1050º C. При этом образуется сульфат бария:
2. Сульфид бария вступает в реакцию со многими сложными веществами :
2.1. Сульфид бария способен реагировать со многими кислотами :
2.1.1. Сульфид бария реагирует с разбавленной хлороводородной кислотой . Взаимодействие сульфида бария с хлороводородной кислотой приводит к образованию хлорида бария и газа сероводорода:
BaS + 2HCl = BaCl2 + H2S↑
2.1.2. При взаимодействии сульфида бария с концентрированной азотной кислотой при кипении выделяются нитрат бария, газ оксид азота, сера и вода:
2.1.3 . Взаимодействуя с насыщенной сероводородной кислотой при комнатной температуре твердый сульфид бария образует гидросульфид бария:
Источник









