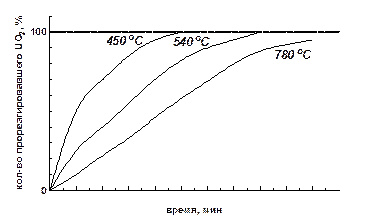Способы получения. Тетрафторид урана (UF4) из всех галогенидов урана имеет в технологии особое значение поскольку он является:
Основные свойства
Тетрафторид урана.
Тетрафторид урана (UF4) из всех галогенидов урана имеет в технологии особое значение поскольку он является:
— исходным соединением для получения UF6;
— исходным соединением для получения металла;
— компонентом ядерного топлива в жидкосолевом реакторе.
Кристаллическая структура UF4 моноклинная. В технологии соединение также известно под названием «зелёная соль».
Плотность r (теор.) = 6,7±0,1 г/см 3 , r (практ.) = 6,43÷6,85 г/см 3 .
Насыпной вес α = 1,5÷3,5 г/см 3 .
Температуры фазовых переходов t (плавл.) = 1036 ± 2 о С, t (крист.) = 960 ± 5 о С, t (кипения) = 1450 о С.
Давление пара UF4 над твёрдой фазой описывается следующим уравнением (р – мм.рт.ст.):
lg(pUF4) = (38,01±0,22) – (20058±243)/T – 7,05 lgT
над жидкой фазой:
lg(pUF4) = (37,09±0,03) – (16840±44)/T – 7,55 lgT
Технологические способы получения тетрафторида урана делят на три большие группы – сухие, полусухие и мокрые, в зависимости от используемых фторирующих реагентов.
I – Сухие способы
1. Взаимодействие оксидов урана с газообразным фтористым водородом. Процесс проводится при температурах выше 550 o C. Примеры реакций представлены ниже:
Фторирование проводят в шнековых аппаратах – горизонтальных цилиндрических печах с вращающимися шнековыми мешалками. Движение твёрдого и газообразного продуктов осуществляется по принципу противотока; шнек выполняет роль транспортёра и мешалки. Материал аппаратуры – никель, диаметр 400 мм, длина – 6 м.
Чем выше температура – тем больше тетрафторида урана гидролизуется и тем, следовательно, необходимо большее парциальное давление паров фтористого водорода для подавления гидролиза. При противоточном фторировании для максимального использования фтористого водорода необходимо проводить процесс при минимальных температурах, но при этом мала скорость реакции. При высоких температурах необходим большой избыток фтористого водорода. Это было бы просто (оставлять часть HF циркулировать в системе) если бы не высокая стоимость осушки HF (значительная часть стоимости HF падает на его обезвоживание).
Из-за совокупности этих причин в шнековых аппаратах необходим градиент температуры; на выходе из аппарата температура максимальна, на входе – минимальна. В свежем HF отсутствует влага и температура здесь может быть весьма значительна (500-600 о С) – обеспечивается высокая скорость процесса. По мере увеличения содержания паров воды температура понижается и на выходе составляет 300-400 о С. На практике температурный градиент не достигается; используют серию аппаратов, работающих при разных температурах.
Технологическая схема процесса сухого фторирования диоксида урана.
1 – фильтр, 2 – конденсатор для 70%-ной плавиковой кислоты, 3 – конденсатор для сухого HF, 4 – смеситель.
Можно использовать и цепь аппаратов «кипящего слоя», в которых просто создать градиент температуры. Возрастает поверхность контакта фаз и, следовательно, увеличивается интенсивность фторирования. Аппараты не имеют движущихся частей.
С целью уменьшения содержания кислорода в получаемом продукте (присутствующем в виде фторида уранила) процесс гидрофторирования можно вести смесью фтористого водорода и газа-восстановителя. В качестве восстановителя можно использовать водород или аммиак, который при повышенной температуре диссоциирует с образованием N2 и Н2. Однако, следует иметь в виду, что увеличение продолжительности процесса в этом случае приводит наряду с уменьшением количества образующегося UO2F2 к повышению содержания UO2 в конечном продукте. В таблице ниже отражено влияние продолжительности гидрофторирования на состав конечного продукта. Процесс проводили при 450 о С, состав газа, %: HF – 84, N2 – 11, H2 – 5.
| Продолжительность, час | Состав конечного продукта | ||
| UF4, % | UO2, % | UO2F2, % | |
| 1,5 | 96,5 | 2,4 | 0,29 |
| 3,0 | 95,7 | 2,6 | 0,34 |
| 4,5 | 96,5 | 2,5 | 0,31 |
| 6,0 | 93,4 | 4,5 | 0,30 |
| 7,5 | 94,8 | 3,5 | 0,24 |
| 9,0 | 94,6 | 3,9 | 0,22 |
| 10,5 | 93,7 | 4,8 | 0,24 |
| 12,0 | 91,7 | 6,7 | 0,14 |
| 13,5 | 93,5 | 5,3 | 0,16 |
Если на гидрофторирование поступает диоксид урана, полученный восстановлением триоксида, то полнота и скорость процесса определяются и «историей» восстановления UO3. Зависимость протекания процесса гидрофторирования от температуры восстановления UO3 представлена на рисунке.
Зависимость полноты протекания процесса гидрофторирования диоксида урана от температуры в процессе восстановления UO3 до UO2
Диоксид урана, полученный восстановлением триоксида при низкой температуре более реакционноспособен. Скорость гидрофторирования возрастает если UO2 частично перевести в U3O8.
2. Фторирование с помощью бифторида аммония. Реакция протекает ступенчато (в зависимости от температуры), продукты разложения аммиака выступают в качестве восстановителя для урана:
3. Фторирование фреонами. Можно использовать различные фреоны, например, фреон-11 – фтортрихлорметан CCl3F tкип. = 178 о С или фреон-114 – тетрафтордихлорэтан C2Cl2F4:
Достоинство этого метода фторирования заключается в том в конечных продуктах нет воды, соответственно не создаются условия для гидролиза тетрафторида урана.
4. Восстановление гексафторида урана водородом. Метод важен при получении металлического топлива на основе обогащённого урана. Процесс проводят при температуре около 800 o C.
5. Восстановление гексафторида урана четырёххлористым углеродом. Четырёххлористый углерод, в отличие от водорода, не пожаро- и не взрывоопасен. Однако его использование в промышленных масштабах в настоящее время сокращается из-за отрицательного влияния на озоновый слой. Реакция протекает при температуре выше 150 o C и идёт бурно:

При избытке CCl4 возможен следующий процесс:
При реализации сухих способов получения тетрафторида урана очень важны материалы для аппаратов (автоклавов и печей непрерывного действия). Используются сплавы на основе никеля:
монель-металл (масс.%): Cu — 27÷29, Fe — 1.5÷2.0, Mn — 1÷2;
хастелои – тройные сплавы Ni-Mo-Fe;
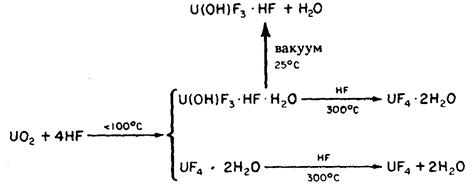
или, например, ИНОР-8: Mo-17, Cr-7, Fe o C – 2UF4·5H2O
T > 400 o C – UF4
Чем выше температура, тем сильнее UF4 подвержен гидролизу, например:
Гидролиз тетрафторида сильно осложняет задачу получения безводного чистого UF4.
Реакции, протекающие при гидрофторировании диоксида урана
Гидрофторирование урана требует соблюдения определённых условий. Рост кристаллов UF4 – важнейший этап его получения. Растворимость UF4 в воде: при 25 о С – 23,8 мг/л; при 60 о С – 95,2 мг/л ≈ 0,1г/л. Тогда как при 25 о С в растворах соляной кислоты: в 1 М HCl – 1,4 г/л; в 6 М HCl – 9,2 г/л. На поверхности частиц диоксида образуется слой тетрафторида и реакция замедляется. Необходимо создать условия для переноса ионов урана.
В производственном процессе используют пульпу UO2 (с d ≈ 2,5 г/см 3 ), соотношение Т:Ж = 1:3,5. Фторирование ведётся смесью HF + HCl (≈ 1:1) – HF — 50÷60 г/л; HCl — 60 г/л. Туда же прибавляют отходы металлического урана. Получающийся, так называемый, «комплексный раствор» содержит [UCl4F2] 2- и [UCl4F] — . Состав раствора изменяется от [UCl4F2] 2- и [UCl4F] — по мере вывода F — в осадок UF4.
Рост более крупных кристаллов тетрафторида урана происходит за счёт растворения мелких. Но для этого должна быть обеспечена «связь», обеспечивающая массоперенос. Комплексные хлоридно-фторидные ионы и служат этим «мостиком».
III – Мокрые способы
В основе этой группы способов лежат химические реакции, протекающие в жидкой фазе и приводящие к осаждению UF4.
1. Непосредственное осаждение из водных растворов. К раствору, содержащему ионы урана(IV), прибавляют раствор плавиковой кислоты.
Присутствующие в растворе анионы также принимают участие в реакциях, при этом образуются промежуточные комплексы:
Вывод из этой последовательности реакций: условия формирования зародышей и роста кристаллов нужно соблюдать лишь после введения в раствор половины необходимого количества F — .
Подобным образом можно получать и двойные соли: NH4UF5·nH2O или КUF5·nH2O:
Восстановление урана до U(IV) производят с помощью ионов Sn 2+ , S2O4 2- или электрического тока.
Если уран находится в кислом растворе, то в качестве химического восстановления можно использовать гидросульфит (дитионит) натрия:
Используют 60 г/л HСl для полного восстановления и предотвращения гидролиза.
В сернокислых растворах уран восстанавливают железной стружкой:
UO2 2+ + 4 Н + + Fe = U 4+ + Fe 2+ + 2 H2O
При электрохимическом восстановлении используют электролиз урансодержащих водных растворов в свинцовом электролизёре. Катодом является корпус аппарата, анодом – свинцовая пластина.
Катод: UO2 2+ + 2 e = U 4+ + 2 O 2-
Для предотвращения выпадения U(SO4)2 в раствор вводят комплексообразователи — ионы аммония.
2. Фотохимический синтез. Реакция протекает в кислых растворах. Восстановителем является этанол, который окисляется до уксусного альдегида (этаналя):
Обезвоживание UF4 является сложной задачей и в этом заключается существенный недостаток полусухого и мокрого способов. Как было сказано ранее:
При доступе воздуха возможно образование уранил фторида:
Но гораздо хуже, если окисление приведёт к образованию летучего гексафторида урана:
Поэтому сушку UF4 проводят в атмосфере водорода:
Обычно продукт высушивают при Т
700 о С в течение 15-20 мин. Остаточная влажность терафторида составляет менее 0.1 %, содержание UO2 не более 1.5 %. Насыпной вес кристаллов UF4 α = 2,5÷3,5 г/см 3 .
В зависимости от назначения тетрафторида устанавливаются кондиционные требования на многие загрязнения:
Черновой уран, полученный при восстановлении тетрафторида, концентрирует в себе все примеси, содержащиеся в UF4, поэтому исходный тетрафторид урана должен быть достаточно чистым.
Если тетрафторид используется для производства гексафторида, то UF6 можно легко очистить от нелетучих фторидов Fe, Ni, Ca, Mg и др. Летучие же фториды (Mo, V, Si, Cr и т.д.) отделять трудно и их содержание должно быть мало. Лимитируется и содержание UO2 и UO2F2, т.к. их фторирование до гексафторида сопряжено с большим расходом фтора.
Для сравнения сопоставим температуры фазовых переходов летучих фторидов:
| Фторид | Т-ра плавления, о С | Т-ра Р = 760 мм рт.ст., о С |
| MoF6 | 17,4 | 35,0 |
| WF6 | 2,3 | 17,0 |
| UF6 | 64,8 | 56,4 |
| NpF6 | 54,4 | 55,2 |
| PuF6 | 50,8 | 62,2 |
Гексафторид урана. Свойства. Способы получения. Применение гексафторида для разделения изотопов урана
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Способ получения тетрафторида урана
Владельцы патента RU 2601477:
Изобретение относится к атомной промышленности и химической технологии неорганических веществ и может быть использовано для получения тетрафторида урана сухим методом в производстве гексафторида урана или металлического урана. Способ получения тетрафторида урана заключается в том, что смешивают диоксид урана с бифторидом аммония и карбамидом, проводят термообработку полученной смеси при температуре выше точки кипения карбамида, но ниже температуры точки кипения бифторида аммония с последующей выдержкой при этой температуре до образования двойной соли, и затем осуществляют термообработку при температуре 500-600°C с выдержкой при этой температуре в вакууме или в инертной атмосфере до получения тетрафторида урана. Изобретение обеспечивает получение кондиционного тетрафторида урана с выходом не менее 98%, а также упрощение процесса его получения. 4 з.п. ф-лы, 2 табл.
Изобретение относится к атомной промышленности и химической технологии неорганических веществ и может быть использовано для получения тетрафторида урана сухим методом в производстве гексафторида урана или металлического урана.
Способы получения тетрафторида урана можно подразделить на водные и сухие. Водный метод получения UF4 заключается в растворении оксида урана в плавиковой кислоте и последующем осаждении UF4, его фильтрации, промывании и обезвоживании получаемого продукта (Ю.В. Гагаринский, Л.А. Хрипин. «Тетрафторид урана». Атомиздат, 1966 г., стр. 8-14). Сухой метод получения UF4 заключается во фторировании оксида урана газообразным фтористым водородом или другими фторирующими агентами при высоких температурах (Ю.В. Гагаринский, Л.А. Хрипин. «Тетрафторид урана». Атомиздат, 1966 г., стр. 15-16). Сухой метод получения UF4 имеет существенные преимущества перед водным:
1) исключаются операции растворения оксида урана, осаждения ТФУ, его фильтрация и дегидратация;
2) отпадает необходимость в переработке больших количеств маточных растворов и промывных вод;
3) возможность эффективной автоматизации процесса.
Известен способ получения тетрафторида урана противоточным взаимодействием диоксида урана с газообразным фтористым водородом при 150÷415°C (патент RU №2484020, МПК C01G 43/06, опубл. 10.06.2013). Способ включает противоточное движение оксида урана и газообразного фтористого водорода (HF) через низкотемпературную (150÷350°C) и высокотемпературную (350÷415°C) области. Недостаток этого способа — использование дорогостоящего, дефицитного газообразного фтористого водорода и нестандартного шнекового реактора. Кроме того, в тетрафториде, полученном таким способом, могут присутствовать 0,9÷2,3% диоксида урана и 1,1÷3,9% уранилфторида (UO2F2).
Известен способ получения тетрафторида урана (патент RU №2456243, МПК C01G 43/06, опубл. 20.07.2012), заключающийся в том, что в качестве урансодержащего соединения используют октаоксид триурана, который обрабатывают парами разложения фторида аммония при 260÷700°C, взятого в избытке 100÷130 мол. % от стехиометрического количества по реакции:
Основной недостаток — сложность аппаратурного оформления. Реактор для фторирования парами фторидами аммония должен содержать испаритель и фильтр для газообразного фтористого аммония, а также конденсатор для улавливания фторида аммония. Кроме того, при 700°C происходит спекание тетрафторида урана, приводящее к снижению выхода продукта.
Известен способ получения тетрафторида урана (Н.П. Галкин, У.Д. Верятин и др. «Технология урана». Москва, Атомиздат, 1964, стр. 276), по которому смесь, состоящую из диоксида урана и бифторида аммония, постепенно нагревают до температуры, несколько превышающей температуру плавления бифторида аммония (125°C), и выдерживают в течение 8 ч. По окончании фторирования получают в основном двойную соль фторида урана и аммония, которую разлагают нагреванием в вакууме при 400°C.
По другому способу, описанному в этом же источнике, смесь из диоксида урана и бифторида аммония нагревают до 150°C, при этом вначале происходит образование двойной соли урана — пентафторураната (NH4UF5) по реакции:
Полученную двойную соль обрабатывали водой, подкисленной азотной кислотой, промывали водой и спиртом и сушили в вакууме при 110°C. Разложение двойной соли проводили в вакууме при 400°C по реакции:
Наиболее близким по технической сущности к заявляемому изобретению является способ получения тетрафторида урана (патент DE №949735, МПК C01G 43/06, опубл. 27.09.1956), по которому смесь диоксида урана и бифторида аммония нагревали до 150°C. Полученную двойную соль фторида урана и избыток бифторида аммония обрабатывали водой, подкисленной азотной кислотой, затем промывали дистиллированной водой и спиртом и сушили в вакууме при 110°C, а разложение двойной соли проводили в вакууме при 400°C. К основным недостаткам этого способа можно отнести следующее. Большая длительность и многостадийность процесса (синтез двойной соли, промывка соли водой и спиртом, сушка, пиролиз в вакууме), сложность аппаратурного оформления, использование горючего и взрывоопасного реагента (спирта). Длительность только одной операции синтеза двойной соли может достигать 8 ч.
Задачей изобретения является упрощение процесса, сокращение его стадийности и продолжительности за счет обеспечения интенсивного массообмена между фторирующим агентом и твердой фазой (диоксидом урана). Дополнительной задачей является получение тетрафторида урана с выходом не менее 98%.
Эта задача решается тем, что в способе получения тетрафторида урана, включающем смешивание диоксида урана с бифторидом аммония, термообработку полученной смеси на стадии образования двойной соли урана и термообработку двойной соли на стадии ее разложения до тетрафторида урана, согласно изобретению в смесь диоксида урана и бифторида аммония добавляют карбамид, проводят термообработку полученной смеси при температуре выше точки кипения карбамида, но ниже температуры точки кипения бифторида аммония с последующей выдержкой при этой температуре до образования двойной соли, затем проводят ее термообработку при температуре 500÷600°C с последующей выдержкой при этой температуре в вакууме или в инертной атмосфере до получения тетрафторида урана.
Бифторид аммония берут в избытке 60÷80% от стехиометрического количества, необходимого для получения двойной соли урана. Как показали экспериментальные данные, указанный диапазон является оптимальным с точки зрения полноты прохождения реакции фторирования.
Карбамид добавляют в количестве 1,0÷1,5 от веса бифторида аммония, так как интенсификация теплообмена между фторирующим агентом и диоксидом урана при данном количестве карбамида происходит наиболее активно.
Термообработку смеси диоксида урана, бифторида аммония и карбамида на стадии образования двойной соли урана проводят при температуре 175÷230°C.
Термообработку смеси диоксида урана, бифторида аммония и карбамида на стадии образования двойной соли урана проводят на воздухе или в инертной атмосфере.
Таким образом, в отличие от прототипа получение тетрафторида урана проводят в два этапа или стадии. На первом этапе порошок диоксида урана смешивают с порошком бифторида аммония и карбамида (NH2)2CO, нагревают полученную смесь до температуры выше точки кипения карбамида (174°C), но ниже температуры точки кипения бифторида аммония (238°C), проводят выдержку при этой температуре до образования двойной соли фторида урана и фторида аммония. На втором этапе поднимают температуру до 500+600°C и проводят выдержку при этой температуре в вакууме или в инертной атмосфере.
Бифторид аммония берут в избытке 60÷80% от стехиометрического количества, необходимого для получения двойной соли (NH4)2UF6, а карбамида (NH2)2CO берут в количестве 1,0÷1,5 от веса бифторида аммония. При нагревании смеси до 175÷230°C получают двойную соль фторида урана и аммония, затем температуру повышают до 500÷600°C и делают выдержку для разложения образовавшейся двойной соли до тетрафторида урана и удаления оставшегося избытка бифторида аммония и карбамида. Образование двойной соли (NH4F)2 UF4 проходит по реакции:
Кроме гексафторураната (NH4)2UF6 на первой стадии способа получения тетрафторида урана при температуре 175÷238°C возможно образование пентафторураната (NH4UF5) и других двойных солей фторида урана и аммония: 7(NH4F)6(UF4) и NH4F3(UF4). Пентафторуранат и гексафторуранат устойчивы на воздухе при температурах до 350°C и 250°C соответственно, а двойные соли — 7(NH4F)6(UF4) и NH4F3(UF4) устойчивы до 450°C. Соли (NH4)2 UF6, NH4UF5, NH4F3(UF4) разлагаются в вакууме с образованием тетрафторида урана при температурах 180, 290 и 400°C соответственно. Порошок UF4 получают разложением указанных выше двойных солей нагреванием их в инертной атмосфере или вакууме до 500÷600°C. Точка кипения карбамида (NH2)2C составляет 174°C.
При фторировании диоксида урана бифторидом аммония при температуре выше точки кипения карбамида, т.е. более 174°C, происходит интенсификация процесса массообмена за счет интенсивного кипения карбамида и, как следствие, активное перемешивание диоксида урана и бифторида аммония. Вместе с тем, температура точки кипения NH4HF2 составляет 238°C, поэтому фторирование необходимо проводить при температурах не выше температуры точки кипения бифторида аммония (238°C). Таким образом, данные условия являются существенными для проведения синтеза двойной соли фторида урана и аммония, а обусловленный ими температурный диапазон 175÷230°C оптимальным с точки зрения достижения технического результата. Продолжительность первой стадии синтеза двойной соли может колебаться от нескольких десятков минут до нескольких часов и в большей мере зависит от величины удельной поверхности (м 2 /г) порошка диоксида урана, чем от температуры процесса. Продолжительность второй стадии предложенного способа, ответственной за разложение двойной соли до тетрафторида урана, зависит от температуры процесса и среды его протекания (вакуум, инертная среда). Разложение двойной соли до тетрафторида урана проводят в вакууме или инертной среде (например, аргон или азот) при 500÷600°C.
Таким образом, авторами обнаружено, что при фторировании диоксида урана бифторидом аммония с добавкой карбамида вследствие кипения карбамида происходит интенсивное перемешивание реагентов, и при этом наиболее полно используется реакционная поверхность частиц фторируемого продукта — диоксида урана. Вследствие указанного технического результата достигается более высокая производительность и более полное превращение диоксида урана в двойную соль и тетрафторид урана.
Сведения, подтверждающие возможность осуществления изобретения
Порошок диоксида урана смешивали с порошками бифторида аммония и карбамида. Масса ингредиентов и режимы термообработки 1-й — низкотемпературной (175÷230°C) и 2-й — высокотемпературной (500÷600°C) стадий приведены в таблице 1. Рентгенофазовый анализ продуктов, полученных на 1-й стадии термообработки, показал образование двойной соли (NH4)2UF6.
Из данных таблиц 1 и 2 и результатов химического рентгенофазового анализов UF4 видно, что в опытах №1, 2, 5, 6 получили UF4 хорошего качества с выходом более 98%. В опыте №3 наряду с основной фазой UF4 присутствовало около 3,0% (NH4)2UF6, что, по-видимому, обусловлено низкой температурой 2-й стадии (450°). В опыте №4 (при отсутствии карбамида), наряду с основной фазой UF4, было обнаружено 5% не прореагировавшего диоксида урана.
Таким образом, предложенный способ позволяет сократить стадийность и продолжительность процесса, при этом получать кондиционный тетрафторид урана с выходом более 98% по сравнению с другими, известными сухими методами. Кроме того, при проведении фторирования диоксида урана, как и при прохождении большинства других гетерогенных процессов, основная трудность заключается в обеспечении надлежащего массообмена между фторирующим агентом и твердой фазой (диоксидом урана). Это, как правило, достигается следующими приемами: фторирование в противотоке, псевдоожиженном слое и виброслое. Аппаратурное оформление таких процессов зачастую сопряжено с разработкой и созданием дорогостоящего, нестандартного и коррозионно-стойкого оборудования. Предложенный способ позволяет организовать интенсивный процесс массообмена в аппаратах стандартной конструкции (муфелях, трубчатых реакторах и т.п.).
1. Способ получения тетрафторида урана, включающий смешивание диоксида урана с бифторидом аммония, термообработку полученной смеси на стадии образования двойной соли урана и термообработку двойной соли на стадии ее разложения до тетрафторида урана, отличающийся тем, что в смесь диоксида урана и бифторида аммония добавляют карбамид, проводят термообработку полученной смеси при температуре выше точки кипения карбамида, но ниже температуры точки кипения бифторида аммония с последующей выдержкой при этой температуре до образования двойной соли, затем проводят ее термообработку при температуре 500÷600°C с последующей выдержкой при этой температуре в вакууме или в инертной атмосфере до получения тетрафторида урана.
2. Способ по п. 1, отличающийся тем, что бифторид аммония берут в избытке 60÷80% от стехиометрического количества, необходимого для получения двойной соли урана.
3. Способ по п. 1, отличающийся тем, что карбамид добавляют в количестве 1,0÷1,5 от веса бифторида аммония.
4. Способ по п. 1, отличающийся тем, что термообработку смеси диоксида урана, бифторида аммония и карбамида на стадии образования двойной соли урана проводят при температуре 175÷230°C.
5. Способ по п. 1, отличающийся тем, что термообработку смеси диоксида урана, бифторида аммония и карбамида на стадии образования двойной соли урана проводят на воздухе или в инертной атмосфере.
Источник