- Сульфат натрия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Сульфат натрия, характеристика, свойства и получение, химические реакции
- Сульфат натрия, характеристика, свойства и получение, химические реакции.
- Краткая характеристика сульфата натрия:
- Физические свойства сульфата натрия:
- Получение сульфата натрия:
- Сульфат натрия
- Характеристики и физические свойства сульфата натрия
- Получение сульфата натрия
- Химические свойства сульфата натрия
- Применение сульфата натрия
- Примеры решения задач
- Сульфат натрия
- Содержание
- Свойства
- Нахождение в природе
- Получение
- Применение
Сульфат натрия: способы получения и химические свойства
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
Способ получения
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4 + NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Качественная реакция
Качественная реакция на сульфат натрия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат натрия образует сульфат бария и хлорид натрия:
Химические свойства
1. Сульфат натрия может реагировать с простыми веществами :
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
2. Сульфат натрия вступает в реакцию со многими сложными веществами :
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
2.2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
2.3. Сульфат натрия реагирует с оксидом серы (VI) . Взаимодействие сульфата натрия с оксидом серы (VI) приводит к образованию пиросульфата натрия:
2.4. Сульфат натрия взаимодействует с хлоридом бария . При этом образуются хлорид натрия и сульфат бария:
Источник
Сульфат натрия, характеристика, свойства и получение, химические реакции
Сульфат натрия, характеристика, свойства и получение, химические реакции.
Сульфат натрия – неорганическое вещество, имеет химическую формулу Na2SO4.
Краткая характеристика сульфата натрия:
Сульфат натрия – неорганическое вещество белого цвета.
Химическая формула сульфата натрия Na2SO4.
Сульфат натрия – неорганическое химическое соединение, соль серной кислоты и натрия.
Хорошо растворяется в воде . Растворим также в глицерине, метаноле, этаноле. Не растворим в ацетоне.
Безводный Na2SO4 устойчив выше температуры 32,384 °C , ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O.
Сульфат натрия существует в трех модификациях (α, β и γ). α-модификация сульфата натрия имеет ромбическую сингонию. β-модификация сульфата натрия также имеет ромбическую сингонию. γ-модификация имеет гексагональную сингонию. α-модификация переходит в β-модификацию при температуре 185 С о , β-модификация переходит γ-модификацию при 241 С о .
Сульфат натрия не токсичен, пожаро- и взрывобезопасен. Пылевоздушная смесь сульфата натрия не взрывоопасна.
В земной коре сульфат натрия находится в свободном чистом состоянии, в форме кристаллогидратов, а также в составе двойных солей.
Сульфат натрия в чистом состоянии широко распространён в природе в виде минерала тенардит.
Сульфат натрия образует с водой кристаллогидраты. Их формула Na2SO4·nH2O, где n может быть 1, 7 или 10. Кристаллогидрат Na2SO4·10H2O известен как минерал мирабилит (глауберова соль). Данный десятиводный кристаллогидрат сульфата натрия впервые обнаружен химиком И. Р. Глаубером в составе минеральных вод.
Двойные соли сульфат натрия образует с сульфатами ряда металлов , к которым, к примеру, относятся природные минералы астраханит Na2SO4·MgSO4·4H2O и глауберит Na2SO4·CaSO4.
В пищевой промышленности используется 2 типа сульфата натрия:
– добавка Е514(i) – сульфат натрия (Sodium sulphate) с химической формулой Na2SO4;
– добавка Е514(ii) – гидросульфат натрия (Sodium hydrogen sulphate) с химической формулой NaHSO4.
Физические свойства сульфата натрия:
| Наименование параметра: | Значение: |
| Химическая формула | Na2SO4 |
| Синонимы и названия иностранном языке | sodium sulfate (англ.) |
натрий сернокислый (рус.)
тенардит (рус.)
Получение сульфата натрия:
Промышленный способ получения сульфата натрия заключается в разработке его месторождений в природе.
В лаборатории сульфат натрия получается в результате следующих химических реакция:
- 1. взаимодействия сульфата магния и карбоната натрия :
- 2. взаимодействия оксида натрия и оксида серы:
- 3. взаимодействия сульфита натрия и пероксида водорода:
- 4. взаимодействия гидросульфата натрия и гидроксида натрия :
- 5. взаимодействия сульфата лития и карбоната натрия:
- 6. взаимодействия оксида серы и гидроксида натрия:
- 7. и иных реакций.
Источник
Сульфат натрия
Характеристики и физические свойства сульфата натрия
Кристаллизуется из водных растворов с десятью молекулами воды (Na2SO4×10H2O) и в таком виде называется глауберовой солью по имени немецкого врача и химика И.Р. Глаубера, который первым получил её действием серной кислоты на хлорид натрия.
Рис. 1. Сульфат натрия. Внешний вид.
Таблица 1. Физические свойства сульфата натрия.
Плотность (20 o С), г/см 3
Температура плавления, o С
Растворимость в воде (20 o С), г/100 мл
Получение сульфата натрия
Основной промышленный способ получения сульфата натрия мало чем отличается, от того, что использовал И.Р. Глаубер, когда впервые получил эту соль. Реакция обмена между серной кислотой и хлоридом натрия, проводимая при нагревании до 500 o С в специальной печи:
Кроме этого сульфат натрия встречается в природе в виде минерала тенардита (безводный) и мирабилита (гидрат).
Химические свойства сульфата натрия
В водном растворе сульфат натрия диссоциирует на ионы:
Твердый сульфат натрия взаимодействует с концентрированнойсерной кислотой
Вступает в реакции обмена с кислотными оксидами (1), гидроксидами (2) и солями (3):
Сульфат натрия восстанавливается водородом (4) и углеродом (5):
Применение сульфата натрия
Безводный сульфат натрия применяется для изготовления стекла. Раньше эту соль использовали в качестве одного из составляющих стиральных порошков и другим моющих средств. Кроме этого сульфат натрия нашел применение в текстильной промышленности, кожевенном деле, производстве цветных металлов, а также в химическом анализе.
Примеры решения задач
| Задание | Вычислите объем кислорода, выделяющийся при образовании сульфата натрия по реакции взаимодействии пероксида натрия массой 47,5 г с раствором серной кислоты. |
| Решение | Уравнение реакции имеет следующий вид: |
Рассчитаем количество моль пероксида натрия (молярная масса равна 78 г/моль):
Согласно уравнению реакции n (Na2O2) : n (O2) = 2: 1. Значит,
Тогда, объем выделяющегося кислорода будет равен:
V (O2) = 0,305 × 22,4 = 6,832л.
| Задание | Вычислите количество теплоты, выделяющейся при образовании сульфата натрия из пероксида натрия массой 7,5 г и оксида серы (IV). Термохимическое уравнение реакции имеет следующий вид: |
Согласно уравнению реакции, в неё вступили 1 моль пероксида натрия и 1 моль оксида серы (IV). Рассчитаем массу пероксида натрия по уравнению, т.е. теоретическую массу (молярная масса – 78 г/моль):
Тогда, количество теплоты, выделяющейся в ходе реакции взаимодействия между пероксидом натрия и оксидом серы (IV) равно:
Qprac = 654,4 × 7,5/ 78 = 62,92 кДж.
Источник
Сульфат натрия
| Сульфат натрия | |
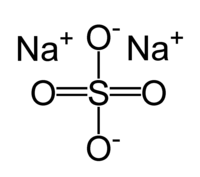 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | сульфат натрия, натрий сернокислый |
| Химическая формула | Na2SO4 |
| Физические свойства | |
| Состояние (ст. усл.) | белые гигроскопичные кристаллы |
| Отн. молек. масса | 142,04 а. е. м. |
| Молярная масса | 142,04 г/моль |
| Плотность | 2,68 г/см³ |
| Термические свойства | |
| Температура плавления | 884 °C |
| Энтальпия образования (ст. усл.) | −1387,9 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 19,2 (20 °C), 42,3 (100 °C) |
| Классификация | |
| Рег. номер CAS | 7757-82-6 |
Содержание
Свойства
Бесцветные кристаллы. Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O.
Нахождение в природе
В природе безводный сульфат натрия встречается в виде минерала тенардита. Кристаллогидрат Na2SO4·10H2O образует минерал мирабилит (глауберову соль). Встречаются также двойные соли сульфата натрия с другими сульфатами, например астраханит Na2SO4·MgSO4·4H2O, глауберит Na2SO4·CaSO4. Значительные количества сульфата натрия содержатся в рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция:
В России крупнейшим производителем природного сульфата натрия является компания ОАО «Кучуксульфат» — 600 тыс. тонн в год.
Получение
Промышленный способ получения сульфата натрия — взаимодействие NaCl с H2SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается соляная кислота.
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья. Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
Применение
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах.
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют для получении сульфатной целлюлозы, в текстильной, кожевенной промышленности и в цветной металлургии.
В медицине и ветеринарии ранее широко использовался в качестве солевого слабительного средства, применяется также как компонент в средствах для промывания носа.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
Зарегистрирован в качестве пищевой добавки E514.
Источник
















