Получение серной кислоты башенным способом
Получение серной кислоты нитрозным (башенным) способом
Схема и основные стадии производства серной кислоты башенным способом
Существует несколько схем производства серной кислоты башенным способом. Ранее башенные системы состояли из 6—7 башен. В последние годы получила распространение предложенная С. Д. Ступниковым так называемая «короткая» башенная система, состоящая из четырех орошаемых башен и одной неорошаемой. Эта схема приведена на рисунке 21. Обжиговые газы, содержащие 8—10% сернистого газа, поступают сначала в первую продукционную башню I, а затем во II. В верхнюю часть этих башен поступает нитроза, которая разбрызгивается на насадку из керамических колец. Сернистый газ растворяется в нитрозе и окисляется до серной кислоты, которая после предварительного охлаждения поступает на склад. Часть ее направляется в башни III и IV. В продукционных башнях из нитрозы выделяется окись азота, которая в неорошаемой башне 3 частично окисляется до двуокиси. Окислы азота затем направляются в башни III и IV, где происходит их поглощение серной кислотой с образованием нитрозы. Нитроза с наиболее высоким содержанием окислов азота направляется (из башни III) в продукционные башни. Во всех орошаемых башнях соблюдается принцип противотока — газ и жидкость движутся навстречу друг другу.
Количество кислоты, подаваемой на орошение башен, примерно в 60 раз превышает количество производимой в сутки кислоты. Циркуляция серной кислоты обеспечивается насосами. Перемещение газов осуществляется центробежным вентилятором, расположенным между последней и предпоследней башнями. Газы в башнях, расположенных перед вентилятором, находятся под некоторым разрежением, а последняя башня — под небольшим напором. Из приведенной схемы следует, что основными стадиями в производстве серной кислоты являются: 1 — окисление сернистого газа до серной кислоты, 2 — окисление окиси азота и 3 — поглощение окислов азота серной кислотой; эти стадии осуществляются в различных аппаратах.
Источник
Серная кислота
Серная кислота , H2SO4, сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях — тяжёлая маслянистая жидкость без цвета и запаха. В технике серную кислоту называют её смеси как с водой, так и с серным ангидридом. Если молярное отношение SO3 : Н2О меньше 1, то это водный раствор серной кислоты, если больше 1, — раствор SO3 в серной кислоте.
Природные залежи самородной серы сравнительно невелики. Общее содержание серы в земной коре составляет 0,1%. Сера содержится в нефти, каменном угле, горючих и топочных газах. Чаще сера встречается в природе в виде соединений с цинком, медью и другими металлами. Следует отметить, что доля колчедана и серы в общем балансе сернокислотного сырья постепенно уменьшается, а доля серы, извлекаемой из различных отходов, постепенно возрастает. Возможности получения серной кислоты из отходов весьма значительны. Использование отходящих газов цветной металлургии позволяет получать, без специальных затрат в сернокислотных системах на обжиг серосодержащего сырья.
Физические и химические свойства серной кислоты
Стопроцентная H2SO4 (SO3 х H2O) называется моногидратом. Соединение не дымит, в концентрированном виде не разрушает черные металлы, являясь при этом одной из самых сильных кислот;
- вещество пагубным образом действует на растительные и животные ткани, отнимая и них воду, вследствие чего они обугливаются.
- кристаллизуется при 10,45 «С;
- tkип 296,2 «С;
- плотность 1,9203 г/см3;
- теплоёмкость 1,62 дж/г.
Серная кислота смешивается с Н2О и SO3 в любых соотношениях, образуя соединения:
- H2SO4 х 4 H2O (tпл — 28,36 «С),
- H2SO4 х 3 H2O (tпл — 36,31 «С),
- H2SO4 х 2 H2O (tпл — 39,60 «С),
- H2SO4 х H2O (tпл — 8,48 «С),
- H2SO4 х SO3 (H2S2O7 — двусерная или пиросерная кислота, tпл 35,15 «С) — олеум,
- H2SO х 2 SO3 (H2S3O10 — трисерная кислота, tпл 1,20 «C).
При нагревании и кипении водных растворов серной кислоты, содержащих до 70% H2SO4, в паровую фазу выделяются только пары воды. Над более концентрированными растворами появляются и пары серной кислоты. Раствор 98,3% H2SO4 (азеотропная смесь) при кипении (336,5 «С) перегоняется полностью. Серная кислота, содержащая свыше 98,3% H2SO4, при нагревании выделяет пары SO3.
Концентрированная серная кислота — сильный окислитель. Она окисляет HI и НВг до свободных галогенов. При нагревании окисляет все металлы, кроме Au и платиновых металлов (за исключением Pd). На холоде концентрированная серная кислота пассивирует многие металлы, в том числе РЬ, Cr, Ni, сталь, чугун. Разбавленная серная кислота реагирует со всеми металлами (кроме РЬ), предшествующими водороду в ряду напряжении, например: Zn + H2SO4 = ZnSO4 + Н2.
Как сильная кислота H2SO4 вытесняет более слабые кислоты из их солей, например борную кислоту из буры:
Na2B4O7 + H2SO4 + 5 H2O = Na2SO4 + 4 H2BO3,
а при нагревании вытесняет более летучие кислоты, например:
NaNO3 + H2SO4 = NaHSO4 + HNO3.
Серная кислота отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы — ОН. Дегидратация этилового спирта в присутствии концентрированной серной кислоты приводит к получению этилена или диэтилового эфира. Обугливание сахара, целлюлозы, крахмала и других углеводов при контакте с серной кислотой объясняется также их обезвоживанием. Как двухосновная, серная кислота образует два типа солей: сульфаты и гидросульфаты.
| Температура замерзания серной кислоты: | |
| концентрация, % | темп.замерз., «С |
| 74,7 | -20 |
| 76,4 | -20 |
| 78,1 | -20 |
| 79,5 | -7,5 |
| 80,1 | -8,5 |
| 81,5 | -0,2 |
| 83,5 | 1,6 |
| 84,3 | 8,5 |
| 85,7 | 4,6 |
| 87,9 | -9 |
| 90,4 | -20 |
| 92,1 | -35 |
| 95,6 | -20 |
Сырьё для получения серной кислоты
Сырьём для получения серной кислоты могут служить: сера, серный колчедан FeS2, отходящие газы печей окислительного обжига сульфидных руд Zn, Сu, РЬ и других металлов, содержащие SO2. В России основное количество серной кислоты получают из серного колчедана. Сжигают FeS2 в печах, где он находится в состоянии кипящего слоя. Это достигается быстрым продуванием воздуха через слой тонко измельченного колчедана. Получаемая газовая смесь содержит SO2, O2, N2, примеси SO3, паров Н2О, As2O3, SiO2 и другие, и несёт много огарковой пыли, от которой газы очищаются в электрофильтрах.
Способы получения серной кислоты
Серную кислоту получают из SO2 двумя способами: нитрозным (башенным) и контактным.
Переработка SO2 в серную кислоту по нитрозному способу осуществляется в продукционных башнях — цилиндрических резервуарах (высотой 15 м и более), заполненных насадкой из керамических колец. Сверху, навстречу газовому потоку разбрызгивается «нитроза» — разбавленная серная кислота, содержащая нитрозилсерную кислоту NOOSO3H, получаемую по реакции:
N2O3 + 2 H2SO4 = 2 NOOSO3H + H2O .
Окисление SO2 окислами азота происходит в растворе после его абсорбции нитрозой. Водою нитроза гидролизуется:
NOOSO3H + H2O = H2SO4 + HNO2.
Сернистый газ, поступивший в башни, с водой образует сернистую кислоту:
SO2 + H2O = H2SO3.
Взаимодействие HNO2 и H2SO3 приводит к получению серной кислоты:
2 HNO2 + H2SO3 = H2SO4 + 2 NO + H2O.
Выделяющаяся NO превращается в окислительной башне в N2O3 (точнее в смесь NO + NO2). Оттуда газы поступают в поглотительные башни, где навстречу им сверху подаётся серная кислота. Образуется нитроза, которую перекачивают в продукционные башни. Таким образом осуществляется непрерывность производства и круговорот окислов азота. Неизбежные потери их с выхлопными газами восполняются добавлением HNO3.
Серная кислота, получаемая нитрозным способом, имеет недостаточно высокую концентрацию и содержит вредные примеси (например, As). Её производство сопровождается выбросом в атмосферу окислов азота («лисий хвост», названный так по цвету NO2).
Принцип контактного способа производства серной кислоты был открыт в 1831 П. Филипсом (Великобритания). Первым катализатором была платина. В конце 19 — начале 20 вв. было открыто ускорение окисления SO2 в SO3 ванадиевым ангидридом V2O5. Особенно большую роль в изучении действия ванадиевых катализаторов и их подборе сыграли исследования советских учёных А. Е. Ададурова, Г. К. Борескова, Ф. Н. Юшкевича.
Современные сернокислотные заводы строят для работы по контактному методу. В качестве основы катализатора применяются окислы ванадия с добавками SiO2, Al2O3, K2O, CaO, BaO в различных соотношениях. Все ванадиевые контактные массы проявляют свою активность только при температуре не ниже
420 «С. В контактном аппарате газ проходит обычно 4 или 5 слоев контактной массы. В производстве серной кислоты контактным способом обжиговый газ предварительно очищают от примесей, отравляющих катализатор. As, Se и остатки пыли удаляют в промывных башнях, орошаемых серной кислотой. От тумана серную кислоту (образующейся из присутствующих в газовой смеси SO3 и H2O) освобождают в мокрых электрофильтрах. Пары H2O поглощаются концентрированной серной кислотой в сушильных башнях. Затем смесь SO2 с воздухом проходит через катализатор (контактную массу) и окисляется до SO3:
SO2 + 1/2 O2 = SO3.
Серный ангидрид далее поглощается водой, содержащейся в разбавленной H2SO4:
SO3 + H2O = H2SO4.
В зависимости от количества воды, поступившей в процесс, получается раствор серной кислоты в воде или олеум.
Посредством данного метода сейчас вырабатывается порядка 80% H2SO4 в мире.
Применение серной кислоты
Серная кислота может служить для очистки нефтепродуктов от сернистых, непредельных органических соединений.
В металлургии серная кислота применяется для удаления окалины с проволоки, а также листов перед лужением и оцинкованием (разбавленная), для травления разичных металлических поверхностей перед покрытием их хромом, медью, никелем и др. Также с помощью серной кислоты разлагают комплексные руды (в частности, урановые).
В органическом синтезе серная кислота концентрированная является необходимым компонентом нитрующих смесей, а также сульфирующим средством при получении многих красителей и лекарственных веществ.
Широко применяется серная кислота для производства удобрений, этилового спирта, искусственного волокна, капролактама, двуокиси титана, анилиновых красителей и целого ряда других химических соединений.
Серная кислота отработанная (отход) применяется в химической, металлургической, деревообрабатывающей и других отраслях промышленности Серная кислота аккумуляторная применяется в производстве свинцово-кислотных источников тока.
Источник
Производство серной кислоты башенным методом. Метод Ступникова
При производстве азотной кислоты, минеральных удобрений в органическом синтезе образуются значительные количества оксидов азота, которые можно использовать для производства серной кислоты нитрозным методом (рис. 5.5).
В данном случае отсутствует контактное отделение и роль катализатора играют оксиды азота.
Особенность этой реакции в том, что требуется строгое соответствие стехиометрических коэффициентов. Азотистый ангидрид (N2O3) является нестойким соединением. При его растворении в 80 % серной кислоте образуется нитрозилсерная кислота (HSNO5):
Это соединение также неустойчиво и легко разлагается, поэтому для его стабилизации берется большой избыток серной кислоты (соотношение N2O3:H2SO4 = 1:50). Раствор нитрозилсерной кислоты в 80 % серной кислоте называется нитрозой. Раствор нитрозы подвергают гидролизу теплой водой — при этом образуется серная кислота.
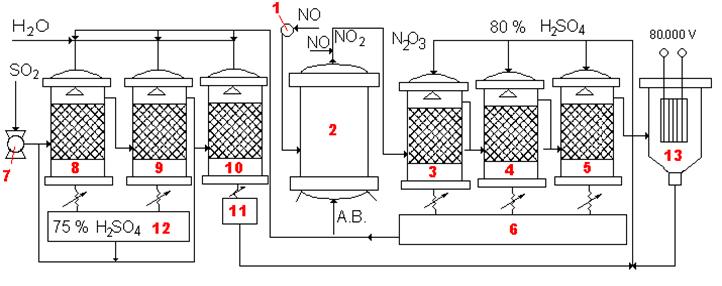
Рис. 5.5. Технологическая схема производства серной кислоты башенным методом
Оксид азота(II) из распределителя 1 поступает в окислительную колонну 2, куда также подается атмосферный воздух. В колонне 2 оксид азота(II) окисляется в оксид азота(IV). Оксид азота(IV) поступает в трубопровод, куда также подводят NO. В трубопроводе образуется оксид азота(III) — N2O3. N2O3 проходит башни 3-5, орошаемые сверху 80 % серной кислотой. Здесь образуется нитрозилсерная кислота, которая растворяется в избытке серной кислоты. Раствор нитрозы охлаждается в водяных холодильниках и сливается в приемник 6.
Нитроза идет на орошение башен 8-10, в которые подается также вода и сернистый газ. В башне 10 образуется 80 % серная кислота, которая идет на орошение башен 3-5 и на получение раствора нитрозы. В башнях 8-9 получают 75 % серную кислоту, её охлаждают и сливают в приемник 12. Эта кислота и является товарным продуктом.
В данном случае обжиговый газ не подвергают химической очистке, поэтому образовавшаяся серная кислота загрязнена и её используют только для производства удобрений.
Данное производство экономично, так как отсутствует дорогостоящий катализатор, но, требует большого количества серной кислоты, циркулирующей в системе. Кислота необходима для стабилизации нитрозы: на 1 объем вновь образующейся кислоты в системе циркулирует 50 объемов серной кислоты.
Получение серной кислоты из отработавшей серной кислоты
В некоторых производствах, потребляющих серную кислоту, например, для очистки нефти от сернистых соединений или при алкилировании органических веществ, из технологического процесса выводят отработанную серную кислоту, сильно загрязненную примесями органических веществ. Такую кислоту трудно очистить от примесей, но её необходимо использовать, так как выброс отработавшей кислоты в канализацию без её нейтрализации и обезвреживания недопустим. Накопление кислоты создает большие трудности на производстве, она занимает большие емкости, является источником загрязнений на производстве и антисанитарных условий труда. Поэтому вопросу использования отработавших кислот уделяется большое внимание.
Одно из направлений использования отработавшей серной кислоты, сильно загрязненной примесями органических веществ — разложение её в печах при 700-800 о С до сернистого ангидрида по уравнению:
Органические соединения окисляются при этом до СO2 и H2O. Из полученного в результате разложения кислоты сернистого газа вновь получают серную кислоту.
Разложение кислоты проводят в печи, которая представляет собой полую цилиндрическую камеру. Корпус печи изготовлен из листовой стали, внутренняя часть выложена огнеупорным кирпичом. В крышке печи имеется форсунка для вбрызгивания отработавшей серной кислоты. Для создания в печи необходимой температуры, в ней сжигают горючий газ, продуваемый вместе с воздухом через горелку, находящуюся в верхней части стенки камеры. Получаемый газ выходит из печи снизу.
Дата добавления: 2018-02-18 ; просмотров: 1373 ; Мы поможем в написании вашей работы!
Источник




