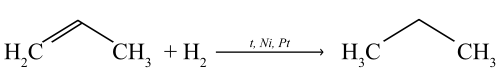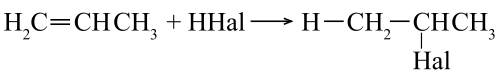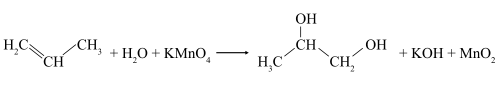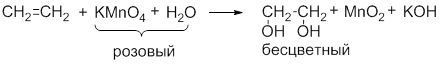- Пропилен
- Содержание
- Физические свойства
- Химические свойства
- Присоединение галогенов (галогенирование)
- Присоединение водорода (реакция гидрирования)
- Присоединение воды (реакция гидратации)
- Присоединение галогеноводородов (HHal)
- Горение на воздухе
- Полимеризация
- Окисление кислородом воздуха в пропиленоксид
- Получение
- В лаборатории
- В промышленности
- Применение
- Производство
- Источники
- Примечания
- Ссылки
- Полезное
- Смотреть что такое «Пропилен» в других словарях:
- Получение пропена лабораторным способом
Пропилен
| Пропилен | |
 | |
 | |
| Общие | |
|---|---|
| Химическая формула | C3H6 |
| Физические свойства | |
| Молярная масса | 42.08 г/моль |
| Плотность | 0.695@-47 °C г/см³ |
| Термические свойства | |
| Температура плавления | − 185.2 °C |
| Температура кипения | − 47.6 °C |
| Классификация | |
| Рег. номер CAS | 115-07-1 |
| SMILES | C=CC |
Пропиле́н (пропен) СН2=СН-СН3 — непредельный (ненасыщенный) углеводород ряда этилена, горючий газ, является изологом пропана. Вещество с наркотическим действием более сильным, чем у этилена. Класс опасности — четвертый. [1] .
Содержание
Физические свойства
Пропилен представляет собой газообразное вещество с низкой температурой кипения tкип= -47,7 °C и температурой плавления tпл= −187,6 °C, оптическая плотность d20 4 =0,5193.
Химические свойства
Обладает значительной реакционной способностью. Его химические свойства определяются двойной углерод-углеродной связью. p-связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Все реакции присоединения протекают по двойной связи и состоят в расщеплении π-связи алкена и образовании на месте разрыва двух новых σ-связей.
Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
Присоединение галогенов (галогенирование)
Реакцию галогенирования обычно проводят в растворителе при обычной температуре. Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных. Легче идет присоединение хлора и брома, труднее — йода. Фтор взаимодействует со взрывом.
Присоединение водорода (реакция гидрирования)
Присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), пропен переходит в предельный углеводород — пропан.
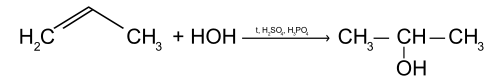
Присоединение воды (реакция гидратации)
Пропилен реагирует с водой с образованием одноатомного спирта изопропанола, при этом двойная связь раскрывается.
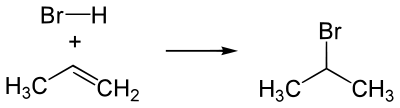
Присоединение галогеноводородов (HHal)
Происходит по правилу Марковникова. Водород кислоты HHal присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Hal связывается с атомом углерода, при котором находится меньшее число атомов водорода.
Пример гидрогалогенирования — получение бромпроизводного пропана при реакции бромоводорода и пропилена.
Горение на воздухе
При поджигании горит на воздухе: 2СН2=СНСН3 + 9О2 → 6СО2 + 6Н2О.
С кислородом воздуха газообразный пропилен образует взрывчатые смеси.
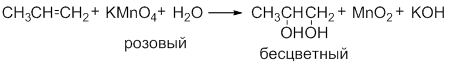
В слабощелочной или нейтральной водной среде пропилен окисляется перманганатом калия, что сопровождается обесцвечиванием раствора KMnO4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах углерода). Эта реакция получила название реакции Вагнера.
Полимеризация
Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путем расщепления внутримолекулярных π-cвязей и образования новых межмолекулярных σ-cвязей.
Окисление кислородом воздуха в пропиленоксид
При нагревании в присутствии серебряных катализаторов:
Получение
В лаборатории
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:
2. Гидрирование пропина в присутствии катализатора (Pd):
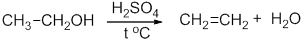
3. Дегидратация изопропилового спирта (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или Аl2O3:
4. Отщепление двух атомов галогена от дигалогеноалканов, содержащих галогены при соседних атомах С. Реакция протекает под действием металлов (Zn и др.):
В промышленности
Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2О3, Аl2О3).
Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия:
Применение
Для производства оксида пропилена, получения изопропилового спирта и ацетона, для синтеза альдегидов, для получения акриловой кислоты и акрилонитрила, полипропилена, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Производство
Большая часть производственных мощностей по пропилену сосредоточена в Европе, Северной Америке и Азии. В настоящее время за год в мире производится более 50 миллионов тонн пропилена полимерного и химического сортов (PG/CG). Большая часть выпуска пропилена этих сортов приходится на долю установок пиролиза, где пропилен — побочный продукт производства этилена. Установками термического крекинга вырабатывается более 60 % такого пропилена. Нефтеперерабатывающими FCC-предприятиями выпускается 34 %. При дегидрогенизации или метатезисе пропана производится 3 % пропилена (в данном случае пропилен является целевым продуктом).
Пропилен нефтехимической чистоты (RG) производится на нефтеперерабатывающих предприятиях мира в количестве, равном 31,2 миллионам тонн. Большая часть такого пропилена вырабатывается на FCC-предприятиях, где пропилен — побочный продукт производства бензина и дистиллятов. Половина этих пропиленовых мощностей интегрирована с нефтехимическими предприятиями, на которых происходит алкилирование пропилена или смешивание LPG и пропана.
Источники
- http://www.ssa.ru
- http://chem.edu.ru
- А. И. Артеменко, Органическая химия, М.:Высшая школа — 1998
- Б. Д. Степин, А. А. Цветков, Органическая химия, М.:Высшая школа — 1994
Примечания
Ссылки
- http://www.xumuk.ru
- http://chemindustry.ru
 Углеводороды Углеводороды | |
|---|---|
| Алканы | Метан • Этан • Пропан • Бутан • Пентан • Гексан • Гептан • Октан • Нонан • Декан • Ундекан • Додекан • Тридекан • Тетрадекан • Гексадекан • Эйкозан . |
| Алкены | Этилен • Пропен • Бутен • Пентен • Гексен • Гептен • Октен . |
| Алкины | Ацетилен • Пропин • Бутин |
| Диены | Пропадиен • Бутадиен • Изопрен |
| Другие ненасыщеные | Винилацетилен • Диацетилен |
| Циклоалканы | Циклопропан • Циклобутан • Циклопентан • Циклогексан • Декалин • Индан |
| Ароматические | Бензол • Толуол • Диметилбензолы • Этилбензол • Пропилбензол • Кумол • Стирол • Фенилацетилен • Индан • Циклобутадиен • Дифенил • Дифенилметан • Трифенилметан • Тетрафенилметан |
| Полициклические | Нафталин • Антрацен • Пентацен • Фенантрен • Пирен • Бензпирен • Азулен • Хризен |
 |
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Пропилен» в других словарях:
ПРОПИЛЕН — Газообразное углеводородное тело, входящее в состав светильного газа. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ПРОПИЛЕН бесцветный газ углеводородного состава., находящейся в светильном газе; под сильным… … Словарь иностранных слов русского языка
Пропилен — – вещество, представляющее собой бесцветный горючий газ со слабым запахом. Химическая формула СH2=СН–CH3. Пропилен является одним из важнейших видов промышленного химического сырья. Содержится в газах крекинга нефтепродуктов. Широко… … Нефтегазовая микроэнциклопедия
ПРОПИЛЕН — (пропен) СН3СН=СН2, бесцветный газ, tкип ?47,7 .С. Получают пиролизом нефтепродуктов и дегидрогенизацией пропана. Важное сырье химической промышленности; применяется для синтеза глицерина, акрилонитрила, кумола, полипропилена и др … Большой Энциклопедический словарь
ПРОПИЛЕН — (пропен), бесцветный алифатический УГЛЕВОДОРОД, СН2СН:СН2, получаемый термическим КРЕКИНГОМ ЭТИЛЕНА. Используется в производстве широкого ряда химических веществ, включая виниловую и акриловую смолы. Свойства: температура кипения 48 °С;… … Научно-технический энциклопедический словарь
пропилен — сущ., кол во синонимов: 3 • олефин (5) • пропен (1) • углеводород (77) Словарь синонимов ASIS … Словарь синонимов
ПРОПИЛЕН — (пропен CH2 = CHCH3) непредельный (ненасыщенный) углеводород ряда этилена; бесцветный горючий газ со слабым запахом. Получают пиролизом нефтепродуктов и дегидрогенизацией пропана. Является важным сырьем химической промышленности … Российская энциклопедия по охране труда
пропилен — (C3Н6) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN propylene … Справочник технического переводчика
ПРОПИЛЕН — (пропей), (СH2=CH СH3) ненасыщенный углеводород ряда этилена, горючий газ без цвета, но со слабым запахом; обладает высокой реакционной способностью. П. содержится в газах, образующихся при (см.) нефти; широко применяется для производства… … Большая политехническая энциклопедия
пропилен — а; м. Органическое соединение газ, выделяемый из попутных газов нефтедобычи и нефтепереработки (используется в производстве моторных масел). ◁ Пропиленовый, ая, ое. П ая смесь. * * * пропилен (пропен), СН3СН=СН2, бесцветный газ, tкип 47,7°C.… … Энциклопедический словарь
пропилен — propenas statusas T sritis chemija formulė CH₂=CHCH₃ atitikmenys: angl. propene; propylene rus. пропен; пропилен ryšiai: sinonimas – propilenas … Chemijos terminų aiškinamasis žodynas
Источник
Получение пропена лабораторным способом
Получение этилена и опыты с ним
Реактивы: этанол, серная кислота, бромная вода, раствор перманганата калия, речной песок.
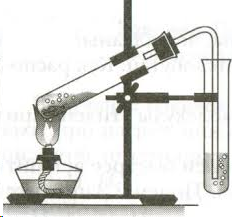
Оборудование: штатив, спиртовка, пробирка с газоотводной трубкой, штатив с пробирками, фильтровальная бумага или вата, спички.
Схема установки:
Проведение эксперимента
В пробирку налейте 3 мл этанола и осторожно добавьте и 9 мл серной кислоты. Затем добавьте немного сухого речного песка (на кончике чайной ложки). Песок обеспечит ровное кипение жидкости, без толчков и выбросов. Вставьте в пробирку пробку с изогнутой газоотводной трубкой. Приготовьте ещё две пробирки: в первую налейте 2-3 мл разбавленного раствора перманганата калия (розовый цвет), во вторую 2-3 мл раствора брома в воде (желто-коричневый цвет). Для получения этилена пробирку с этанолом и серной кислотой осторожно нагрейте в пламени спиртовки. Продолжая нагревание, опустите конец газоотводной трубки в пробирку с перманганатом калия (трубка должна находиться ниже уровня раствора). Пропускайте этилен до полного исчезновения розовой окраски. Смените пробирку и пропустите этилен через раствор бромной воды до полного обесцвечивания раствора брома. Уберите пробирку с обесцвеченным раствором. Протрите конец газоотводной трубки ватой или фильтровальной бумагой, поверните трубку вверх и подожгите выделяющийся газ. Обратите внимание на цвет пламени.
Реакция дегидратации этанола:
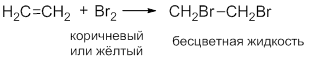
Обесцвечивание раствора Br2:
Исчезает окраска брома и образуется 1,2-дибромэтан.
Обесцвечивание водного раствора KMnO4 (без нагревания):
Исчезает окраска перманганата калия и образуется 1,2-этандиол (этиленгликоль).
Получение пропилена и опыты с ним
Пропилен получают аналогично этилену.
В пробирку помещают 3-4 мл изопропилового спирта и 9-12 мл серной кислоты. Осторожно нагревают. Выделяющийся газ пропускают через растворы бромной воды и перманганата калия, наблюдают исчезновение окраски растворов. Поджигают газ у конца газоотводной трубки.
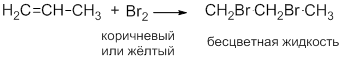
Обесцвечивание раствора Br2:
Исчезает окраска брома и образуется 1,2-дибромпропан.
Обесцвечивание водного раствора KMnO4 (без нагревания):
Исчезает окраска перманганата калия и образуется 1,2-пропандиол (пропиленгликоль).
Источник