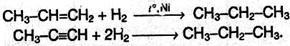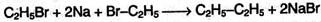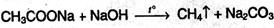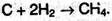- Способы получения. В обычных условиях первые четыре члена гомологического ряда алканов (C1 – С4) – газы. Нормальные алканы от пентана до гептадекана (C5 – С17 ) – жидкости,
- Пентан, свойства, химические реакции
- Пентан, свойства, химические реакции.
- Пентан, формула, газ, характеристики:
- Физические свойства пентана:
- Химические свойства пентана:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Пентан: способы получения и химические свойства
- Гомологический ряд пентана
- Строение пентана
- Изомерия пентана
- Структурная изомерия
- Химические свойства пентана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование пентана
- 2. Дегидрирование пентана
- 3. Окисление пентана
- 3.1. Полное окисление – горение
- Получение пентана
- 1. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 3. Гидрирование алкенов и алкинов
- 4. Синтез Фишера-Тропша
- 5. Получение пентана в промышленности
Способы получения. В обычных условиях первые четыре члена гомологического ряда алканов (C1 – С4) – газы. Нормальные алканы от пентана до гептадекана (C5 – С17 ) – жидкости,



Физические свойства
В обычных условиях первые четыре члена гомологического ряда алканов (C1 – С4) – газы. Нормальные алканы от пентана до гептадекана (C5 – С17 ) – жидкости, начиная с C18 и выше – твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды, они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан и др. Жидкие алканы легко смешиваются друг с другом.
Основные природные источники алканов – нефть и природный газ. Различные фракции нефти содержат алканы от C5H12 до С30Н62. Природный газ состоит из метана (95%) с примесью этана и пропана.
Из синтетических методов получения алканов можно выделить следующие:
1. Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом («гидрирование») происходит в присутствии металлических катализаторов (Ni, Pd) при нагревании:
2. Получение из галогенпроизводных. При нагревании моногалогензамещенных алканов с металлическим натрием получают алканы с удвоенным числом атомов углерода (реакция Вюрца):
Подобную реакцию не проводят с двумя разными галогензамещенными алканами, поскольку при этом получается смесь трех различных алканов.
3. Получение из солей карбоновых кислот. При сплавлении безводных солей карбоновых кислот с щелочами получают алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот (реакция Дюма):
4. Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:
Такая же реакция идет при нагревании углерода в атмосфере водорода но 400-500 °С при повышенном давлении в присутствии катализатора.
В лабораторных условиях метан можно получить из карбида алюминия:
Источник
Пентан, свойства, химические реакции
Пентан, свойства, химические реакции.
Пентан, C5H12 – органическое вещество класса алканов. В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе, в нефти.
Пентан, формула, газ, характеристики:
Пентан – органическое вещество класса алканов, состоящий из пяти атомов углерода и двенадцати атомов водорода. Название происходит от корня «пент-» (в переводе с древне-греческого «πέντε» – пять) и суффикса «-ан» (что означает принадлежность к алканам).
Химическая формула пентана C5H12. Имеет три изомера: н-пентан, изопентан (2-метилбутан) и неопентан (2,2-диметилпропан). Изомеры пентана различаются между собой по своим физическим свойствам.
Строение молекулы н-пентана:
Строение молекулы изопентана:
Строение молекулы неопентана:
Н-пентан – легколетучая подвижная горючая жидкость с характерным запахом.
Изопентан – легколетучая подвижная горючая жидкость с характерным запахом.
Неопентан – бесцветный газ, без вкуса, со специфическим характерным запахом.
В природе содержится в природном газе , добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе , в нефти . Также содержится в сланцевой нефти , сланцевом газе и сжиженном газе ( сжиженном природном газе ).
Пожаро- и взрывоопасен.
Мало растворяется в воде. Растворяется в органических веществах (ацетон, бензол, хлороформ, диэтиловый эфир и другие).
Пентан по токсикологической характеристике относится к веществам 3-го класса опасности (умеренно опасным веществам) по ГОСТ 12.1.007.
Физические свойства пентана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | специфический характерный запах |
| Вкус (неопентан) | без вкуса |
| Агрегатное состояние н-пентана (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Агрегатное состояние изопентана (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Агрегатное состояние неопентана (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность н-пентана (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 626 |
| Плотность изопентана (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 619,7 |
| Плотность неопентана (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 613 |
| Температура плавления н-пентана, °C | -129,72 |
| Температура плавления изопентана, °C | -159,89 |
| Температура плавления неопентана, °C | -16,55 |
| Температура кипения н-пентана, °C | 36,07 |
| Температура кипения изопентана, °C | 27,85 |
| Температура кипения неопентана, °C | 9,5 |
| Температура самовоспламенения н-пентана, °C | 309 |
| Критическая температура н-пентана*, °C | 196,62 |
| Критическая температура изопентана, °C | 187,39 |
| Критическая температура неопентана, °C | 160,75 |
| Критическое давление н-пентана, МПа | 3,369 |
| Критическое давление изопентана, МПа | 3,381 |
| Критическое давление неопентана, МПа | 3,199 |
| Критический удельный объём н-пентана, м 3 /кг | 231,9 |
| Критический удельный объём изопентана, м 3 /кг | 234 |
| Критический удельный объём неопентана, м 3 /кг | 237,7 |
| Взрывоопасные концентрации смеси газа н-пентана с воздухом, % объёмных | от 1,5 до 7,8 |
| Удельная теплота сгорания н-пентана, МДж/кг | 45,38 |
| Молярная масса н-пентана, г/моль | 72,15 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства пентана:
Химические свойства пентана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны аналогичные химические реакции.
Примечание: © Фото //www.pexels.com, //pixabay.com

газовая газ редуктор газовый баллон метан пентан этан пентан пропен цена купить реакции 1 4 50 3 какой кислород вещество авто температура кг воздух вода
заправка баллонов пентаном
сколько литров стоимость сгорание уравнение реакций давление смесь расход объем литр пентана
сжиженный пентан
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 541)
- Экономика Второй индустриализации России (102 549)
- Программа искусственного интеллекта ЭЛИС (27 759)
- Метан, получение, свойства, химические реакции (24 204)
- Этилен (этен), получение, свойства, химические реакции (23 961)
- Природный газ, свойства, химический состав, добыча и применение (21 572)
- Крахмал, свойства, получение и применение (20 892)
- Пропилен (пропен), получение, свойства, химические реакции (20 002)
- Целлюлоза, свойства, получение и применение (19 742)
- Прямоугольный треугольник, свойства, признаки и формулы (19 001)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Пентан: способы получения и химические свойства
Пентан C5H12 – это предельный углеводород, содержащий пять атомов углерода в углеродной цепи. Бесцветная жидкость с характерным запахом, нерастворим в воде и не смешивается с ней.
Гомологический ряд пентана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение пентана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :

При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:

При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:

Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:

Это соответствует тетраэдрическому строению.
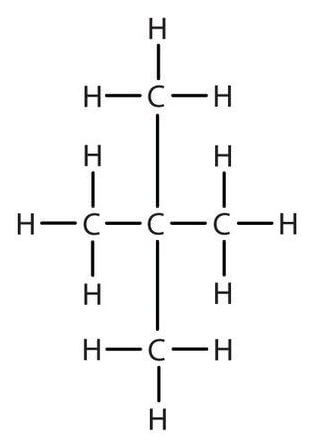
| Например, в молекуле пентана C5H12 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение. |
Изомерия пентана
Структурная изомерия
Для пентана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Для углеводородов состава С5Н12 существуют три изомера углеродного скелета: н-пентан, метилбутан (изопентан), диметилпропан (неопентан) |
| Пентан | Изопентан |
| CH3-CH2-CH2-CH2-CH3 | CH3-CH(CH3)-CH2-CH3 |
Для пентана не характерна пространственная изомерия.
Химические свойства пентана
Пентан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для пентана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для пентана характерны радикальные реакции.
Пентан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Пентан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании пентана образуется смесь хлорпроизводных.
| Например, при хлорировании пентана образуются 1-хлорпентан, 2-хлорпентан и 3-хлорпентан: Бромирование протекает более медленно и избирательно.
|