Литий: способы получения и химические свойства
Литий — это щелочной металл, серебристо-белого цвета. Самый легкий из металлов, мягкий, низкая температура плавления.
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Качественная реакция
Качественная реакция на литий — окрашивание пламени солями лития в карминно-красный цвет .
Химические свойства
Литий — активный металл; на воздухе реагирует с кислородом и азотом, и покрывается оксидно-нитридной пленкой. Воспламеняется при умеренном нагревании; окрашивает пламя газовой горелки в темно-красный цвет.
1. Литий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами .
1.1. Литий легко реагирует с галогенами с образованием галогенидов:
2Li + I2 = 2LiI
1.2. Литий реагирует с серой с образованием сульфида лития:
2Li + S = Li2S
1.3. Литий активно реагирует с фосфором и водородом . При этом образуются бинарные соединения — фосфид лития и гидрид лития:
3Li + P = Li3P
2Li + H2 = 2LiH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
1.5. Литий реагирует с углеродом с образованием карбида:
1.6. При взаимодействии с кислородом литий образует оксид.
2. Литий активно взаимодействует со сложными веществами:
2.1. Литий бурно реагирует с водой . Взаимодействие лития с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
2Li 0 + H2 + O = 2 Li + OH + H2 0
Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Литий взаимодействует с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , литий бурно реагирует с соляной кислотой :
2Li + 2HCl = 2LiCl + H2↑
2.3. При взаимодействии лития с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии лития с концентрированной серной кислотой образуется сульфат лития, диоксид серы и вода:
2.4. Литий реагирует с азотной кислотой:
3Li + 4HNO3(разб.) = 3LiNO3 + NO↑ +2H2O
2.5. Литий может реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
2.6. В расплаве литий может взаимодействовать с некоторыми солями . Обратите внимание! В растворе литий будет взаимодействовать с водой, а не с солями других металлов.
Например , литий взаимодействует в расплаве с хлоридом алюминия :
3Li + AlCl3 → 3LiCl + Al
Источник
Получение лития электролитическим способом
Наличие искусственных водоемов на приусадебных участках уже давно перестало быть редкостью. К настоящему времени они стали не только красивыми и функциональными, но и.
Скрытые петли – это фурнитура, которая позволяет сделать зазор между полотном и коробом минимальным, а эксплуатацию двери удобной, долговечной и надежной.
Если вы новичок в сварке и только начинаете свой путь, то сегодняшний огромный рыночный ассортимент продукции сварочных аппаратов, поначалу может привести в.
Из одного деревянного бруса сразу несколько досок выпиливаются с помощью многопильных деревообрабатывающих станков. Формы и размеры заготовок задаются заранее. По.
Долговечность и устойчивость строения зависит от качества и прочности фундамента. Специальные блоки нередко используют для того, чтобы создать надежное основание. Со.
Натяжной потолок — отличное решение для современного интерьера, имеющее целый ряд преимуществ.
В сохранности стремятся сохранить свое имущество все люди. Только злые собаки и надежные замки раньше были в распоряжении владельцев частных домов. Дополнительную охрану.
В современных интерьерах все чаще можно увидеть стеклянные элементы. Это козырьки, душевые кабины, перегородки, двери и другие конструкции.
Источник
Получение лития электролитическим способом
Вследствие высокого сродства к кислороду и к галогенам литий получают либо электролизом расплавленных сред, либо металлотермическим восстановлением с отгонкой лития.
Технология производства металлического лития
Получение чистого хлорида лития
Безводный хлорид лития, служащий исходным материалом для производства лития, обычно получают из карбоната лития. Содержание примесей, %: натрия 0,12; кальция 0,03; алюминия 0,05; железа 0,005; сульфат-иона 0,1; оксида кремния 0,05; фосфат-иона 0,005.
Для получения хлорида лития обычно требуется предварительная очистка карбоната лития от примесей. Очистку проводят методом перекристаллизации через хорошо растворимый бикарбонат лития (способ Труста). С этой целью через водную суспензию Li2CO3 пропускают СО2, что приводит к переходу лития в раствор в виде бикарбоната LiHCO3.
При кипячении раствора бикарбонат разрушается, из раствора осаждается очищенный Li2CO3.
Для получения хлорида лития влажный карбонат растворяют в 30 %-ной соляной кислоте. Раствор очищают от примесей, выпаривают (трудности выпаривания и последующего обезвоживания хлорида обусловлены высокой коррозирующей способностью LiCl и его растворов, для выпаривания используют аппараты из керамики или специальных сплавов, а для обезвоживания хлорида – керамическую аппаратуру), кристаллизуют хлорид LiCl∙Н2О, хлорид обезвоживают (сушат) при 120 – 150 о С с получением LiCl.
Электролиз проводят в электролите при соотношении LiCl : KCl = 1 : 1 (по массе), что близко к составу эвтектики в системе LiCl – KCl, плавящейся при 361 о С. Это позволяет проводить электролиз при 400 — 460 о С.
На рисунке 4.3 показана принципиальная схема электролизера с двумя прикатодными пространствами, отделенными от анодного пространства диафрагмами. Стальной кожух ванны футеруют графитом – наиболее устойчивым материалом по отношению к хлориду лития.
Рис. 4.3 – Схема электролизера для получения лития
Катодами служат пластины из низкоуглеродистой стали, анодами – графитовые стержни. Потенциалы разложения LiCl и KCl в электролите эвтектического состава при 400 о С равны 3,78 и 3,89 В соответственно, что обусловливает частичное выделение калия на катоде.
Электролиз ведут при 400 — 430 о С при плотности тока на катоде и аноде 2,0 — 5,0 и 0,8 — 1,5 А/см 2 соответственно. Выход по току достигает 90-95 %.
Растворимость калия в литии плохая (0,5 – 1,5 %), поэтому он образует новую фазу, окисляется в электролизере до K2O и растворяется в электролите. Выделяющийся на катоде жидкий литий всплывает на поверхность электролита, и его вычерпывают железной сетчатой ложкой по мере накопления. Металл защищен от окисления тонкой пленкой солей, хорошо смачивающих жидкий литий. Примерное содержание примесей в электролитическом литии, %: Na 0,3 — 2,5; K 0,02 — 1,5; Cu, Fe, Ca от 0,001 до 0,4; Si 0,004 — 0,8; Al 0,002 — 0,12; Mg 0,003; Cl 0,01. Полученный литий переплавляют в парафине и хранят в банках с парафином. По ходу электролиза в анодное пространство периодически вводят LiCl, поддерживая в ванне его содержание 55 — 57 % (по массе). Хлор из анодного пространства направляется в абсорбер, орошаемый известковым молоком.
Электролизом, помимо лития, можно получать сплавы лития с другими металлами (кальцием, магнием, тяжелыми металлами). Для этого либо вводят в электролит хлорид соответствующего металла, либо ведут электролиз с растворимым анодом из металла – компонента сплава с литием.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
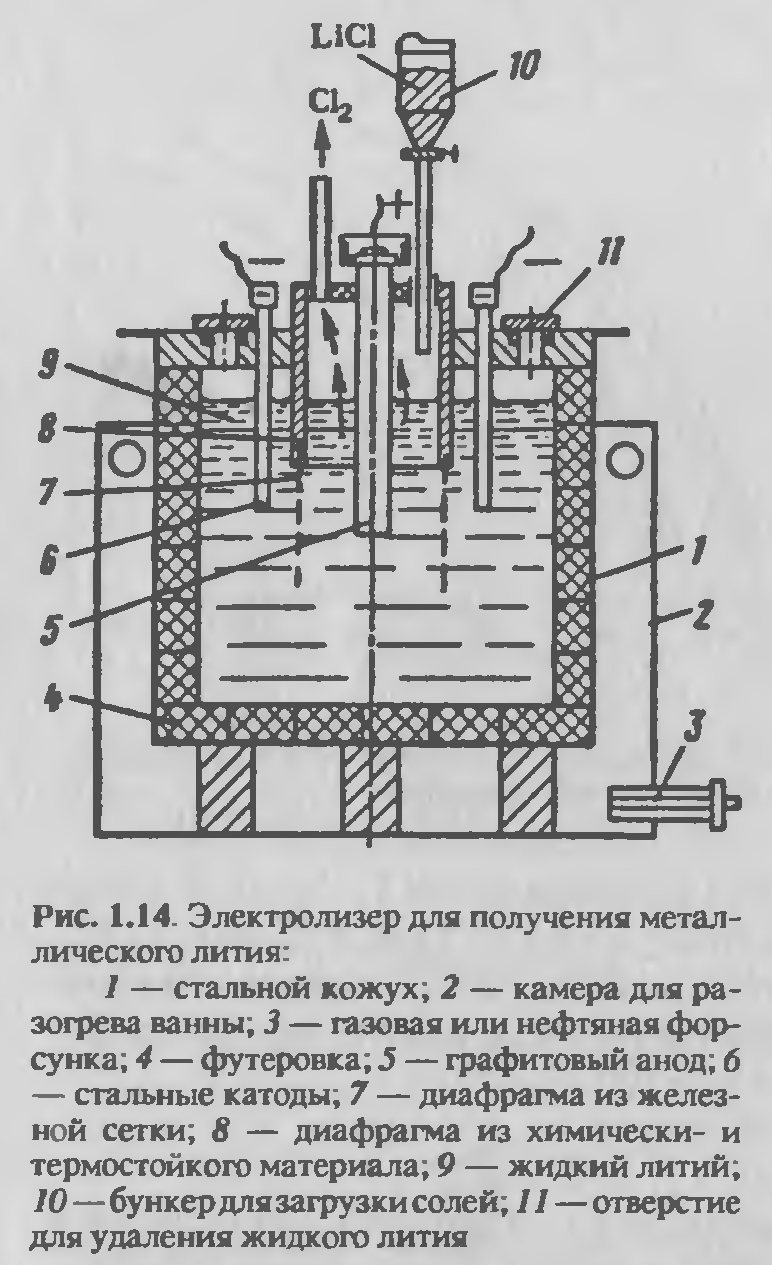
Получение металлического лития
Металлический литий получают двумя способами: электролизом и вакуумтермией. Вследствие высокой химической активности лития и термодинамической устойчивости его соединений процессы его получения связаны с рядом трудностей. Они заключаются в ограниченности выбора возможных способов получения, в необходимости защиты получающегося металла от действия кислорода, азота, углекислого газа и водяных паров, в подборе конструкционных материалов, устойчивых к действию лития и его соединений при повышенной температуре.
Электрохимическое получение лития. Электрохимические характеристики показывают, что литий можно получить только электролизом расплавов, электролиз водных растворов невозможен. В водных растворах электродный потенциал лития имеет очень большое отрицательное значение, вследствие чего на катоде при электролизе будет выделяться водород. Для электролиза обычно используют расплавы галогенидов, однако индивидуальные галогениды лития LiCl и LiF для этой цели непригодны вследствие высоких температур плавления, при которых давление паров лития становится довольно большим. Для снижения температуры плавления электролита используют смесь LiCl и КС1 в соотношении 1:1; такой состав близок к составу эвтектики в системе LiCl– КС1 [58,5 % (мол.) LiCl, Тпл = 361°С ]. Электролиз проводят при 400–430°С.
Напряжение разложения хлоридов магния, кальция и натрия в расплавах меньше напряжения разложения хлорида лития при 700°С, В:
2,60 3,38 3,39 3,41 3,53
Эти элементы будут восстанавливаться на катоде раньше лития и поэтому будут полностью переходить в металл. Напряжение разложения хлорида калия лишь очень немного больше напряжения разложения хлорида лития. Такая небольшая разница сохраняется в широком интервале температур. В результате выделение калия на катоде увеличивается при обеднении расплава электролита хлоридом лития, поэтому состав электролита постоянно нужно корректировать, добавляя LiCl и не допуская снижения его концентрации ниже 55–57%. Для уменьшения загрязнения металлического лития магнием, кальцием и натрием необходимо использовать исходный хлорид лития высокой степени чистоты.
Для электролиза используют электролизеры с разделенными анодным и катодным пространствами (рисунок 2.13). Корпус электролизера стальной, футерован графитом, материалом, наиболее устойчивым по отношению к расплавленному хлориду лития. Футеровка из графита служит около трех месяцев, так как постепенно разрушается вследствие образования карбида лития. Более чистый металл получают в электролизерах со стальными водоохлаждаемыми стенками, на которых образуется гарнисаж из затвердевших солей электролита. Аноды графитовые, катоды — из малоуглеродистой стали, но могут использоваться и более стойкие металлы, такие как ниобий и тантал. Катодное и анодное пространство разделяют диафрагмой из железной сетки. При электролизе литий, вследствие меньшей плотности, чем расплав солей, собирается на поверхности расплава электролита в катодном пространстве. Расплавленный литий защищен от соприкосновения с воздухом тонкой пленкой расплавленных солей. По мере накопления расплавленного лития он удаляется вручную. Хлор из анодного пространства отсасывается вентиляторами и направляется на нейтрализацию известковым молоком.
Электролиз характеризуется следующими показателями: выход по току 90–93 %, расход электроэнергии на 1 кг лития до 144 кВт·ч. И извлечение лития до 95 %, напряжение на ванне 6–6,6В. Содержание примесей в электролитическом литии, %: 0,3–2,5 Na; 0,02–1,50 К; 0,002–0,12 А1; 0,003 Mg; 0,001–0,04 Са, Fe, Сu; 0,004–0,8 Si; 0,01 С1.
Электрохимический метод может быть использован для получения сплавов лития с другими металлами — магнием, алюминием, кальцием, свинцом и др. При получении сплавов с легкоплавкими металлами с невысокой плотностью возможны два варианта проведения процесса электролиза. По первому — хлорид соответствующего металла вводится в состав электролита; по второму — из этого металла изготовляется катод, который по мере выделения лития растворяется в нем. В обоих случаях образуется жидкий сплав, собирающийся на поверхности расплава электролита.
Электрохимический метод является достаточно эффективным и применяется в промышленных масштабах. В то же время он не лишен недостатков, важнейшие из которых следующие: необходимый для него безводный хлорид лития высокой чистоты является дорогим продуктом; получающийся металлический литий загрязнен примесями, прежде всего натрием, что требует дополнительной его очистки; выделяющийся при электролизе хлор необходимо обезвреживать.
Рисунок 2.13 — Электролизер для получения металлического лития.
Вакуумтермическое восстановление. Термодинамический анализ реакций типа приведенной ниже показывает, что большинство из них характеризуется положительными значениями изменения энергии Гиббса особенно велики они для восстановления фторидов и хлоридов:
LiX + M → Li + MX, где Х — F, С1, О.
Это является следствием того, что соединения лития с кислородом и особенно с фтором и хлором термодинамически более прочны, чем соответствующие соединения наиболее активных металлов-восстановителей (Na, Са, Mg, А1 и др.). При таких термодинамических характеристиках осуществление металлотермического процесса становится возможным при условии удаления получаемого металла из зоны реакции или связывания получаемых продуктов каким-либо компонентом, дополнительно вводимым в исходную шихту. В результате равновесие реакции смещается вправо, этому благоприятствует относительно низкая температура кипения лития.
Наиболее подходящими для восстановления оксида лития оказались элементарный кремний и металлический алюминий, имеющие высокие температуры кипения.
При восстановлении лития кремнием в шихту вводят оксид кальция, который связывает образующийся оксид кремния и препятствует образованию силиката лития. Суммарная реакция процесса может быть выражена уравнением:
Оксид лития, необходимый для процесса, получают термическим разложением карбоната лития. Для этого нагревают в вакууме при 850°С брикетированную смесь Li2CO3 и СаО, взятых в соотношении 1:1,5. Оксид кальция добавляют для предотвращения плавления карбоната и облегчения удаления углерода. Полученную смесь оксидов измельчают, шихтуют с кремнием, который берется с избытком 10 %, нагревают в вакуумной печи при давлении 0,1 Па и температуре 1000–1300°С. Извлечение лития при 1000°С составляет 75 %, а при 1300 °С увеличивается до 93 %. Основные примеси в металлическом литии: 0,01 % Si и 0,04 % Са.
При восстановлении оксида лития алюминием в шихту также добавляют оксид кальция, который связывает образующийся оксид алюминия и препятствует образованию алюмината лития:
Лучшие результаты по получению лития повышенной чистоты дает восстановление алюмината лития, которое не требует введения в шихту СаО.
Исходный алюминат получают путем взаимодействия стехиометрических количеств карбоната лития и оксида алюминия в вакууме при 900–1000°С. Процесс восстановления проводят при давлении 10 Па и температуре 1150–1200 °С. Извлечение лития достигает 95–98 %.
Металлотермическое восстановление оксида лития имеет некоторые преимущества перед электролизом расплавов: в качестве исходного сырья используется карбонат лития, являющийся основным продуктом большинства современных технологических схем переработки литиевого сырья. Способ позволяет получать из технических продуктов более чистый литий, чем электрохимический метод; восстановителями служат кремний и алюминий, относительно дешевые и доступные.
Дата добавления: 2015-06-22 ; просмотров: 3641 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник