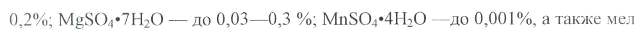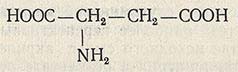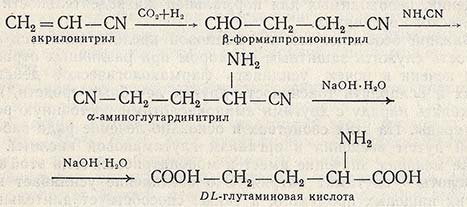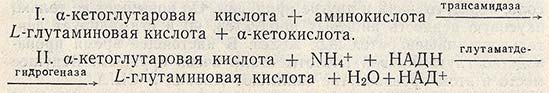Производство глутаминовой кислоты
Трейдинг криптовалют на полном автомате по криптосигналам. Сигналы из первых рук от мощного торгового робота и команды из реальных профессиональных трейдеров с опытом трейдинга более 7 лет. Удобная система мгновенных уведомлений о новых сигналах в Телеграмм. Сопровождение сделок и индивидуальная помощь каждому. Сигналы просты для понимания как для начинающих, так и для опытных трейдеров. Акция. Посетителям нашего сайта первый месяц абсолютно бесплатно .
2.4 Микробиологический синтез глутаминовой кислоты
Наиболее перспективным и широко используемым способом производства глутаминовой кислоты является микробиологический синтез. Впервые овозможности получения L-глутаминовой кислоты непосредственно из углеводов с помощью микроорганизмов методом глубинного культивирования сообщили в 1957 г. Японские ученые Киносита, Асаи и др.
ящему времени выяснено, что способностью продуцировать глутаминовую кислоту обладают некоторые расы дрожжей, микроскопические грибы, бактерии. Однако практически только бактерии могут синтезировать глутаминовую кислоту с выходом не менее 40% относительно исходного сахара или другого сырья. Поэтому промышленное значение имеют пока только бактерии, относящиеся к родам Micrococcus, Brevibacterium, Microbacterium, Corynebacterium.
Это, главным образом, палочковидные, грамположительные, неподвижные бактерии, не образующие спор. Специфической для них является обязательная потребность в биотине либо в биотине и тиамине. Сырьем для получения глутаминовой кислоты кроме углеводов могут быть также различные углеводороды, начиная от природного газа (метан, этан) и кончая н-парафинами или ароматическими соединениями (бензиловый спирт пирокатехин и пр.). Могут быть также использованы газойль, уксусная, аминомасляная, фумаровая кислоты и ряд других продуктов.
3. Технологическая схема производства
Имеет много общего со схемой производства лизина. Последовательность этапов и требования, предъявляемые к процессу в целом, очень близки. Основные различия заключаются в свойствах микроорганизма-продуцента, условиях его культивирования, составе среды, стадии очистки.
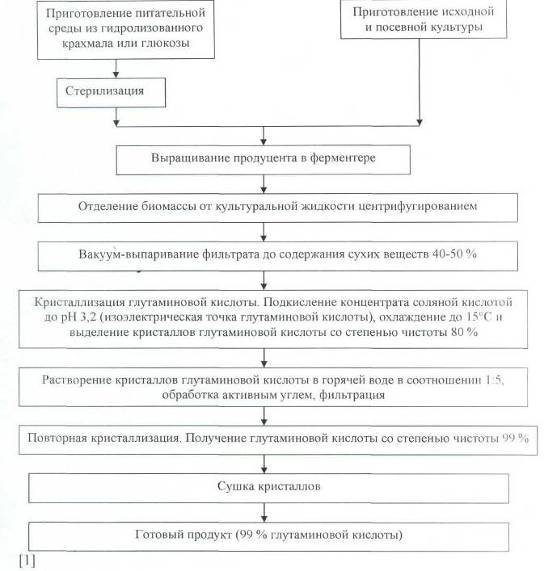
Схема получения глутаминовой кислоты при использовании в качестве источников углерода глюкозы или гидролизата крахмала представлена ниже.
Принципиальная технологическая схема получения глутаминовой кислоты или глутамата натрия складывается из следующих стадий: получение посевного материала; приготовление питательной среды, ее стерилизация, охлаждение и засев готовым посевным материалом; выращивание продуцента в ферментаторе до накопления максимального количества глутаминовой кислоты; выделение глутаминовой кислоты в кристаллическом виде или в виде кристаллов глутамата натрия, сушка кристаллов, фасовка и упаковка.
4. Характеристика сырья материалов и полупродуктов
Состав питательной среды для главной ферментации и для получения посевного материала в значительной степени зависит от используемого продуцента, от его физиологических особенностей. Основным источником углерода в среде чаще всего используются глюкоза, сахароза, гидролизаты крахмала, свекловичная меласса, гидрол. Количество усваиваемого сахара в пересчете на сахарозу должно быть в пределах от 8,5 до 25%. Но следует помнить, что пределы использования мелассы определяются уровнем в ней биотина. Концентрация биотина, по данным большинства исследователей, не должна превышать 2–5 мкг на 1 л питательной среды, иначе вместо глутаминовой кислоты будут интенсивно накапливаться аланин, молочная, янтарная, аспарагиновая кислоты, резко возрастет прирост биомассы продуцента, но снизится выход глутаминовой кислоты. Иными словами, максимум биосинтеза глутаминовой кислоты не совпадает с максимумом образования биомассы, так как потребность в биотине для этих двух процессов различна. Помимо мелассы биотин в среду может быть внесен и с кукурузным экстрактом.
Ингибирующее влияние биотина удается снизить при включении в состав питательных сред различных добавок в виде некоторых спиртов, ПАВ, антибиотиков (пенициллинов, тетрациклинов). Вероятно, это связано с изменением липидного состава клеточных мембран, что способствует увеличению проницаемости клеточных мембран для глутаминовой кислоты. Присутствие такого рода стимуляторов позволяет вести ферментацию с большим выходом глутаминовой кислоты при повышенных концентрациях биотина. Добавки в среду ПАВ в количестве 0,01–0,2% или калиевой соли бензилпенициллина повышают биосинтетическую способность продуцента на 15–45% и выход глутаминовой кислоты достигает 50г/л. [2]
В качестве источника азота в питательных средах чаще всего используют мочевину в количестве до 1,5–2,0% в зависимости от особенностей используемого штамма, но вводится она дробно, по мере потребления ее из среды, и так, чтобы содержание ее в культуралыюй жидкости не превышало 0,8% и рН среды было в пределах от 6,8 до 7,8.
Недостаток азота в среде приводит к снижению синтеза глутаминовой кислоты и к накоплению в среде повышенных количеств α-кетоглутаровой кислоты.
Для нормального роста культуры и образования ею глутаминовой кислоты необходимо вводить в среду соли калия в виде КН2РО4 до 0,1-
для поддержания рН среды на оптимальном уровне – около 7–7,2. Длительность культивирования зависит от содержания сухих веществ в среде, способа введения компонентов среды (единовременно или дробно), степени аэрации среды и, конечно, от физиологических особенностей продуцента. [2]
5. Изложение технологического процесса
5.1 Приготовление питательной среды
Для промышленных штаммов Coryn. glutamicum питательные среды при производстве посевного материала, как правило, содержат следующие компоненты (в%) [2]:
Источник
Глутаминовая кислота и глутамат натрия
Глутаминовая кислота (a-аминоглутаровая) является одной из важнейших аминокислот растительных и животных белков. Не являясь незаменимой, она тем не менее служит основой для синтеза многих физиологически активных соединений, необходимых для нормальной жизнедеятельности человеческого организма.
Важной особенностью глутаминовой кислоты является способность служить защитным фактором при различных отравлениях печени и почек, усиливать фармакологическое действие одних и ослаблять токсичность других лечебных средств, поддерживать наряду с другими аминокислотами постоянную реакцию среды. На этих свойствах и основано лечение ряда заболеваний путем введения в организм глутаминовой кислоты.
Не меньшее значение имеет и мононатриевая соль этой аминокислоты — глутамат натрия. Это соединение усиливает вкус многих пищевых продуктов, а также способствует длительному сохранению вкусовых качеств консервированных продуктов. Это обстоятельство позволяет широко использовать моноглутамат натрия в консервной промышленности, особенно при консервировании овощей, рыбы, мясных продуктов.
Во многих зарубежных странах глутамат натрия добавляют абсолютно во все продукты при консервировании, замораживании или просто при хранении. В Японии, США и других странах глутамат натрия является такой же обязательной принадлежностью стола, как соль, перец, горчица и другие приправы. Он повышает не только вкусовую ценность пищевых продуктов, но и стимулирует деятельность пищеварительных желез. В настоящее время производство глутаминовой кислоты стало очень крупным. Ведущее место в этом производстве занимают Япония и США.
Известно несколько способов получения глутаминовой кислоты: гидролиз различных белков, синтез химический, ферментативный из а-кетоглутаровой кислоты и микробиологический.
Получение глутаминовой кислоты гидролизом белков
Гидролиз протеинов является классическим методом получения аминокислот из природных источников. Для выработки глутаминовой кислоты и ее натриевой соли используются животные и растительные белки: казеин молока, клейковина пшеницы, кукурузный глютен, отходы мясокомбинатов, свеклосахарных (сепарационный щелок) и спиртовых заводов (барда).
Метод гидролиза малопроизводителен и довольно дорог из-за значительного образования побочных продуктов и необходимости тщательной очистки глутаминовой кислоты.
Комплексная переработка мелассы позволяет получить наряду с высококачественными сахарными сиропами глутаминовую кислоту, бетаин, холин и другие ценные продукты.
Химический синтез глутаминовой кислоты
Среди методов химического синтеза наиболее перспективным является использование в качестве исходного сырья акрилонитрила. Согласно этому методу акрилонитрил в результате реакции гидроформилирования превращается в (B-формилпропионнитрил и последний через стадию образования а-аминоглутардинитрила переводится в DL-глутаминовую кислоту.
Основным недостатком химического синтеза является получение рацематов аминокислот. Разделение D- и L-изомеров является довольно сложной операцией и требует больших затрат.
Ферментативный синтез глутаминовой кислоты
Получение L-глутаминовой кислоты из а-кетоглутаровой возможно переаминированием аминокислот (I) и восстановительным аминированием (II):
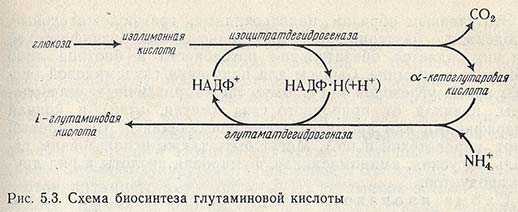
В обоих случаях а-кетоглутаровая кислота является предшественником L-глутаминовой (рис. 5.3).
Многие микроорганизмы (Pseudomonas, Escherichia) способны продуцировать значительное количество а-кетоглутаровой кислоты. Так, при использовании в качестве продуцента Kluyverd citrophila а-кетоглутаровая кислота была получена с 57%-ным выходом.
Дрожжи рода Candida также способны синтезировать а-кетоглутаровую кислоту вместе с небольшим количеством пировиноградной (обычно в соотношении 85:15) при культивировании на н-парафинах. Выход а-кетоглутаровой кислоты достигает 90 % от количества использованных углеводородов.
Для проведения реакции I можно использовать Е. coli и другие микроорганизмы. Донором аминогруппы может быть аспарагиновая кислота или аланин.
Восстановительное аминирование (II) — более сложный процесс. При использовании Pseudomonas ovalis выход аминокислоты составляет 60 %. В ряде случаев при получении L-глутаминовой кислоты с помощью Pseudomonas или Aeromonas а-кетоглутаровую кислоту можно заменить на DL-a-оксиглутаровую кислоту, получаемую синтетическим путем.
Микробиологический синтез глутаминовой кислоты
Наиболее перспективным и широко используемым способом производства глутаминовой кислоты является микробиологический синтез. Впервые о возможности получения L-глутаминовой кислоты непосредственно из углеводов с помощью микроорганизмов методом глубинного культивирования сообщили в 1957 г. японские ученые Киносита, Асаи и др.
К настоящему времени выяснено, что способностью продуцировать глутаминовую кислоту обладают некоторые расы дрожжей, микроскопические грибы, бактерии. Однако практически только бактерии могут синтезировать глутаминовую кислоту с выходом не менее 40% относительно исходного сахара или другого сырья. Поэтому промышленное значение имеют пока только бактерии, относящиеся к родам Micrococcus, Вгеvibacterium, Microbacterium, Corynebacterium.
Это главным образом палочковидные, грамположительные, неподвижные бактерии, не образующие спор. Специфической для них является обязательная потребность в биотине либо в биотине и тиамине. Сырьем для получения глутаминовой кислоты кроме углеводов могут быть также различные углеводороды, начиная от природного газа (метан, этан) и кончая н-парафинами или ароматическими соединениями (бензиловый спирт, пирокатехин и пр.). Могут быть также использованы газойль, уксусная, аминомасляная, фумаровая кислоты и ряд других продуктов.
Схема производства глутаминовой кислоты. Имеет много общего со схемой производства лизина. Последовательность этапов и требования, предъявляемые к процессу в целом, очень близки. Основные различия заключаются в свойствах микроорганизма-продуцента, условиях его культивирования, составе среды, стадии очистки.
Схема получения глутаминовой кислоты при использовании в качестве источников углерода глюкозы или гидролизата крахмала представлена ниже.
Для нормального роста культуры и синтеза ею глутаминовой кислоты в качестве источника азота применяют мочевину в количестве до 1,5-2,0%, жидкий аммиак и аммиачную воду, часто используют различные соли аммония, например NH4C1, (NH4)2SO4. В качестве вспомогательных материалов в состав питательных сред вводят сернокислый магний, марганец, железо и другие соединения. В питательные среды наряду с источниками углерода и азота вносят также различные биостимуляторы, например кукурузный, дрожжевой и солодовый экстракты, пептон, витамины, аминокислоты. Из витаминов обычно используются тиамин и биотин. Высокие концентрации биотина — более 5 мкг на 1 л питательной среды, как правило, способствуют росту биомассы, но снижают выход глутаминовой кислоты.
При получении глутаминовой кислоты из мелассы основная трудность заключается в снижении высокого содержания биотина. Это достигается, например, добавлением в культуральную жидкость некоторых спиртов для ингибирования действия биотина или поверхностно-активных веществ (ПАВ). Так, при использовании этого метода культура Microbacterium ammoniaphilum на питательной среде, содержащей 7,0 г/л тростниковой мелассы, обеспечивала выход глутаминовой кислоты более 70 г/л.
Некоторые антибиотики (пенициллин, тетрациклин, окситетрациклин) снимают тормозящее действие избытка биотина и могут быть использованы при получении глутаминовой кислоты, например с помощью штамма Brevibacterium 22, применяемого в производстве лизина. Продуцент активно развивается на среде следующего состава (г/л): мелассы 15; К2НРО4 0,05; КН2РO4 0,05 и мочевины 0,8.
Переключение биосинтетической способности культуры с лизина на глутаминовую кислоту может быть достигнуто добавлением в обычную кукурузно-мелассную среду через 4-5 ч от начала культивирования небольших количеств (2-4 ед. на 1 мл среды) пенициллина, изменяющего проницаемость клетки. Образующиеся при этом протопласты обладают высокой биосинтетической активностью, превращая до 89 % потребленного сахара в глутаминовую кислоту.
За 30 ч культивирования при 2 г/л растворенного кислорода по сульфитному числу в среде накапливалось около 30 г/л глутаминовой кислоты. Следует отметить, что примерно половина сахара, содержащегося в исходной среде, остается неиспользованной. В связи с этим данный способ целесообразно применять в сочетании с другим микробиологическим производством, в котором утилизируются остаточные сахара, например с производством лизина.
Для получения глутаминовой кислоты по методу, разработанному в Институте микробиологии им. А. Кирхенштейна АН ЛатвССР, культуру Micrococcus glutamicus размножают в лаборатории — в пробирках, затем в колбах на качалке. Питательная среда имеет следующий состав (в %): сахарозы 5, мочевины 1, мелассы 1,5, сульфата магния 0,1, одно- и двухзамещенного фосфата калия 0,1. Температура культивирования 28-30 °С, pH 6,8-7,5, длительность выращивания 24 ч. Инокулят готовят в аэробных условиях на среде такого же состава в ферментаторах вместимостью 2 и 5 м3 до получения 6-8 г/л сухой биомассы. Инокулят в количестве 5-6% (от объема среды) вносят в ферментаторы на 50 м3. Коэффициент заполнения аппарата 0,7.
Производственное культивирование проводят на среде следующего состава (в %): сахарозы 8,5-10, мелассы 1,2, мочевины 0,5, одно- и двухзамещенного фосфата калия 0,01, сульфата марганца и сульфата цинка 0,005. Интенсивность аэрации составляет 40-45 мг 02 л/мин, pH 7,8-8,0, температура 28-30 °С. Процесс культивирования длится 48 ч. За это время в среде накапливается до 50 г/л глутаминовой кислоты. Биомассу отделяют от культуральной жидкости центрифугированием.
Глутаминовую кислоту выделяют из фильтрата культуральной жидкости сорбцией на смоле КУ-2 в NН+4-форме. Сорбционная емкость катионита составляет 0,08-0,1 г глутаминовой кислоты на 1 г абсолютно сухого катионита. После промывки колонки 0,001 н. серной кислотой элюция проводится 0,2 н. раствором аммиака, при этом выход глутаминовой кислоты на стадии элюции составляет более 99%.
Собранные элюаты обрабатывают активным углем и сгущают под вакуумом при 40 °С в 3-5 раза. После подкисления соляной кислотой до pH 3,2 при 4 °С выкристаллизовывалось около 77% глутаминовой кислоты. Повторная обработка маточника повышала выход глутаминовой кислоты до 87%, чистота получаемых кристаллов составляла 99,2%. После перекристаллизации чистота повышается до 99,6%, что удовлетворяет требованиям фармакопии.
Получение глутамата натрия. Глутамат натрия НООС-СН2-СН2-CH(NH2)-COONa-H2O получают из технической глутаминовой кислоты. Водный раствор ее обрабатывают активным углем до полного обесцвечивания при температуре 60-70 °С и введении NaOH, pH раствора доводят до 6,8-6,85, после чего фильтруют. Раствор глутамата натрия упаривается под вакуумом при 40-50 °С до содержания сухих веществ примерно 60%, а затем передается на кристаллизацию. Кристаллизация проводится в течение 3 сут. при плавном снижении температуры. Кристаллы глутамата натрия отделяют от маточного раствора на центрифуге и высушивают нагретым воздухом до остаточной влажности 0,05-0,1%.
В соответствии с требованиями МРТУ 18/210-68 глутамат натрия пищевой должен иметь следующий состав (в %):
Источник