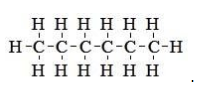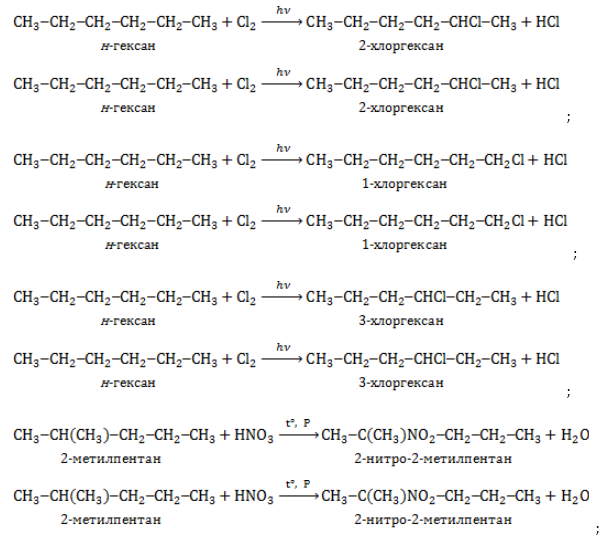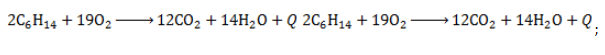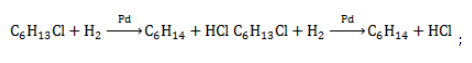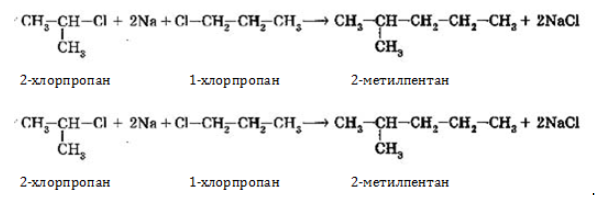- Изомеры гексана
- Формула и строение гексана
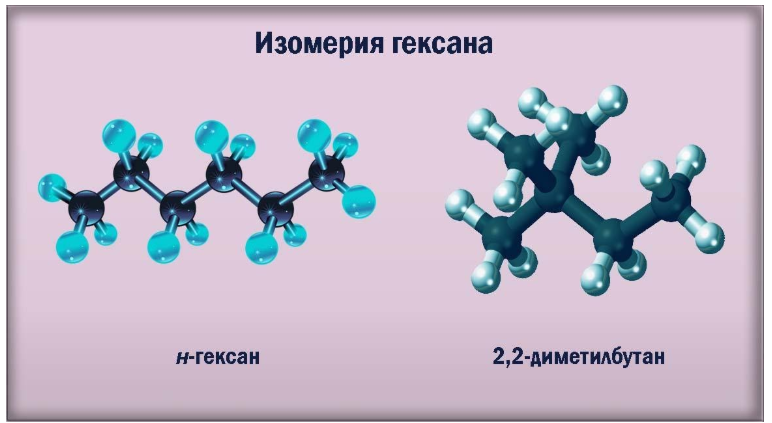
- Изомерия гексана
- Свойства гексана
- Физические свойства (таблица)
- Химические свойства
- Получение гексана
- Применение гексана
- Заключение
- Гексан: способы получения и химические свойства
- Гомологический ряд гексана
- Строение гексана
- Изомерия гексана
- Структурная изомерия
- Химические свойства гексана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование гексана
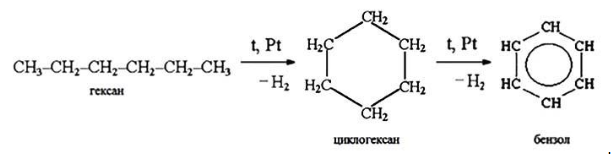
- 2. Дегидрирование гексана
- 3. Крекинг
- 4. Окисление гексана
- Полное окисление – горение
- 5. Изомеризация гексана
- Получение гексана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
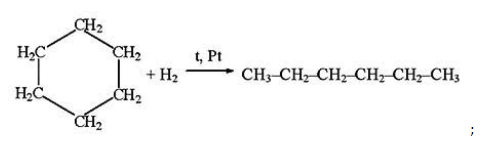
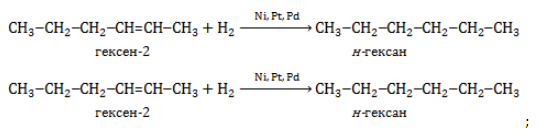
- 2. Гидрирование алкенов и алкинов
- 3. Синтез Фишера-Тропша
- 4. Получение гексана в промышленности
Изомеры гексана
Гексан является шестым членом гомологического ряда алканов. Существуют различные варианты строения молекулы – изомеры гексана. Структурные различия изомеров обусловливают разные свойства.
Формула и строение гексана
Как насыщенный углеводород, гексан характеризуется максимально возможным количеством водорода в молекуле. При этом все четыре валентности углеродных атомов задействованы в простых ковалентных связях.
Молекулярная формула гексана 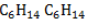
Наглядным примером может служить изомер с простейшим строением – н-гексан. Структурная формула нормального гексана имеет вид
Необходимо отметить, что она не отражает зигзагообразного пространственного расположения атомов в цепи 
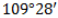
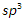
Цепь может принимать различные конформации за счет вращения вокруг простых 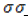
Изомерия гексана
Как представитель ряда алканов, гексан обладает структурной изомерией, обусловленной различиями в расположении звеньев углеродного скелета. Изомеры гексана отличаются друг от друга наличием или отсутствием в молекуле алкильных радикалов, их количеством и позицией.
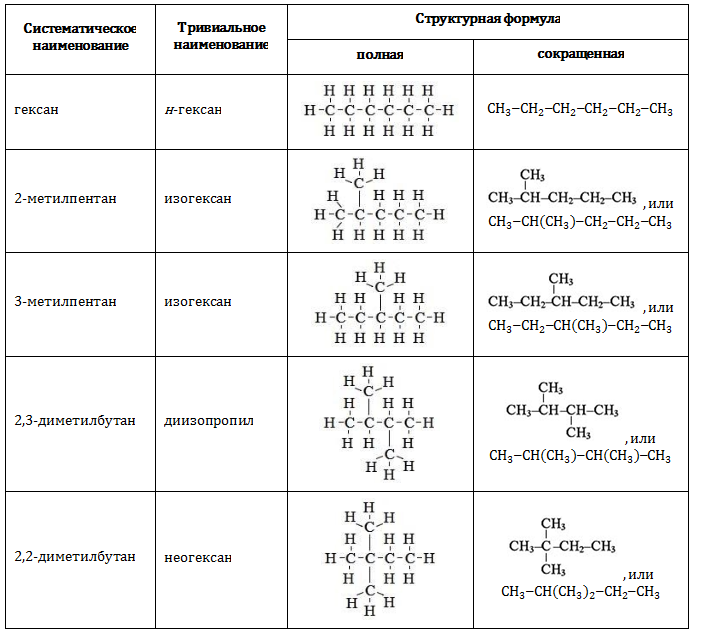
Существует всего пять изомерных соединений с составом 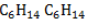
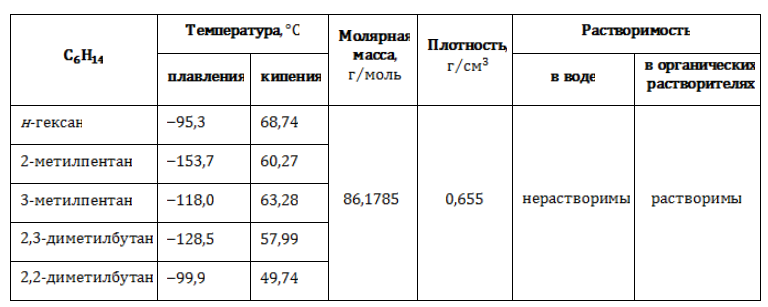
В таблице представлены полные и сокращенные структурные формулы всех возможных для гексана изомеров.
Свойства гексана
Вследствие структурных различий при одном и том же атомном составе изомеры представляют собой разные вещества, характеризующиеся неодинаковыми свойствами.
Физические свойства (таблица)
Все изомеры состава 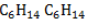
Химические свойства
Поскольку у алканов нет межклассовых изомеров, все вещества состава 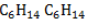
- неспособность к реакциям присоединения;
- участие в реакциях замещения:
- устойчивость к окислению при низких температурах;
- горючесть:
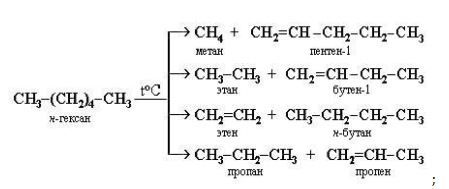
- разложение (крекинг) при энергичном термическом воздействии:
- способность к отщеплению водорода с образованием непредельных и циклических углеводородов:
Получение гексана
В промышленности гексан и его изомеры получают в процессах переработки нефтепродуктов:
- нормальный гексан – при прямой перегонке;
- изогексаны – при каталитическом разделении (крекинге).
Для лабораторных нужд используют следующие методы:
- гидрирование непредельных углеводородов:
- сшивание галогеналканов (синтез Вюрца):
Применение гексана
Различные изомеры состава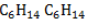
- В качестве компонентов топлива используются изомеры с наиболее разветвленной цепью – диметилгексаны (н-гексан ввиду склонности к детонации, наоборот, снижает качество бензина).
- В производстве ароматических углеводородов при нефтепереработке.
- Как растворитель гексан используется в органическом синтезе, хроматографии, при экстракции из натурального сырья растительных масел, в лакокрасочном производстве и нефтедобыче.
- При обработке порошковых материалов в нанотехнологии.
Заключение
Гексан – соединение, незаменимое во многих отраслях, однако работа с ним сопряжена с риском. Гексан отличается взрывоопасностью и высокой степенью воспламеняемости, обладает негативными биологическими (наркотическими) свойствами. Это токсичное соединение относится к умеренно опасным (третий класс) веществам.
При работе с гексаном и его изомерами необходимо соблюдение техники безопасности и правильное использование средств защиты (респираторов, перчаток) и оборудования.
Источник
Гексан: способы получения и химические свойства
Гексан C6H14 – это предельный углеводород, содержащий шесть атомов углерода в углеродной цепи. Бесцветная жидкость с характерным запахом, нерастворим в воде и не смешивается с ней.
Гомологический ряд гексана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение гексана
В молекулах алканов встречаются химические связи C–H и С–С.
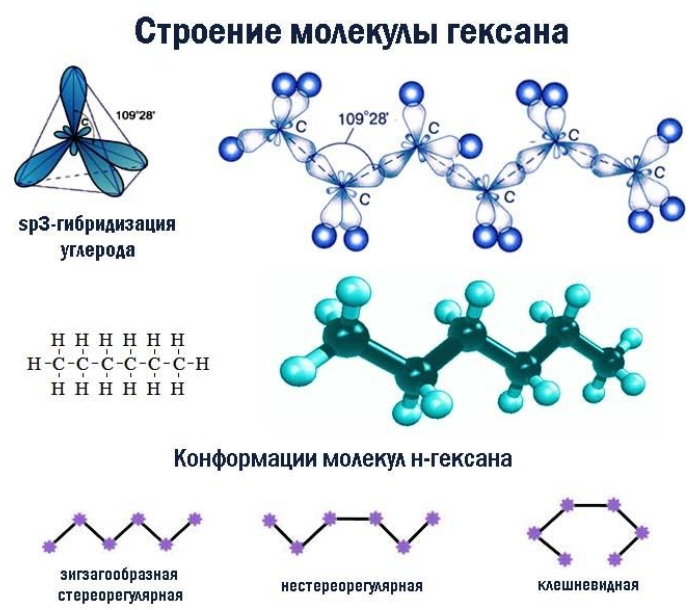
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :

При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:

При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:

Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:

Это соответствует тетраэдрическому строению.
| Например, в молекуле гексана C6H14 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение. |
Изомерия гексана
Структурная изомерия
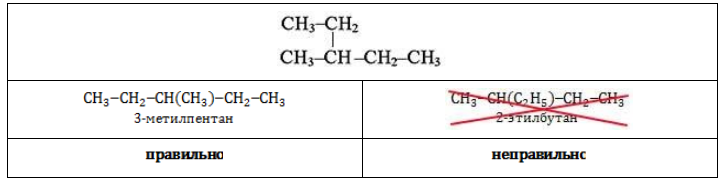
Для гексана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Для углеводородов состава С6Н14 существуют пять изомеров углеродного скелета: н-гексан, 2-метилпентан, 3 -метилпентан, 2,2-диметилбутан, 2,3-диметилбутан |
| Гексан | 2-Метилпентан |
| CH3-CH2-CH2-CH2-CH2-CH3 | CH3-CH(CH3)-CH2-CH2-CH3 |
Для пентана не характерна пространственная изомерия.
Химические свойства гексана
Гексан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для гексана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для гексана характерны радикальные реакции.
Гексан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Гексан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании гексана образуется смесь хлорпроизводных.
| Например, при хлорировании гексана образуются 1-хлоргексан, 2-хлоргексан и 3-хлоргексан: Бромирование протекает более медленно и избирательно.
|