- Этилен (этен), получение, свойства, химические реакции
- Этилен (этен), получение, свойства, химические реакции.
- Этилен (этен), формула, газ, характеристики:
- Физические свойства этилена (этена):
- Химические свойства этилена (этена):
- Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
- Применение и использование этилена (этена):
- Получение этилена лабораторным способом при нагревании
- Лабораторная работа «Получение этилена»
- 3. Подготовка к выполнению работы
- 4. Краткие теоретические сведения
- 5. Задание
- 6. Порядок выполнения работы
- 7. Содержание отчета
Этилен (этен), получение, свойства, химические реакции
Этилен (этен), получение, свойства, химические реакции.
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики:
Этилен (этен) – органическое вещество класса алкенов, состоящий из двух атомов углерода и четырех атомов водорода . Этилен имеет двойную углерод -углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов ), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Плохо растворяется в воде . Зато хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое гидрирование(восстановление)этилена:
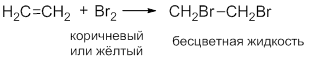
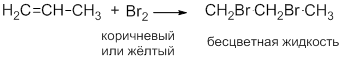
- 2. галогенирование этилена:
Однако при нагревании этилена до температуры 300 o C разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
- 3. гидрогалогенирование этилена:
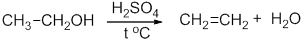
- 4. гидратация этилена:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
- 5. окисление этилена:
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
В результате образуется эпоксид.
В результате образуется ацетальдегид.
- 6. горение этилена:
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и вода .
- 7. полимеризация этилена:
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
- 1. каталитическое дегидрирование этана :
Этилен в лабораторных условиях получается в результате следующих химических реакций:
- 2. дегалогенирования дигалогенпроизводных этана:
- 3. неполное гидрирование ацетилена:
- 4. дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей:
Применение и использование этилена (этена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена , стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
Примечание: © Фото //www.pexels.com, //pixabay.com

как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
Источник
Получение этилена лабораторным способом при нагревании
Получение этилена и опыты с ним
Реактивы: этанол, серная кислота, бромная вода, раствор перманганата калия, речной песок.
Оборудование: штатив, спиртовка, пробирка с газоотводной трубкой, штатив с пробирками, фильтровальная бумага или вата, спички.
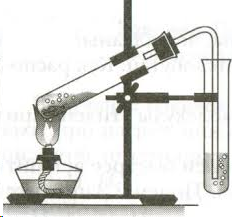
Схема установки:
Проведение эксперимента
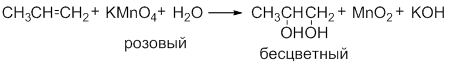
В пробирку налейте 3 мл этанола и осторожно добавьте и 9 мл серной кислоты. Затем добавьте немного сухого речного песка (на кончике чайной ложки). Песок обеспечит ровное кипение жидкости, без толчков и выбросов. Вставьте в пробирку пробку с изогнутой газоотводной трубкой. Приготовьте ещё две пробирки: в первую налейте 2-3 мл разбавленного раствора перманганата калия (розовый цвет), во вторую 2-3 мл раствора брома в воде (желто-коричневый цвет). Для получения этилена пробирку с этанолом и серной кислотой осторожно нагрейте в пламени спиртовки. Продолжая нагревание, опустите конец газоотводной трубки в пробирку с перманганатом калия (трубка должна находиться ниже уровня раствора). Пропускайте этилен до полного исчезновения розовой окраски. Смените пробирку и пропустите этилен через раствор бромной воды до полного обесцвечивания раствора брома. Уберите пробирку с обесцвеченным раствором. Протрите конец газоотводной трубки ватой или фильтровальной бумагой, поверните трубку вверх и подожгите выделяющийся газ. Обратите внимание на цвет пламени.
Реакция дегидратации этанола:
Обесцвечивание раствора Br2:
Исчезает окраска брома и образуется 1,2-дибромэтан.
Обесцвечивание водного раствора KMnO4 (без нагревания):
Исчезает окраска перманганата калия и образуется 1,2-этандиол (этиленгликоль).
Получение пропилена и опыты с ним
Пропилен получают аналогично этилену.
В пробирку помещают 3-4 мл изопропилового спирта и 9-12 мл серной кислоты. Осторожно нагревают. Выделяющийся газ пропускают через растворы бромной воды и перманганата калия, наблюдают исчезновение окраски растворов. Поджигают газ у конца газоотводной трубки.
Обесцвечивание раствора Br2:
Исчезает окраска брома и образуется 1,2-дибромпропан.
Обесцвечивание водного раствора KMnO4 (без нагревания):
Исчезает окраска перманганата калия и образуется 1,2-пропандиол (пропиленгликоль).
Источник
Лабораторная работа «Получение этилена»
Лабораторная работа №2
Тема: Получение этилена реакцией дегидратации этанола
Цель: Получить этилен путём нагревания смеси этилового спирта с концентрированной серной кислотой и изучить его свойства.
Оборудование: штатив с лапкодержателями, штатив с пробирками, пробка с газоотводной трубкой, спиртовка, прокаленный песок.
Реактивы: смесь этилового спирта с конц. серной кислотой (на 1 объем спирта 3 объема конц. серной кислоты), разбавленный раствор 2. Литература
1. Габриелян О,С. Химия: учеб для студ. сред. проф. учеб. заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2017. – 336с.
2. Габриелян О,С. Химия для профессий и специальностей технического профиля:
учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2017. – 256с.
3. Подготовка к выполнению работы
1. Получите у преподавателя сборник практических работ, оборудование и реактивы.
2. Ознакомьтесь с заданиями и порядком выполнения работы
3. Подготовьте рабочее место для выполнения работы
4. Краткие теоретические сведения
Углеводороды, содержащие в углеродной цепи одну или несколько кратных
(двойных или тройных) углерод-углеродных связей, называют непредельными . Термин «непредельный» означает, что атомы углерода не до предела насыщены атомами водорода и, как следствие, склонны к реакциям присоединения с образованием соединений предельного ряда.
Aлкенами (олефиновыми, этиленовыми) называют непредельные углеводороды с открытыми углеродными цепями, молекулы которых содержат одну двойную углеродуглеродную связь. Простейшим представителем алкенов является этилен СН2=СН2.
Физические свойства. При обычных условиях алкены состава С 2 Н 4 , С 3 Н 6 , С 4 Н 8 являются газообразными веществами без цвета и запаха ; углеводороды СnH2n, где n = 5 – 15 – бесцветные жидкости; при n 16 – твердые вещества . Алкены не растворимы в воде, однако могут растворяться в органических растворителях. Газообразные алкены образуют с воздухом взрывоопасные смеси.
Химические свойства алкенов. По химическим свойствам алкены коренным образом отличаются от алканов. Наличие в молекуле двойной углерод-углеродной связи обусловливает характерные свойства олефинов: реакции присоединения, окисления, полимеризации.
Алкены легко присоединяют молекулы хлора и брома с разрывом двойной связи и образованием дигалогенопроизводных:
Лабораторные способы получения алкенов. В лаборатории для получения алкенов используют реакции дегидратации спиртов и дегидрогалогенирования производных предельных углеводородов.
5. Задание
1. Ознакомьтесь с оборудованием и реактивами
2. Проведите опыты и наблюдения занесите в таблицу
3. Приведите рабочее место в порядок
6.  Порядок выполнения работы
Порядок выполнения работы
1. В сухую пробирку налейте 5мл смеси этилового спирта с. серной кислоты.
2. Всыпьте немного предварительно прокаленного песка, чтобы избежать толчков жидкости при кипении.
3. Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе (см. рис) и осторожно ее нагрейте.
4. В другую пробирку налейте 2-3мл. разбавленного раствора перманганата калия подкисленного серной кислотой и пропустите через него газ.
5. Подожгите выделяющийся газ.
6. Потушите спиртовку.
7. Содержание отчета
3. Выполнение эксперимента
4. Заполнение таблицы
5. Ответы на контрольные вопросы
1. Какой газ выделяется при нагревании смеси этилового спирта с серной кислотой?
2. Что происходит при пропускании газа через раствор перманганата калия?
3. Почему этилен горит более светящимся пламенем, чем метан. Напишите уравнения соответствующих реакций?
Источник











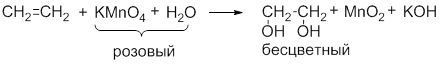
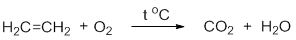



 Порядок выполнения работы
Порядок выполнения работы


