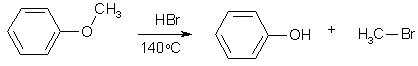Получение диэтилового эфира все способы
- Tweet
Методы получения эфира.
Этиловый эфир можно получать различными способами. Однако вследствие своей простоты и дешевизны преимущественное распространение получили способы, основанные на отнятии какими-либо водоотнимающими средствами (концентрированными серной и фосфорной кислотами, ароматическими сульфокислотами, а также некоторыми безводными солями) молекулы воды от двух молекул спирта по схеме:
2С2Н5ОН С2Н5ОС2Н5 + Н2О
Сернокислотный метод.
Как показали исследования Вильямсона (1851-1852 гг.), реакция образования эфира из спирта при помощи серной кислоты протекает в две фазы.
Сначала образуется сложный эфир спирта и серной кислоты:
ОН
СН3СН2ОН + SО2 Н2О + СН3СН2ОSО2 ОН,
ОН
называемый этилсерной кислотой. Этот продукт устойчив при умеренных температурах.
Дальнейший нагрев этилсерной кислоты до 140°С с избытком спирта ведет к ее разложению на серную кислоту и диэтиловый эфир:
ОН
СН3СН2ОSО2 ОН + СН3СН2ОН SО2 + СН3СН2ОСН3СН2
ОН
Если процесс проводить с самого начала при 140°С и вводить спирт в систему постепенно, то эфир отгоняется непрерывно, и теоретически процесс может продолжаться бесконечно. Однако в действительности кислота разбавляется водой и частично восстанавливается до сернистой кислоты, что обусловливает, в конечном итоге, прекращение процесса эфирообразования (эфиризации).
Сандерен нашел, что прибавление к реагирующей смеси сернокислого алюминия или свинца в количестве 5% от веса смеси значительно облегчает образование эфира, которое в этом случае происходит уже при 120°С.
Сернокислый алюминий действует при этом как катализатор, образуя промежуточную двойную соль этилсерной кислоты
(SO4)2Al2SO4HC2H5. Также действует сернокислый свинец.
Ведение процесса эфирообразования при избытке приливаемого к серной кислоте спирта обусловливает большую производительность и получение более чистого продукта.
При нагреве этилсерной кислоты выше 200°С происходит почти количественная её диссоциация по уравнению:
СН3СН2ОSО2 ОН СН2=СН2 + Н2SО4.
Если эфирообразование ведется без избытка спирта, некоторый распад этилсерной кислоты происходит и при более низких температурах (125-140°С).
При дегидратации, параллельно с образованием эфира, происходит частичное окисление спирта до ацетальдегида. Последний легко окисляется в уксусную кислоту:
СН3СНО + О2 2СН3СООН,
которая повышает кислотность образовавшегося продукта. При применении серной кислоты, содержащей соли железа, реакция окисления спирта идет более интенсивно.
При получении эфира, особенно из спирта-сырца, помимо альдегида образуется также и ряд других побочных продуктов, раскисляющих серную кислоту. Из них в первую очередь надо отметить: продукты осмоления уксусного альдегида, этилен, сернистый газ, сульфоновые кислоты и так называемое «винное масло». Последнее состоит из простых и сложных эфиров, кетонов и углеводородов. Удельный вес масла равен 0,9; оно кипит в пределах 150-200°С. Основная часть «винного масла» кипит при 150-170°С и содержит этиламиловый эфир, этиламиловый кетон и диэтилсульфаты.
Несмотря на загрязнение серной кислоты в процессе производства эфира, срок службы её довольно значителен.
Реакция образования эфира из этилового спирта экзотермична. Количество выделяющегося при 125°С тепла, найденное расчетным путем, равно 8,59 ккал/гмоль или 8590:74=116 ккал/кг. Теплота сгорания эфира при 15°С – 8910 ккал/кг.
ООО «Кузбассоргхим» производит эфир медицинский (ФСП 42-0473-4635-03) сернокислотным методом по реакции этерификации с последующей очисткой химическими растворами в соответствии с разработанным и утвержденным в установленном порядке промышленным регламентом на производство эфира медицинского ПР 43852015-02-2002. Существующий технологический процесс разработан НИИХП г. Казань для ПО «Прогресс» (п/я Р 6718, объект 430/416), входившего в состав оборонного комплекса, преемником которого в кадровой, технической и технологической политике с 1996 года является ООО «Кузбассоргхим». Год ввода в эксплуатацию производства эфира медицинского 1976, мощность производства 1350 тонн. Способ производства эфира медицинского ООО «Кузбассоргхим» за это время был оптимизирован в части усовершенствования способов очистки, но значительных изменений в технологии изготовления эфира диэтилового не произошло.
| Источник: | Собственная информация |
| Учетная запись: | Кузбассоргхим,ООО |
| Дата: | 16.04.10 |
При регистрации сайта Вы получаете пароль для управления сайтом, который подходит для входа в личный кабинет — зарегистрироваться
Источник
Получение диэтилового эфира все способы
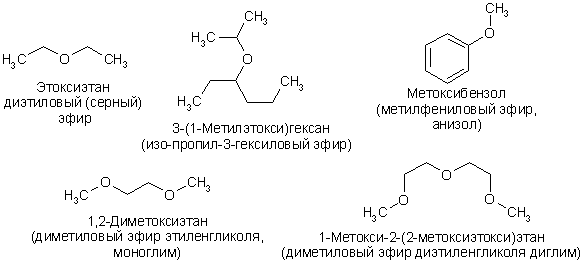
Простые эфиры представляют собой соединения, в которых два углеводородных радикала связаны атомом кислорода. Систематическая номенклатура рассматривает простые эфиры как производные алканов, например диэтиловый эфир следует называть этоксиэтаном, анизол метоксибензолом. По рациональной номенклатуре названия простых эфиров составляют по именам с добавлением слова «эфир»: диэтиловый эфир, метилэтиловый эфир, дифениловый эфир. Применяется «оксидная» номенклатура: дифенилоксид = дифениловый эфир, иногда используются тривиальные названия: диэтиловый эфир = серный эфир (по способу получения) или просто эфир, анизол (метилфениловый эфир), фенетол (этилфениловый эфир).
Для циклических эфиров номенклатурой IUPAC зарегистрированы тривиальные названия, например:
Получение простых эфиров
Простые эфиры образуются из спиртов при действии кислот, обладающих водоотнимающими свойствами, таких как H2SO4 или полифосфорная кислота.
Реакция Уильямсона открывает более широкие возможности, т.к. позволяет синтезировать несимметричные эфиры.
Эта реакция стала интенсивно использоваться для синтеза открытых в 60-е годы краун-эфиров.
Свойства простых эфиров
Химические свойства простых эфиров обусловлены присутствием атома кислорода, связанного с двумя С-атомами. Две несвязывающих пары электронов кислорода обусловливают основность (по Льюису) простых эфиров. Низшие представители сравнительно неплохо растворимы в воде (водородные связи), с сильными кислотами они образуют гидроксониевые соли. Поэтому диэтиловый эфир растворим в концентрированной соляной кислоте и выделяется при разбавлении раствора водой.
Кислоты Льюиса с простыми эфирами дают солеобразные оксониевые соединения, которые называют эфиратами. Кислота и основание связаны донорно-акцепторной связью.
Комплексы эфиров с трифторидом бора весьма стабильны и в синтетических целях, к примеру, удобным реагентом является эфират трифторида бора: сам BF3 при комнатной температуре представляет собой газообразное вещество, диэтиловый эфир кипит при 34.5 °С, тогда как их комплекс перегоняется без разложения при 129 °С.
Несмотря на полярность связи С-О в молекулах простых эфиров (m=1,6D), они не реагируют с нуклеофилами. Вероятно, это обусловлено тем, что в ходе расщепления должно было бы произойти вытеснение нуклеофилом более сильного основания – алкоголят-иона (плохая уходящая группа). Напротив, в сильнокислой среде, где плохая уходящая группа алкоксид-ион превращается в хорошую уходящую группу (молекулу спирта), простые эфиры расщепляются действием сильных нуклеофилов. Так, эфиры расщепляются до соответствующего спирта и алкилгалогенида под действием HBr или HI (но не HCl):
Простые эфиры легко вступают реакции свободно-радикального замещения по α-углеродному атому. Так, получение хлордиэтилового эфира ведут действием хлора на эфир при -20 °С.
Столь легкое замещение при α-С-атоме объясняют тем, что в результате отрыва атома водорода возникает радикальная частица, стабилизированная за счет нахождения неспаренного электрона в поле атома кислорода («три электрона в поле двух атомов»).
Это же обстоятельство является причиной легкости окисления простых эфиров кислородом воздуха по свободно-радикальному механизму. Вследствие этого пары эфиров образуют с воздухом взрывчатую смесь, а во время хранения эфира в нем накапливаются гидропероксиды, которые, благодаря более высокой температуре кипения, остаются в перегонной колбе и в конце перегонки могут взрываться. Поэтому эфиры перед перегонкой обрабатывают раствором солей двухвалентного железа либо твердой щелочью.
В то же время простые эфиры очень устойчивы к действию других окислителей, сильных кислот (кроме HBr и HI) и оснований, в т.ч. металлоорганических соединений, и поэтому широко используются в лабораторной практике в качестве растворителей, особенно это касается диэтилового эфира, ТГФ, диоксана и глимов.
α-Хлорзамещенные эфиры вступают как очень активные электрофилы в реакции нуклеофильного замещения хлора по мономолекулярному механизму с различными реагентами цианид-, иодид-, ацетат-ионом. Этилхлорметиловый эфир гидролизуется в 1 · 10 9 раз быстрее трет-бутилхлорида по механизму SN1, а метилхлорметиловый эфир лишь в 400 раз быстрее, чем хлорэтан, по SN2-механизму. Предпочтительность SN1-механизма легко объясняется резонансной стабилизацией карбокатиона.
Источник
Получение, физические и химические свойства простых эфиров
Некоторые способы получения простых эфиров были рассмотрены при изучении галогеналканов, алкенов, одноатомных спиртов. В данном разделе подробнее рассмотрим получение, физические и химические свойства простых эфиров .
Получение простых эфиров
- Реакция Вильямсона – взаимодействие галогенированных углеводородов с алкоголятами:
При этом способе получения используются первичные реагирующие соединения.
- Межмолекулярная дегидратация спиртов протекает под действием окиси алюминия и температуре 300°С или серной кислоты как дегидратирующего агента. В результате получают симметричные простые эфиры, например, по этому принципу получают серный эфир (диэтиловый эфир):
Его получение происходит в 2 стадии. Сначала, при взаимодействии этанола с избытком серной кислоты, получается этилсерная кислота, которая, затем реагирует с новой порцией этанола с образованием диэтилового эфира:
- Каталитическое присоединениеспиртов к олефинам или алкинам:
При присоединении спиртов к алкинам образуются виниловые эфиры:
- Оксимеркурирование алкенов протекает в несколько стадий. Сначала при действии на алкены ацетата ртути в водном растворе тетрагидрофурана (ТГФ) или в водной уксусной кислоте при 20°С образуется ртутьорганические соединения. При этом присоединение ацетата ртути к алкену происходит согласно правилу Марковникова. Далее при воздействии таких растворителей как спирты, уксусная кислота, ацетонитрил и др. получаются простые эфиры:
Физические свойства
Простые эфиры — это прозрачные бесцветные жидкости, обладающие характерным «эфирным» запахом. Они являются легколетучими и пожароопасными.
Растворимость простых эфиров
Простые эфиры растворимы в протонных кислотах, что связано с основными свойствами эфирного кислорода. Этот кислород имеет две свободные электронные пары, которые не могут использоваться для проявления обычной валентности и принять электроны. Однако для осуществления связи кислород может предоставить свою электронную пару в общее пользование:
В зависимости от строения эфира, они могут иметь хорошую растворимость в воде или вовсе не растворяться (см. таблицу ниже). В большинстве органических растворителей простые эфиры хорошо растворимы.
Точки плавления и кипения простых эфиров
Простые эфиры кипят при гораздо более низких температурах, чем соответствующие спирты. Например, метиловый спирт кипит при +65°С, а метиловый эфир – при -23,7°С. Это связано с тем, что эфиры, в отличие от спиртов, лишены гидроксильного водорода и поэтому не имеют возможности образовывать водородные связи, объединяющие одну молекулу с другой. Т.е. простые эфиры не способны к ассоциации молекул.
Химические свойства простых эфиров
Простые эфиры – малореакционноспособная группа органических соединений, проявляющие слабоосновные свойства. Они могут расщепляются лишь некоторыми веществами при нагревании (концентрированной йодистоводородной кислотой или воздействием металлического натрия). Водные растворы кислот и щелочей не действуют на простые эфиры.
- Образование оксониевых солей при воздействии сильных кислот:
- Образование комплексных соединений с солями (Меервейн Г.Л.):
- Расщепление простых эфиров:
Под действием концентрированных йодоводородной или бромоводородной кислот:
Под действием активных металлов при повышенной температуре (Шорыгин П.П.):
Под действием серной кислоты:
- Окисление простых эфиров происходит с образованием перекисных соединений (автоокисление):
Простые эфиры при хранении легко окисляются кислородом воздуха с образованием перекисей. При использовании простых эфиров, особенно при перегонке их необходимо хорошо очистить от накопленных перекисей, которые могут стать причиной взрыва.
Источник