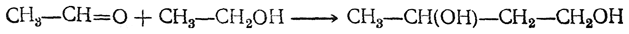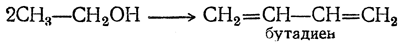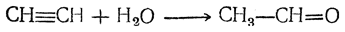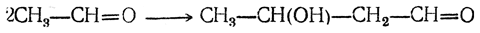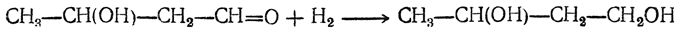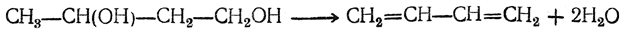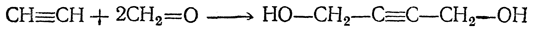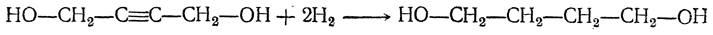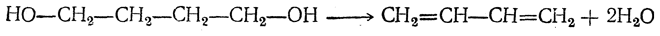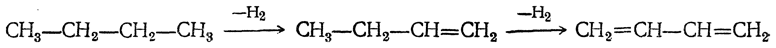- Получение алкадиенов
- Получение алкадиенов
- 1. Дегидрирование алканов
- 2. Синтез Лебедева
- 3. Дегидратация двухатомных спиртов
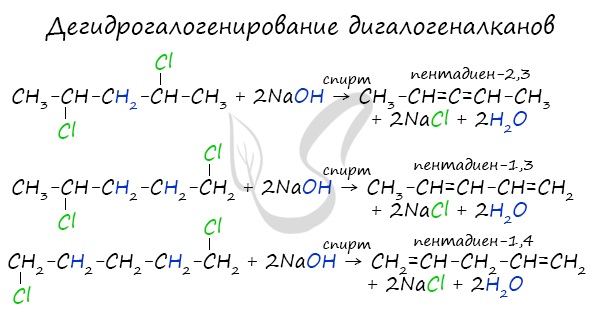
- 4. Дегидрогалогенирование дигалогеналканов
- Бутадиен-1,3, или дивинил
- Алкадиены
- Алкадиены
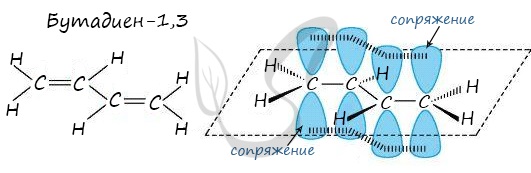
- Строение алкадиенов
- Строение сопряженных алкадиенов
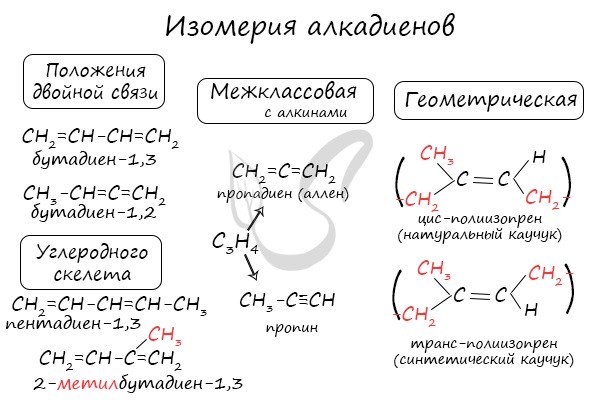
- Изомерия алкадиенов
- Структурная изомерия
- Пространственная изомерия
- CH2=CH–CH=CH2
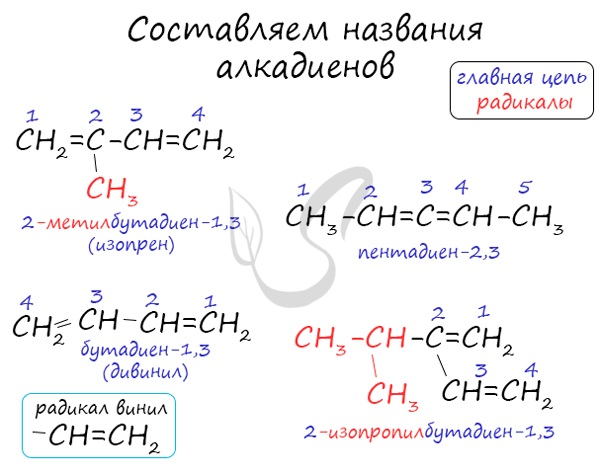
- Номенклатура алкадиенов
- Химические свойства сопряженных алкадиенов
- 1. Реакции присоединения
- 1.1. Гидрирование алкадиенов
- 1.2. Галогенирование алкадиенов
- 1.3. Гидрогалогенирование алкадиенов
- 1.5. Полимеризация
- 2. Окисление алкадиенов
- 2.1. Мягкое окисление алкадиенов
- 2.2. Жесткое окисление
- 2.3. Горение алкадиенов
- Получение алкадиенов
- 1. Дегидрирование алканов
- 2. Синтез Лебедева
- 3. Дегидратация двухатомных спиртов
- 4. Дегидрогалогенирование дигалогеналканов
Получение алкадиенов
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):

Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
Н агревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
Источник
Бутадиен-1,3, или дивинил
Бутадиен-1,3, или дивинил, СН2=СН—СН=СН2 представляет собой газ, конденсирующийся при —4,5° С. Вследствие громадного технического значения бутадиена-1,3 как одного из важнейших исходных мономеров для производства синтетических каучуков было разработано много способов его получения, в том числе и промышленных.
Бутадиен образуется при термическом разложении различных органических веществ; в небольших количествах содержится в газах, получаемых пиролизом нефтепродуктов и каменного угля. Он может быть получен пиролизом циклогексана и других углеводородов нефти, пиролизом циклогексанола, дегидратацией 1,3-бутиленгликоля, а также конденсацией альдегида и спирта в присутствии глинозема как катализатора (И. И. Остромысленский). В последнем случае, вероятно, промежуточно образуется 1,3-бутиленгликоль
который сразу же дегидратируется. Другой способ получения бутадиена из спирта состоит в окислении этанола в ацегальдегид, который конденсируют в альдоль; восстановление альдоля дает 1,3-бутиленгликоль.
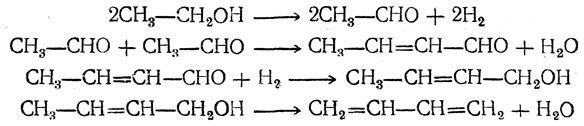
Первым технически целесообразным путем получения бутадиена из спирта является способ С. В. Лебедева, впервые осуществленный в промышленных масштабах в СССР в 1932 г. и в дальнейшем получивший широкое распространение. По С. В. Лебедеву спирт непосредственно превращается в бутадиен при пропускании его паров при 400—500° С над катализатором, обладающим одновременно дегидрирующим и дегидратирующим действием. Суммарно процесс выражается уравнением
Вероятно, механизм этой реакции (М. Я. Каган, Ю. Д. Горин) таков:
Можно получать дивинил, в том числе и в промышленном масштабе, на основе ацетилена. Более старый метод синтеза из ацетилена может быть представлен следующей схемой:
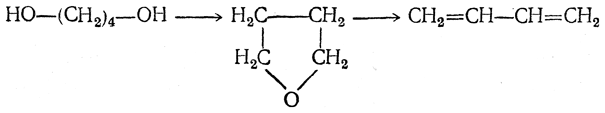
Позднее был предложен следующий путь: 1. Получение 1,4-бутиндиола конденсацией ацетилена и формальдегида (с Сu2Сl2 в качестве катализатора):
2. Гидрирование 1,4-бутиндиола в 1,4-бутандиол:
3. Дегидратация 1,4-бутандиола в дивинил либо непосредственно
либо с промежуточным выделением тетрагидрофурана
В настоящее время самым эффективным методом получения дивинила является каталитическое дегидрирование природного бутана, а также бутиленов, содержащихся в газах термической переработки нефти. Реакция проводится над различными алюмо-хромовыми катализаторами при 500—650° С. В зависимости от применяемых катализаторов бутан может быть превращен в бутадиен либо сразу, либо в две стадии
причем для каждой стадии требуются свои катализаторы и условия реакции. Эти методы, разрабатывавшиеся одновременно в СССР и в США, в настоящее время осуществляются как промышленные.
Хлорпроизводное дивинила — 2-хлорбутадиен-1,3, или хлоропрен, СН2—СН—ССl=СН2 может быть получен присоединением молекулы хлористого водорода к винилацетилену, получаемому при пропускании ацетилена через солянокислые растворы медных солей. Хлоропрен — жидкость с характерным эфирным запахом, несколько напоминающим запах бромистого этила; т. кип. 59,4°С, относительная плотность 0,9533 (при 20°С). Подобно дивинилу, но значительно легче, хлоропрен полимеризуется в каучукоподобные вещества — синтетические каучуки, выпускаемые в СССР под названием наирит, а в США — под названием неопрен.
Полихлоропреновые каучуки обладают рядом ценных физико-химических свойств — стойкостью к атмосферным воздействиям, к солнечному свету, к различным маслам и химическим агентам, а также негорючестью, благодаря чему они нашли очень широкое применение.
Источник
Алкадиены
Алкадиены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С. Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда — пропадиен — CH2=C=CH2. Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкадиенов
Названия алкенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В зависимости от того, как чередуются двойные связи в молекуле алкадиена, они подразделяются на следующие типы:
- Кумулированные двойные связи
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
Пример — пропадиен-1,2 (аллен) — CH2=C=CH2
В молекуле аллена крайние атомы углерода находятся в состоянии sp 2 -гибридизации, а центральный атом — sp-гибридизации.
Сопряженные двойные связи
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).
Изолированные двойные связи
В случае, если две двойные связи разделены двумя и более одинарными связями.
Получение алкадиенов
Алкадиены получают несколькими способами:
- Дегидрогалогенирование дигалогеналканов
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта.
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.
В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора.
Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны. Наличие сопряженных двойных связей увеличивает реакционную способность молекулы и обуславливает необычный механизм некоторых реакций.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
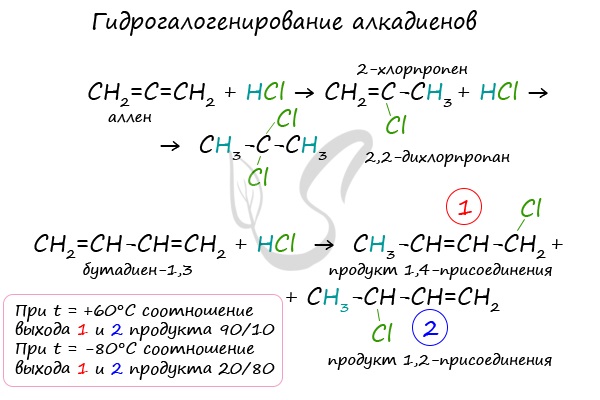
В случае, если двойные связи находятся в сопряжении, выход продуктов во многом зависит от температуры. Например, в ходе галогенирования бутадиена-1,3 при -80°C преимущественно получается продукт 1,2-присоединения, а при +60°C — продукт 1,4-присоединения.
Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.
При горении алкадиены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление.
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Алкадиены
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение алкадиенов
Свойства алкадиенов определяются их строением и взаимных расположением двойных связей в молекуле.
Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4:
Изолированные алкадиены проявляют свойства алкенов.
Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода.
Например , пропадиен:
Кумулированные алкадиены неустойчивы.
Сопряженные двойные связи разделены одной σ-связью С-С.
Например , бутадиен-1,3:
Сопряженные алкадиены обладают характерными свойствами, которые отличаются от свойств алкенов.
Строение сопряженных алкадиенов
Молекула бутадиена-1,3 содержит четыре атома углерода в sp 2 —гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.
Это соответствует плоскому строению молекулы бутадиена-1,3.
| Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей. |
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Аналогичное устроены и другие сопряженные алкадиены.
Например , 2-метилбутадиен-1,3:
Сопряжение в молекуле алкадиенов можно также схематично изобразить так:
Изображение с сайта orgchem.ru
Изомерия алкадиенов
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратных связей и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры положения двойных связей отличаются положением двойных связей.
| Например. Изомеры положения двойных связей с формулой С6Н10 — гексадиен-1,3 и гексадиен-2,4 |
| Гексадиен-1,3 |
| Например. Межклассовые изомеры с общей формулой С4Н6 — бутадиен-1,3, бутин-1, циклобутен |
| Бутадиен-1,3 | Бутин-1 | Циклобутен |
 |  |  |
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Изомеры углеродного скелета, которые соответствуют формуле С5Н8 — пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен) |
| Пентадиен-1,3 | 2-Метилбутадиен-1,3 |
 |  |
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| цис-Алкадиен |
| Например. Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода) |
CH2=CH–CH=CH2
Номенклатура алкадиенов
В названиях алкадиенов для обозначения двух двойных связей используется суффикс -ДИЕН.
| Например, алкадиен имеет название бутадиен-1,3. |
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
| Тривиальное название | Формула алкадиена |
| Дивинил |  |
| Изопрен |  |
Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
| Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей. |
1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
| Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода. |
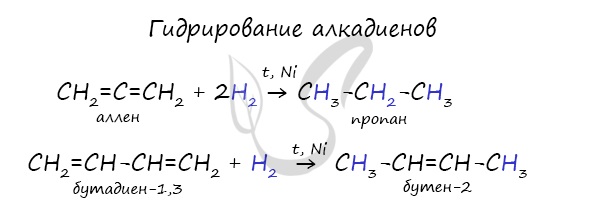
1.1. Гидрирование алкадиенов
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
| При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2). |
При полном гидрировании дивинила образуется бутан:
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2: |
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:

1.3. Гидрогалогенирование алкадиенов
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком. |
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
При полимеризации изопрена образуется природный (натуральный) каучук:
2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
| Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь. |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
| Например, уравнение сгорания бутадиена: |
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):

Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
Н агревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
Источник