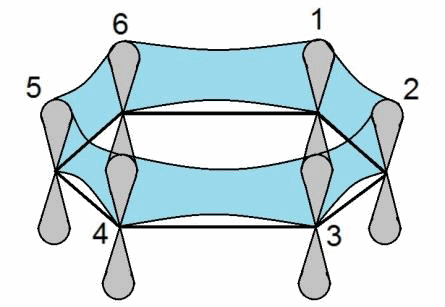
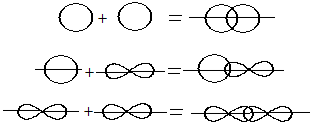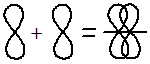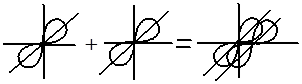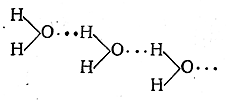Способы перекрывания электронных облаков



1. Вдоль межъядерной оси – сигма связь (σ)
2. По обе стороны от межъядерной оси – за счёт бокового перекрывания орбиталей — Пи-связь (π)
Перекрывание электронных облаков над и под линией, соединяющей ядра атомов, осуществляется за счёт так называемой π – связи. Если d – электронные облака, расположенные в параллельных плоскостях, перекрываются всеми четырьмя лепестками, то такую связь называют дельта связью (δ). В молекулах с двойной и тройной связью имеются и σ — и π – связи.
Следует различать понятия «полярность связи» и «полярность молекулы». Например, и σ- и π- связь С=О полярны, а молекула СО2 неполярна, т.к. суммарный дипольный момент молекулы равен нулю.
Ионная связь.Такой тип химической связи возникает только при взаимодействии атомов, которые сильно отличаются по электроотрицательности, т.е. между типичными металлами и типичными неметаллами.
При химическом взаимодействии типичные металлы, имеющие на внешнем энергетическом уровне 1 – 2 электрона, отдают их атому неметалла, который приобретает завершённый энергетический уровень и превращается в отрицательно заряжённый ион, а атом, отдавший электроны – в положительно заряженный ион. Например NaCl:
Na 0 1s 2 2s 2 2p 6 3s 1 — e → Na + 1s 2 2s 2 2p 6 3s 0
Сl 0 1s 2 2s 2 2p 6 3s 2 3p 5 + е → Сl ¯ 1s 2 2s 2 2p 6 3s 2 3p 6
Между образовавшимися ионами осуществляется электростатическое взаимодействие, приводящее к образованию химического соединения. Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной или электровалентной связью.
Соединения, которые образовались за счёт притяжения ионов, называются гетерополярными или ионными. Ионные соединения состоят из молекул только в парообразном состоянии.
Ионная связь в отличие от ковалентной характеризуется ненаправленностью в пространстве и ненасыщаемостью. Квантово — механическая теория валентности указывает, что резкого различия между ионной и ковалентной полярной связью не существует. Ионная связь это предельный случай полярной ковалентной связи.
Металлическая связь – сильно делокализованная химическая связь. Возникает в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, валентные электроны слабо удерживаются ядром из – за малой энергии ионизации. Наличие в металле так называемых свободных электронов (электронного газа) характеризует многие общие для всех металлов свойства: металлический блеск, теплопроводность и электрическую проводимость.
Свободные электроны связывают друг с другом ионы.
Данный вид связи характерен для металлов и их сплавов, а так же для интерметаллических соединений, она ненасыщенна и ненаправлена.
Водородная связь. Межмолекулярное взаимодействие может осуществляться не только за счёт донорно – акцепторных связей, но и за счёт сил Ван-дер-Ваальса (дисперсионного, ориентационного и индукционного взаимодействия) и водородной связи. Водородная связь обусловлена тем, что атом водорода, химически связанный в одной молекуле с атомом высокой элктроотрицательностью (например, фтора, кислорода) может соединиться ещё с атомом этого же элемента из другой молекулы. Водородную связь обозначают пунктиром
Водородная связь менее прочна чем обычная химическая связь, но оказывает влияние на многие свойства веществ. Различают межмолекулярную водородную связь и внутримолекулярную.
Контрольные задания.
99-118. Укажите тип химической связи в молекулах соединений вашего варианта. Составьте электронные схемы образования молекул с ковалентной связью. Электроны каких орбиталей атомов принимают участие в образовании ковалентной связи? Определите валентность и степени окисления атомов в молекуле. Изобразите электронными уравнениями процессы образования ионов из атомов для соединений с ионной связью.
Источник
Лекция по химии №3
Лекция по общей химии №3
Конспект лекции по общей химии составлен в соответствии с программой учебной дисциплины Химия, которая является частью программы среднего (полного) общего образования, реализуемого в рамках СПО с учетом профиля получаемого профессионального образования.
Конспект лекций по органической химии предназначен для использования учащимися с целью самостоятельного изучения предмета, коррекции знаний, при повторении и подготовке к итоговой контрольной работе.
Тема: Химическая связь – ионная и ковалентная.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
1.Ионная химическая связь
Ионная химическая связь – это связь, образовавшаяся за счет электростатического притяжения катионов к анионам .
Атомы, присоединившие «чужие» электроны, превращаются в отрицательные ионы, или анионы . Атомы, отдавшие свои электроны, превращаются в положительные ионы, или катионы . Понятно, что между анионами и катионами возникают силы электростатического притяжения, которые и будут удерживать их друг около друга, осуществляя тем самым ионную химическую связь.
Так как катионы образуют в основном атомы металлов, а анионы – атомы неметаллов, логично сделать вывод, что этот тип связи характерен для соединений типичных металлов (элементы главных подгрупп I и II групп, кроме магния Mg и бериллия Be ) с типичными неметаллами (элементы главной подгруппы VII группы). Классическим примером является образование галогенидов щелочных металлов (фторидов, хлоридов и др.). Например, рассмотрим схему образования ионной связи в хлориде натрия:
Два разноименно заряженных иона, связанные силами притяжения, не теряют способности взаимодействовать с противоположно заряженными ионами, вследствие чего образуются соединения с ионной кристаллической решеткой. Ионные соединения представляют собой твердые, прочные, тугоплавкие вещества с высокой температурой плавления.
Растворы и расплавы большинства ионных соединений – электролиты. Такой тип связи характерен для гидроксидов типичных металлов и многих солей кислородсодержащих кислот. Однако при образовании ионной связи не происходит идеального (полного) перехода электронов. Ионная связь является крайним случаем ковалентной полярной связи
Кристаллическая решетка хлорида натрия, состоящая из противоположно заряженных ионов натрия и хлорид-ионов
В ионном соединении ионы представлены как бы в виде электрических зарядов со сферической симметрией электрического поля, одинаково убывающего с увеличением расстояния от центра заряда (иона) в любом направлении (рис. 1). Поэтому взаимодействие ионов не зависит от направления, то есть ионная связь, в отличие от ковалентной, будет ненаправленной.
Ионная связь существует также в солях аммония, где нет атомов металлов (их роль играет катион аммония 
2. Ковалентная химическая связь
Ковалентная химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
Механизм образования такой связи может быть обменный или донорно-акцепторный.
Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов.
Связь возникает благодаря образованию общей электронной пары s -электронами атомов водорода (перекрыванию s -орбиталей):
Связь возникает за счет образования общей электронной пары из s — и p -электронов (перекрывания s – p -орбиталей):
Cl 2 – в молекуле хлора ковалентная связь образуется за счет непарных p -электронов (перекрывания p – p -орбиталей):
N 2 – в молекуле азота между атомами образуются три общие электронные пары:
По способу перекрывания электронных орбиталей различают σ- и π-ковалентные связи (сигма- и пи-) .
В молекуле азота одна общая электронная пара образуется за счет σ-связи (электронная плотность находится в одной области, расположенной на линии, соединяющей ядра атомов; связь прочная).
Две другие общие электронные пары образуются за счет π-связей, то есть бокового перекрывания p -орбиталей в двух областях; π-связь менее прочна, чем σ-связь.
В молекуле азота между атомами существует одна σ-связь и две π-связи, которые находятся во взаимно перпендикулярных плоскостях (так как взаимодействуют 3 неспаренных p -электрона каждого атома).
Следовательно, σ-связи могут образовываться за счет перекрывания электронных орбиталей:
а также за счет перекрывания «чистых» и гибридных орбиталей .
По числу общих электронных пар, связывающих атомы, то есть по кратности , различают ковалентные связи:
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть неполярной и полярной. При неполярной ковалентной связи общие электронные пары не смещены ни к одному из атомов, так как эти атомы имеют одинаковую электроотрицательность (ЭО) – свойство оттягивать к себе валентные электроны от других атомов.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью , называют неполярной .
то есть посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов.
Значения относительной электроотрицательности фосфора и водорода практически одинаковы: ЭО ( Н ) = 2,1; ЭО ( Р ) = 2,1, поэтому в молекуле фосфина PH 3 связи между атомом фосфора и атомами водорода ковалентные неполярные.
Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной .
Азот – более электроотрицательный элемент, чем водород, поэтому общие электронные пары смещаются к его атому.
Источник
По способу перекрывания электронных облаков различают
Часто химические связи образуются за счёт электронов, расположенных на разных атомных орбиталях. Казалось бы, и связи в молекуле по прочности должны быть неравноценными. Однако опыт показывает, что они равнозначны. Это явление объясняется представлением о гибридизации атомных орбиталей, введённым американским химиком Л. Полингом.
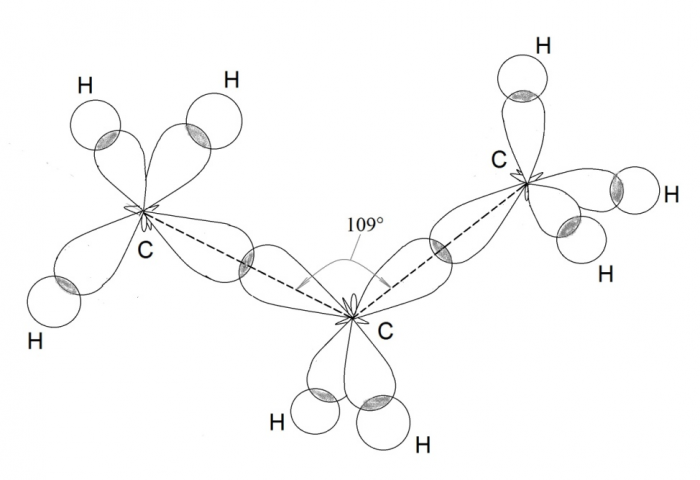
Рассмотрим образование молекулы метана. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя р-электронами – 1s 2 2s 1 2p 3 . Экспериментальные данные показали, что все четыре связи С-Н в молекуле метана СН4 одинаковы и направлены к вершинам тетраэдра (угол между ними составляет 109 о 28′).
Одинаковая прочность связей объясняется гибридизацией валентных (внешних) орбиталей, то есть смешением их и выравниванием по форме и энергии. При этом число гибридных орбиталей равно числу исходных.
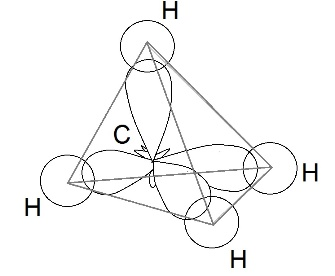 |
Четыре совершенно одинаковые sp 3 –гибридные орбитали атома углерода расположены под углом 109 о 28′ друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода. На рисунке видно, что гибридная орбиталь асимметрична и сильно вытянута по одну сторону от ядра.
Это обусловливает более сильное перекрывание гибридных орбиталей с орбиталями других атомов по сравнению с перекрыванием «обычных» s- и р-орбиталей и приводит к образованию более прочных связей.
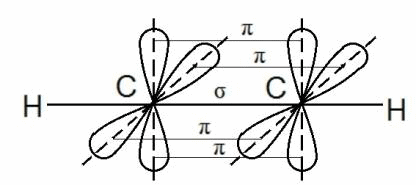
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры атомов, называется σ (сигма) – связью.
Так как гибридные электронные орбитали направлены к вершинам тетраэдра, то при образовании молекулы пропана С3Н8 направление химической связи между вторым и третьим атомами углерода не может совпадать с направлением связи между первым и вторым атомами углерода. Образуется угол 109 о 28′. Такие же углы существуют между четвертым, пятым и другими атомами углерода. Углеродная цепь принимает зигзагообразную форму:
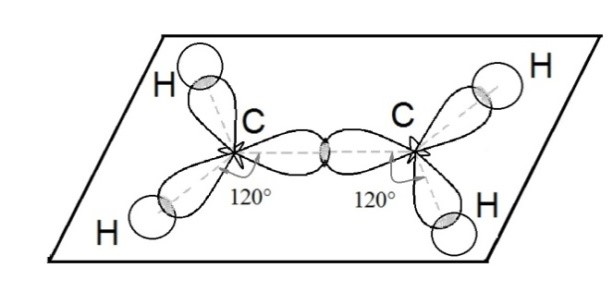
Ещё один вид гибридизации осуществляется в соединениях углерода ряда этилена. В этом случае происходит гибридизация одной s- и двух р-орбиталей углерода (sp 2 –гибридизация). При этом образуются три одинаковые sp 2 –гибридные орбитали, расположенные под углом 120 о друг к другу. Таким образом каждый атом углерода имеет по три гибридных электронных облака и по одному негибридному р-облаку. Гибридные электронные облака взаимно перекрываются и образуют между атомами углерода σ –связь:
Остальные гибридные электронные облака атомов углерода перекрываются с s-облаками атомов водорода и также образуют σ -связи. Негибридные p-орбитали взаимно перекрываются в плоскости, которая расположена перпендикулярно плоскости σ-связей:
Ковалентная связь, возникающая при перекрывании орбиталей по обе стороны линии, связывающей центры атомов, называется π (пи) – связью.
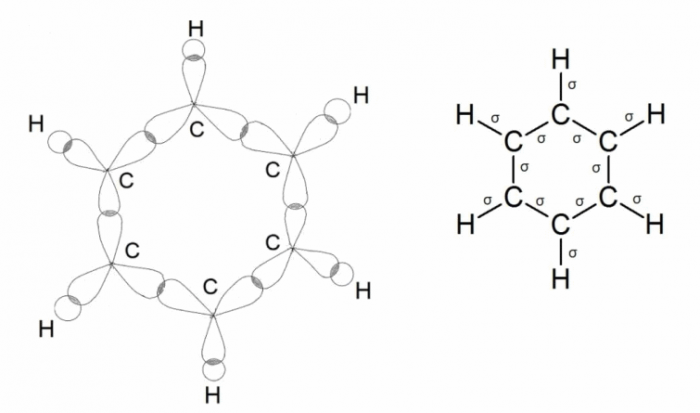
Ещё одним примером, где происходит sp 2 –гибридизации углерода, является молекула бензола. Три атомные орбитали (одна s и две р) каждого углерода в молекуле бензола гибридизируются и образуют три σ -связи. Гибридные орбитали перекрываются друг с другом. Перекрывание всех электронных облаков на одном рисунке показать трудно, поэтому рассмотрим последовательно два рисунка. Ниже приведены схема образования σ -связей в молекуле бензола:
Негибридные р-электронные орбитали атомов углерода расположены перпендикулярно плоскости направления σ-связей, они также перекрываются друг с другом, образуя единую систему π-связей:
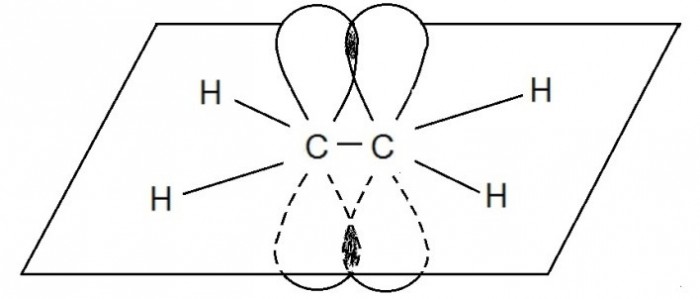
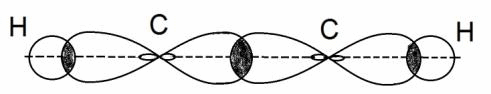
В молекуле ацетилена С2Н2 каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180 о друг к другу. Они, как уже упоминалось выше, называются σ — связями.
Но в молекуле ацетилена в каждом из атомов углерода содержится ещё по два p-электрона, которые не принимают участие в образование σ – связей. Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р-электронных облака в каждом из атомов выступают из плоскости в перпендикулярном к ней направлении. При этом происходит некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании σ – связей. В итоге в молекуле ацетилена образуются ещё две ковалентные углерод-углеродные π-связи:
Под воздействием реагентов π-связь легко разрывается, она значительно слабее, чем σ–связь. π –связь образуется не только между атомами углерода, но и в случае образования двойных и тройных связей между углеродом и кислородом, углеродом и азотом.
Источник