По каким способом можно определить температуру горения
5.2. ТЕОРЕТИЧЕСКАЯ ТЕМПЕРАТУРА ГОРЕНИЯ
Температура горения любого вещества не является постоянной величиной. Она зависит от условий горения (в замкнутом объеме или на открытом воздухе), от условий теплоотдачи, полноты сгорания топлива, коэффициента избытка воздуха и других факторов.
Для сравнения температуры горения Тг разных веществ расчет ведется при строго одинаковых следующих условиях.
· Горючее и воздух вступают в реакцию горения при температуре Т = 0 ° С.
· Количество воздуха равно теоретически необходимому, то есть коэффициент избытка воздуха α=1.
· Горение происходит мгновенно до полного окисления (СО2, Н2О, SO 2) без образования промежуточных продуктов неполного горения (например, угарного газа СО).
· Вся выделенная теплота сообщается продуктам горения и расходуется исключительно на их нагревание.
Рассчитанная при этих условиях температура называется теоретической. Практически реализуемая температура горения T (при пожарах, при горении в печах, каминах, камерах сгорания и других технических устройствах) всегда ниже теоретической T г. Это связано с тем, что реальный процесс горения происходит с избытком воздуха, в условиях неполного сгорания. Кроме того, теплота горения частично расходуется на нагрев окружающей среды, а при температурах выше 1700 ° С – на диссоциацию продуктов горения.
Например, при горении древесины, отличие Тг от практически реализуемой температуры горения может достигать более 500 ° С (табл. 5.6).
Температура горения древесины
Древесина
Q , МДж/кг
Расчет теоретической температуры горения
При определении теоретической температуры горения Тг предполагается, что вся выделившаяся теплота сообщается продуктам сгорания. Температура, до которой нагреются продукты сгорания, зависит от количества сообщаемой им теплоты, состава и количества продуктов сгорания и их удельной теплоемкости. Для расчета теоретической температуры горения Тг запишем уравнение теплового баланса.
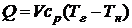
где Q – теплотворная способность топлива, Дж/кг;
V – объем продуктов сгорания, образующихся при горении 1 кг топлива, м 3 /кг;
с p –объемная удельная теплоемкость продуктов сгорания, Дж/(м 3 ∙град);
Тг – теоретическая температура горения, ° С;
Тн – начальная температура воздуха, ° С.
При горении в нормальных условиях (Тн=0 ° С) уравнение (5.3) примет вид:
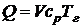
Из (5.4) следует формула для расчета теоретической температуры горения:
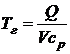
Поскольку продукты сгорания реальных топлив, как правило, состоят из разных газов, теплоемкость и плотность которых различны, то эта формула (5.4) записывается в следующем виде:
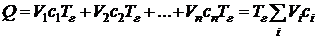
Соответственно, формула для расчета с учетом (5.6) примет вид
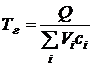
Для повышения точности расчетов необходимо учитывать зависимость теплоемкости газов от температуры. Однако, для оценочных расчетов можно принять средние значения теплоемкости (табл. 5.7).
Средняя теплоемкость (с p ) газов в диапазоне температур (1000÷3000) ° С
Источник
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ГОРЕНИЯ
Определение температуры горения пиросоставов имеет большое значение, так .как яляется критерием для оценки существующих составов и облегчает создание новых, более совершенных составов.
Температуру горения можно определить:
1) вычислением по формуле (6.6) (см. ниже). При этом используется общеизвестное положение, что температура горения равна ее теплоте, деленной на суммарную теплоемкость продуктов реакции горения;
2) .непосредственным намерением пр,и помощи оптических пирометров ил’и термопар (см. § 6 этой главы).
Известно, что в разных зонах пл.амя имеет разную температуру. Расчетным путем .может ‘быть найден только верхний предел температуры или, .иначе .говоря, максимальная температура пламени. Однако этот способ определения температуры не .всегда приемлем ‘из-за отсутствия точных данных о теплоемкости многих соединений при высоких температурах (выше 2000° С); для многих соединений не определены с достаточной точностью скрытые теплоты испарения. Кроме того, в действительности, температура горения должна быть значительно ниже вследствие затраты тепла на термическую диссоциацию продуктов горения, а также вследствие тепловых потерь в окружающее пространство.
Удовлетворительные результаты вычисления температуры горения описываемым ниже способом с использованием формулы (6.6) могут быть получены в том случае, если искомая температура не превышает 2000—2500° С. В противном случае могут быть .получены только ориентировочные данные.
Так .как при горении пиросоставов обычно имеется возможность для расширения газов, то при расчетах пользуются значениями теплоемкости Ср при постоянном давлении. Молекулярные теплоемкости газов Ср при постоянном объеме и при постоянном давлении Су связаны соотношением
(6.1) кал/ (г • моль -град)
где л’—газовая постоянная, равная 1,98
В табл. 6.5 приведены полученные опытным путем значения молекулярной теплоемкости Ср при различной температуре для двух- и трехатомных газов и водяного пара.
Значения средней молекулярной теплоемкости газов Ср (кал/град; 1 кал =4,186 Дж)
| Интервал темпера | Нг, N», Oa, СО | Нар | со, | Интервал темпера | Н;, N„. 0;, СО | H„0 | со; |
| туры, °С | туры, °С | ||||||
| 0—100 | 7,0 | 8,0 | 9,1 | 0—2000 | 7,7 | 10,3 | 12,3 |
| 0—500 | 7,1 | 8,3 | 10,3 | 0—2500 | 7,8 | 11,4 | 12,5 |
| 0—1000 | 7,3 | 8,8 | 11,3 | 0—3000 | 8,0 | 12,8 | 12,7 |
| 0—1500 | 7,5 | 9,5 | 11,9 |
Для простых веществ, находящихся в твердом состоянии, грубо приближенно можно считать (согласно правилу Дюлонга 72 и Пти), что их грамм-атомная теплоемкость при высоких температурах равна или больше 6,4 кал/град (36,8 Дж/град).
Для соединений, находящихся в твердом состоянии при высоких температурах, молекулярная теплоемкость (табл. 6.6) приближенно равняется сумме атомных теплоемкостей составляющих его элементов (правило Неймана — Коппа).
Таблица 6.6 Средняя молекулярная теплоемкость твердых веществ Ср
| Символ | Температура. °С | с? | Символ | Температура, °C | °р |
| Fe | 20—1500 | 9,6 | КС1 | 13,3 | |
| Си | 20—1500 | 9,4. | А^Оз | 30—1100 | 27,7 |
| NaCI | 20—785 | 13,6 | А40з | 30—1500 | 28,1 |
| MgO | 20—1735 | 12,1 | AlaOj | 20—2030 | 28,5 |
| MgO | 20—2370 | 14,0 | BaClz | 19,6 | |
| MgO | 20—2780 | 14,3 | BaCOj | 31,8 | |
| Примечание. 1 кал=4,186 Дж. |
Теплоемкость вещества в жидком состоянии обычно больше, чем в твердом. Иногда приближенно принимают теплоемкость жидких высоко плавящихся веществ равной 1,3 Ср твердых тел. Скрытая теплота плавления (испарения). Для многих простых веществ справедлива формула
где Qs — теплота плавления в ккал/г-атом;
7’s—температура плавления в К.
Однако зависимость эта оправдывается с достаточной точностью далеко не для всех простых веществ.
Зяачение Qs для многих неорганических соединений может быть приближенно вычислено по эмпирической формуле
где п — число атомов в молекуле соединения.
Скрытая теплота испарения вещества уменьшается с повышением температуры.
Для воды теплота испарения составляет при 100° С 9,7 ккал/ моль i(39,6 кДж/моль).
Зависимость между теплотой кипения Qn в ккал/моль (кДж/моль) и температурой кипения жидкости Гк в К выражается формулой Трутона:
Qк-=0,02 ккал (0,08 кДж). (6.4)
Для многих (в особенности высококипящих) неорганических соединений Ок может быть с большей точностью, чем по формуле Трутона, вычислена по эмпирической формуле, предложенной автором:
Tк
Очевидно, теплота испарения (кипения) соединений значительно больше теплоты их плавления.
Максимальную температуру горения вычисляют по формуле
t = Q — E (Qs + Qk) / E Cp
где Q—теплота горения;
E Ср — сумма теплоемкостей продуктов горения;
E(Qs+Qk.)—сумма скрытых теплот плавления и кипения
Пример 3. Вычислить максимальную температуру пламени состава красного огня, содержащего 65% КСlOз, 20% SrСОз и 15 % C13H12O2 (идитола).
Реакция горения приближенно может быть выражена уравнением
7,1 КС10з+ l,8SrC03+C13H1202=7,l KC1 +1,85гСОз+ +6Н20 пар+4,ЗС02+8,7СО.
Расчет теплоты горения ведется в ккал (1 ккал =4,11186 кДж) с использованием закона Гесса
Ниже приводится теплота образования начальных и конечных продуктов реакции; теплота образования идитола принята равной 0,74 ккал/г.
Для Н20 пар. . 6.57,4=344
Для СО2 . 4,3.94=404
ДляСО2 . 8,7-26=22б
Для КСl . . . . 7,1.106=752
Для C13H1202 . . . 0,74.200=148
Для КСlOз . 7,1.96=682
Количество тепла, выделяющееся при горении, равно 1726—830=896 ккал.
Теплоемкость Ср газов и водяного пара в интервале О—1500° С (см. табл. 6.7) равна:
для Н2О. . 6.9,5=57,0
для С02. . . . . . . . 4,3.11,9=51,2
для СО . . . . . . . . 8,7.7,5=65,2
Теплоемкость KC1 и SrСОз принимаем равной соответственно 12,8 и 32,0 кал/град моль и суммируем Отсюда
E Ср= 173,44-148,5=321,9 кал/град,
t=567*1000 / 321,9 = 1760 C
Если бы мы приняли во внимание частично протекающую в пламени термическую диссоциацию: SrCO3=SrO+CO2, то при расчете получили бы значение температуры порядка 1600° С.
Аналогичным методом был проведен расчет [23] для стехиомегрической смеси (WОз+2А1) и сделан вывод, что температура горения не должна превышать температуру кипения Аl2Оз, т. е. должна быть равной примерно 3000° С.
Необходимо еще раз отметить, что если температура горения превышает 2000—2500° С, то данные, полученные расчетным путем, являются лишь ориентировочными, а потому могут быть полезными только при сравнении между собой составов, резко обличающихся по своему рецепту.
Для ракетных топлив требуется высокая точность расчета температуры горения и других характеристик процессов горения. В этом случае для вычисления температуры горения выполняются весьма трудоемкие расчеты, при которых учитываются процессы термической диссоциации и испарения продуктов грения. Исходные данные для таких расчетов имеются в справочнике [86].
Дата добавления: 2016-01-09 ; просмотров: 1935 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Определение температуры горения
Под температурой горения понимают ту температуру,которую приобретают продукты сгорания в результате сообщения им тепла, выделенного при сжигании. Различают теоретическую и калориметрическую температуры горения.
Теоретическую температуру горения tт определяют с учетом процессов диссоциации, протекающих при образовании продуктов сгорания:

где 
qдисс – тепло, израсходованноеина процессы диссоциации, кДж/м 3 или кДж/кг;
Vпр – объем продуктов сгорания, образующихся при сгорании единицы топлива,
с – объемная теплоемкость продуктов сгорания, кДж/(м 3 ∙ град) или
Калориметрическую температуру tк определяют из условия полного сгорания топлива и использования всего выделившегося при горении тепла только на повышение температуры продуктов сгорания при адиабатных условиях (отсутствие теплообмена с внешней средой) и n = 1.

При подогретом воздухе (или топливе) калориметрическую температуру определяют по выражению:

где Qф – физическое тепло подогретых воздуха и топлива.
Газообразные продукты сгорания любого топлива представляют собой смесь различных газообразных составляющих. Каждой из этих составляющих при той или иной температуре присуща определенная величина теплоемкости. Это дает возможность определить теплоемкость теплоемкость продуктов сгорания в целом для соответствующей температуры. Например, теплоемкость продуктов сгорания, состоящих из 9,45 % СО2, 18,9 % Н2О и 71,65 % N2 при температуре 1500 ˚ С может быть определена следующим образом.
Объемные теплоемкости при этой температуре составят :
для СО2 2,3636 кДж/(м 3 ∙ град),
для Н2О 1,8389 кДж/(м 3 ∙ град),
для N2 1.447 кДж/(м 3 ∙ град).
В 1 м 3 продуктов сгорания содержится 0,0945 м 3 СО2, 0,189 м 3 Н2О, 0,7165 м 3 N2.
Следовательно, теплоемкость 1 м 3 продуктов сгорания будет равна:
СО2. . . . . .2,3636 ∙ 0,0945 = 0,223
Н2О . . . . . . 1,8389 ∙ 0,189 = 0,348
N2 . . . . . . . .1,447 ∙ 0,7165 = 1,035
Кроме теплоемкостей пользуются также величинами энтальпий. Энтальпия представляет собой произведение теплоемкости газа при постоянном давлении на температуру:
Например, энтальпия СО2 при температуре 1500 ˚ С равна:
i (СО2) = 2,3636 ∙ 1500 = 3545,34 кДж/м 3 .
3.4.4.4 Основные формулы для расчета горения топлива
Сведем все формулы, необходимые для расчета горения топлива, в единую таблицу.
Таблица 3.2 – Основные формулы для расчета горения топлива
| Искомый параметр | Жидкое и твердое топливо | Газообразное топливо |
| Пересчет на рабочий состав |    |   |
| Состав смеси |  где где  | |
| Низшая теплота сгорания |   |     |
| Расход кислорода на горение при n=1 | V(О2)=0,01(1,867С Р +5,6Н Р + +0,7(S Р -О Р )) | V(О2)=0,01(0,5(СО+Н2+3Н2S)+∑(n+m/4)СnНm) |
Таблица 3.2 – Продолжение
| Расход сухого воздуха | VВ=n(1+k)V(О2), где k=79/21=3,76;n – коэффициент расхода воздуха | |
| Объемы компонентов продуктов сгорания | V(RО2)=0,01(1,867С Р +0,7S Р ) RО2=СО2+SО2 V(Н2О)=0,01(11,2Н Р + +1,242W Р ) V(N2)=0,008N Р +nkV(О2) V(О2)’=(n-1)V(О2) | V(RО2)=0,01(СО2+SО2+СО+ +Н2S+∑nСnНm) V(Н2О)=0,01(Н2О+Н2+ Н2S+ +0,5∑mСnНm) V(N2)=0,01N2+nkV(О2) V(О2)’=(n-1)V(О2) |
| Объем продуктов сгорания | VПС= V(RО2)+ V(Н2О)+ V(N2)+ V(О2)’ | |
| Калориметрическая температура горения |  |
| Энтальпия продуктов сгорания | Истинная  При температуре tК‘ При температуре tК‘  |
| Действительная температура продуктов сгорания | tД=ηпирtК, где ηпир— пирометрический коэффициент для топочных камер ηпир=0,95 для мартеновских печей ηпир=0,85 – 0,9 для садочных печей ηпир=0,8 – 0,85 для проходных и протяжных печей ηпир=0,7 – 0,75 |
Задача 1
Воздух при давлении p1=0.1 МПа и температуре t1=15 °C вытекает из резервуара.
Найти значение р2, при котором теоретическая скорость адиабатного истечения будет равна критической, и величину этой скорости.
Источник




