ПЕРМАНГАНАТОМЕТРИЯ
Метод основан на полуреакции восстановления перманганат-иона в кислой среде:
MnO4 – + 8H + + 5e → Mn 2+ + 4Н2O.
Перманганат калия не является стандартным веществом (препарат содержит примеси MnO2). Готовят рабочий раствор КMnO4, выдерживают его в склянке из темного стекла в течение 7–10 сут, после чего отделяют раствор от осадка MnO2 (фильтрование). Хранят раствор в склянке из темного стекла с пришлифованной пробкой. Раствор стандартизируют по щавелевой кислоте или оксалату натрия.
Условия перманганатометрического титрования.
¨ Реакция восстановления перманганат-иона может протекать в любых условиях (табл. 9), но титрование проводят преимущественно в кислой среде.
Влияние рН на реакцию восстановления перманганат-иона
| Реакция среды | Реакция титрования | 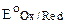 ,В ,В | Мэкв (КMnO4), г/моль |
| рН – + 8H + + 5e→ Mn 2+ + 4Н2O | 1,51 | М(1/5КMnO4)= 31,6 | |
| 7 ≤ рН ≤ 9 | MnO4 – + 2Н2O + 3e→ MnО2 + 4ОH – | 0,60 | М(1/3КMnO4)=52,7 |
| рН > 9 | MnO4 – + e→ MnO4 2– | 0,56 | М(1/1КMnO4)=158 |
В кислой среде в реакции участвует редокс-пара MnO4 – /Mn 2+ , стандартный потенциал которой имеет наибольшее значение, следовательно, скорость реакции в этих условиях максимальна. В кислой среде КMnO4 проявляет себя как более сильный окислитель, что расширяет ассортимент определяемых веществ. Кроме того, продукты восстановления перманганата калия в нейтральной и щелочной средах (аморфные осадки бурого цвета) затрудняют фиксирование точки эквивалентности.
¨ Безиндикаторное фиксирование точки эквивалентности: титрант КMnO4 имеет собственную фиолетовую окраску, которая исчезает при титровании (образуются бесцветные ионы Mn 2+ ). В точке эквивалентности, когда весь восстановитель полностью окислен, избыточная капля титранта окрашивает титруемый раствор в розовый цвет. Чувствительность реакции соответствует концентрации перманганата калия 1·10 –5 моль/дм 3 .
Перманганатометрия применяется для определения восстановителей (прямое титрование) и окислителей с предварительным восстановлением (обратное титрование).
Концентрация раствора перманганата калия при хранении изменяется вследствие окислительно-восстановительной реакции с водой, катализируемой диоксидом марганца на свету:
Титр раствора KMnO4 еженедельно устанавливают по стандартному раствору щавелевой кислоты.
Реакция между перманганатом калия и щавелевой кислотой автокаталитична (продукт реакции Mn 2+ – катализатор), поэтому, несмотря на значительную разность стандартных потенциалов редокс-пар MnO4 – /Mn 2+ и СО2/С2О4 2– , для ускорения реакции раствор нагревают.

Титрование проводят без индикатора. Для установления точки эквивалентности фиксируют момент, когда очередная капля титранта окрасит раствор в неисчезающий в течение 1–2 мин бледно-розовый цвет. В начале титрования титрант обесцвечивается медленно, затем, когда в растворе образуется большое количество Mn 2+ , обесцвечивание происходит практически мгновенно (Mn 2+ – катализатор реакции окисления щавелевой кислоты).
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Перманганатометрия способ фиксирования точки эквивалентности
В ряде случаев окислительно-восстановительного титрования точки эквивалентности фиксируют по изменению окраски титруемого раствора, вызываемой избытком окрашенного стандартного раствора (например, перманганата).
В методах, основанных на титровании стандартным раствором иода, или на выделении иода (иодометрия), точку эквивалентности устанавливают при помощи индикатора — крахмала, специфически реагирующего с иодом (в присутствии свободного иода бесцветный раствор крахмала окрашивается в интенсивно синий цвет; в присутствии избытка восстановителей, восстанавливающих нейтральный иод, интенсивно синее окрашивание исчезает).
В некоторых случаях конец титрования определяется по обесцвечиванию кроваво-красной окраски роданида железа в присутствии избытка восстановителя (титанометрия).
Перечисленные вещества можно отнести к группе специфических реактивов (индикаторов), действующих в пределах определенных методов окисления—восстановления.
Помимо этой группы веществ (индикаторов), в методах окисления—восстановления широко применяются индикаторы, называемые ред-окс-индикаторами, которые изменяют окраску в зависимости от величины окислительно-восстановительного потенциала (Е).
Иногда для более четкого фиксирования точки эквивалентности прямое визуальное титрование проводят либо в неводных растворах, либо к водному раствору добавляют небольшое количество органического растворителя, не смешивающегося с водой (бензол, изоамиловый эфир, четыреххлористый углерод и т. п.). При этом органический растворитель экстрагирует слабоокрашенное вещество, и окраска его усиливается. Так, например, поступают при иодометрическом титровании, экстрагируя иод.
В ряде случаев используют внешние, флюоресцирующие, хемилюми-несцентные и другие индикаторы (см. ниже).
Наиболее широко для фиксирования конечной точки титрования применяют физико-химические (инструментальные) методы (потенциометрический, амперометрический, кулонометрический, кондуктометрический, хронокондуктометрический, высокочастотный, фотометрический, спектрофотометрический и др.).
Источник
Способы определения точки эквивалентности
В редоксиметрии точку эквивалентности можно определить с помощью различных инструментальных методов (например, потенциометрически) либо визуально.
Визуальное обнаружение конечной точки титрования может быть проведено по изменению окраски одного из участников протекающей реакции, либо с помощью индикаторов. Например, в перманганатометрии критерием достижения точки эквивалентности обычно служит появление неисчезающей розовой окраски вследствие добавления к бесцветному титруемому раствору одной лишней капли ярко-малинового раствора KМnO4.
Индикаторы, используемые для определения точки эквивалентности, могут быть специфическими либо окислительно-восстановительными.
Специфические индикаторы реагируют на изменение концентрации одного из участников химической реакции, протекающей при титровании, образуя с ним нестойкое яркоокрашенное соединение.
Оно легко может разрушаться при добавлении второго реагента. Например, в иодометрии для этих целей используют раствор крахмала, образующий с I2 соединение ярко-синего цвета. По исчезновении (в результате расходования I2) или возникновении (при добавлении лишней капли раствора I2) синей окраски судят о достижении точки эквивалентности.
Окислительно-восстановительными, или редокс-индикаторами, называются вещества, которые изменяют свою окраску в зависимости от величины окислительно-восстановительного потенциала системы.
Под действием окислителя или восстановителя в структуре молекулы редокс-индикатора происходят изменения, вызывающие возникновение новой окраски. Таким образом, в растворе редокс-индикатора существует равновесие между его окисленной и восстановленной формами, имеющими разную окраску, которое сдвигается при изменении потенциала системы:
где Indox – окисленная, а IndRed – восстановленная формы индикатора; n – число электронов, принимающих участие при переходе молекулы индикатора из одной формы в другую.
Потенциал такой индикаторной системы может быть рассчитан по уравнению Нернста:
где Е 0 – стандартный электродный потенциал, возникающий в системе, когда молярные концентрации окисленной (с(Indox)) и восстановленной (с(IndRed)) форм индикатора будут равны друг другу.
Как и в случае индикаторов других типов, изменение окраски редокс-индикаторов происходит в некотором интервале изменения величины их электродного потенциала. Можно показать, что крайние значения этого интервала определяются соотношением:
Редокс-индикатор можно использовать в окислительно-восстановительном титровании, если его интервал перехода лежит внутри скачка редокс-потенциала системы на кривой титрования.
Редокс-индикаторы могут быть двухцветными (каждая из его форм имеет свою специфическую окраску) и одноцветными (табл. 22). В первом случае в точке эквивалентности мы наблюдаем переход одной окраски раствора в другую. Во втором случае – исчезновение или возникновение окраски титруемого раствора.
Таблица 22. Некоторые окислительно-восстановительные индикаторы
| Индикатор | Е 0 , В | Окраска | |
| Окисленная форма | Восстановленная форма | ||
| Нейтральный красный | +0,240 | красная | нет |
| Метиловый синий | +0,532 | синяя | нет |
| Дифениламин | +0,76 | фиолетовая | нет |
| Эриоглауцин А | +0,99 | оранжевая | жёлтая |
| Ферроин | +1,06 | бледно-голубая | красная |
| 5-Нитроферроин | +1,25 | бледно-голубая | красная |
Редокс-индикаторы бывают обратимыми и необратимыми. Первые могут изменять свою окраску в растворе в зависимости от величины электродного потенциала системы неограниченное число раз. Вторые изменяют свою окраску необратимо, например, при окислении разрушаются с образованием бесцветных продуктов, как индиго под действием гипохлоритов или нафтоловый сине-чёрный под действием ионов BrO3 — .
Перманганатометрия
Перманганатометрическим титрованием называется титриметрический метод анализа, основанный на использовании в качестве титранта KМnO4.
Перманганатометрическое титрование проводят чаще всего в кислой среде, реже – в нейтральной. Щелочные растворы KМnO4 используют для количественного определения некоторых органических соединений: спиртов, альдегидов. Во всех трёх случаях продукт восстановления иона МnO4 – и редокс-потенциал системы различны:
а) МnO4 – + 8H + + 5ē = Mn 2+ + 4H2O,
E 0 (МnO4 – / Mn 2+ ) = +1,58В, рН – + 2H2O + 3ē = MnO2↓ +4OH – ,
Таким образом, в кислой среде, окислительная активность KМnO4 является самой высокой, что позволяет при этих условиях определить гораздо большее число различных восстановителей, чем в нейтральной и щелочной средах. Кроме того, при титровании в нейтральной и слабощелочной средах образуется тёмно-бурый осадок MnO2, сильно затрудняющий фиксирование точки эквивалентности.
Для создания кислой среды в перманганатометрии используют разбавленный раствор H2SO4 (c(H2SO4)) ≈ 1моль/дм 3 .
Азотная кислота (особенно содержащая оксиды азота) сама является сильным окислителем и может, наряду с KМnO4, окислять определяемое вещество, что приведёт к получению заниженных результатов анализа. Соляная и другие галогеноводородные кислоты (HBr, HI) будут, наоборот, окисляться KМnO4:
Продуктом восстановления иона МnO4 – в кислой среде является бесцветный ион Mn 2+ , что очень удобно для определения точки эквивалентности.
Рабочий раствор KМnO4 по точной навеске кристаллического вещества приготовить невозможно, т.к. в нём всегда содержится некоторое количество MnO2.
Кроме того, MnO2 образуется при окислении органических соединений, присутствующих в окружающей среде, например в воздухе.
В водных растворах концентрация KМnO4 со временем уменьшается, так как перманганат калия частично расходуется на окисление различных посторонних примесей (присутствующих даже в дистиллированной H2O) и самой воды.
Данная реакция протекает достаточно медленно, поэтому правильно приготовленный раствор KМnO4 можно хранить в течение нескольких недель.
Обычно раствор KМnO4 готовят несколько больше заданной концентрации. Рассчитанную для этих целей навеску вещества взвешивают на технических весах.
Перед установлением точной концентрации раствор KМnO4 кипятят в течение небольшого промежутка времени (≈10 минут), а затем после охлаждения выдерживают в тёмной посуде несколько дней, чтобы завершились процессы окисления органических веществ и других примесей, содержащихся в H2O. После этого раствор фильтруют через стеклянный фильтр для удаления образовавшегося MnO2 и затем титруют рабочим раствором дигидрата щавелевой кислоты H2C2O4·2H2O или её натриевой соли Na2C2O4 (приготовленным по точной навеске вещества) в соответствии с уравнением:
Данная реакция протекает медленно, поэтому на начальном этапе её проводят при нагревании (около 70 0 С). Также она является автокаталитической – роль катализатора выполняют образующиеся ионы Mn 2+ . К концу титрования их накапливается большое количество и реакция с достаточной скоростью начинает протекать и при обычных условиях.
Перегревать раствор H2C2O4 (тем более доводить его до кипения) нельзя, т.к. растворенное вещество при этом будет частично разрушаться:
H2C2O4 
Вместо нагревания к раствору щавелевой кислоты можно добавить определенное количество горячей H2O с таким расчётом, чтобы температура смеси стала равной приблизительно
60-80 о С.
Индикаторы в перманганатометрическом титровании обычно не используются. В их роли выступает раствор KМnO4, имеющий интенсивную фиолетовую окраску. Конечную точку титрования обнаруживают по исчезновению окраски раствора KМnO4 (если к нему прибавляют из бюретки исследуемый раствор) или, наоборот, появлению неисчезающей слабо-розовой окраски при добавлении одной лишней капли выступающего в роли титранта раствора KМnO4.
Не рекомендуется оставлять раствор KМnO4 в бюретках на длительное время.
Источник






