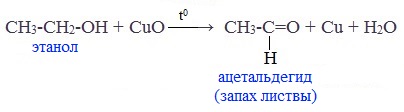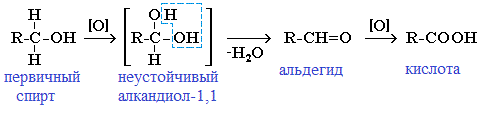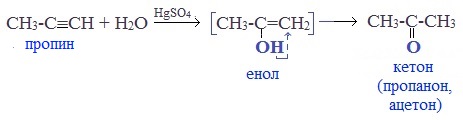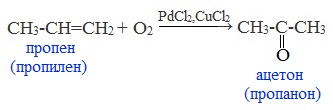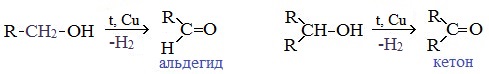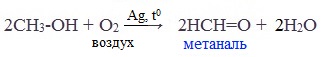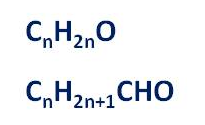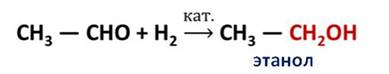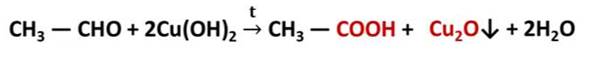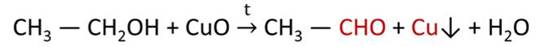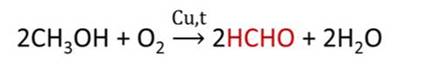Перечислите способы получения альдегидов
1. Окисление спиртов
В лаборатории карбонильные соединения получают окислением спиртов в жестких условиях в присутствии сильных окислителей (дихромата калия К2Cr2O7 или перманганата калия КМnО4) в серной кислоте Н2SO4. В качестве окислителя можно использовать оксид меди (II) при нагревании.
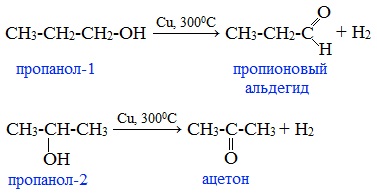
При окислении первичных спиртов образуются альдегиды:
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
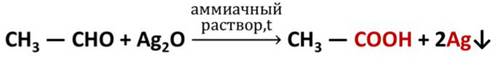
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, ниже tкип спирта и кислоты).
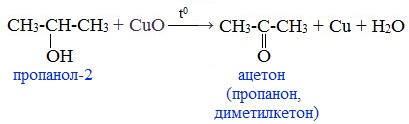
При окислении вторичных спиртов образуются кетоны:
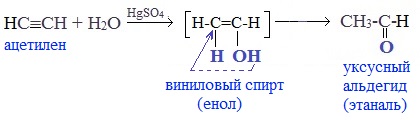
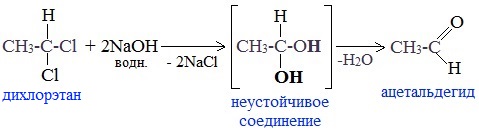
Присоединение воды к ацетилену происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта (енола), который изомеризуется в уксусный альдегид (в случае ацетилена):
Кетоны получают при гидратации других гомологов ряда алкинов:
Раньше это был промышленный способ получения карбонильных соединений. В настоящее время этот способ находит ограниченное применение из-за загрязнения получаемых продуктов токсичными солями ртути и относительной дороговизны.
3. Каталитическое окисление алкенов кислородом воздуха
Этим способом в промышленности получают уксусный альдегид — окислением этилена кислородом воздуха (Вакер-процесс).
Эта реакция протекает в присутствии катализатора – смеси PdCl2 и CuCl2 и температуре 100 0 С:
Этим экономичным способом получают низшие альдегиды и кетоны.
Этот промышленный способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
4. Каталитическое дегидрирование спиртов
В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов.
Этот способ получения объясняет суть названия «альдегид» (от лат. alconol dehydrogenatum – спирт, от которого «отняли» водород).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
В 1835 г. немецкий химик Ю. Либих выделил индивидуальное вещество, молекула которого содержала на два атома водорода меньше, чем этанол. Ученый установил состав этого соединения – С2Н4О и назвал его альдегидом (от лат. al conol dehyd rogenatum — т.е. дегидрированный спирт, «спирт, лишенный водорода»).
В 1867 г. немецкий химик-органик А. Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О, молекула которого отличается от открытого Либихом альдегида на группу -СН2— . Именно это соединение (муравьиный альдегид) открывает гомологический ряд альдегидов.
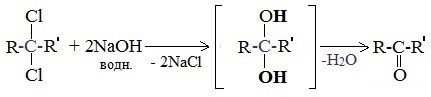
5. Щелочной гидролиз дигалогеналканов
Реакция протекает при действии водных растворов щелочей на дигалогензамещенные углеводороды, содержащие два атома галогена у одного и того же атома углерода.
При щелочном гидролизе дигалогеналканов образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и при отщеплении воды, превращаются в карбонильные соединения.
Если два атома галогена связаны с первичным атомом углерода, то образуются альдегиды:
При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны:
Это лабораторный способ получения карбонильных соединений.
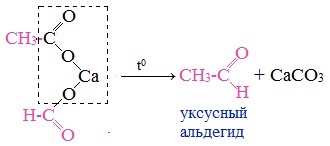
6. Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны.
Это лабораторный способ получения карбонильных соединений.
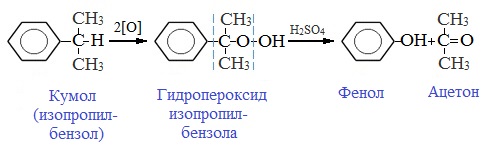
7. Кумольный способ получения ацетона (наряду с фенолом)
Простейший кетон – ацетон – получают кумольным методом вместе с фенолом:
Это промышленный способ получения ацетона.
Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
Получение формальдегида
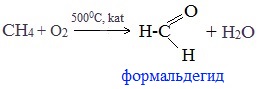
1. Окисление метана
Формальдегид в промышленности можно получить окислением метана кислородом воздуха при высоких температурах с использованием катализатора:
2. Окисление метанола
Основной промышленный способ получения формальдегида – окисление метанола с использованием серебряного катализатора при температуре 650 0 С и атмосферном давлении:
Реакция происходит на раскаленной серебряной сетке, через которую проходят пары ментола, смешанные с воздухом. Реакция настолько экзотермична, что выделяющейся в ходе ее теплоты достаточно для того, чтобы поддерживать сетку в раскаленном состоянии.
В настоящее время разработан перспективный способ высокотемпературного окисления метанола с использованием железомолибденовых катализаторов:
Источник
Альдегиды. Свойства. Получение. Применение
Урок 35. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Альдегиды. Свойства. Получение. Применение»
Альдегиды. Свойства. Получение и применение
Каждый из вас может представить себе запах гиацинтов. Этот аромат обусловлен наличием альдегида, который так и называют – гиацинтовый. А что же представляют собой альдегиды?
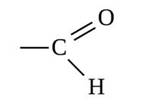
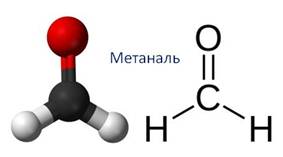
Альдегиды – это производные углеводородов, в молекулах которых атом водорода замещён на группу ― CHО. Эта группа называется альдегидной и для альдегидов она является функциональной, то есть определяет принадлежность к данному классу соединений.
Общая формула альдегидов R – CHO, где R – углеводородный заместитель или атом водорода. Кроме этого, использую ещё и общую формулу CnH2nO, которая отражает молекулярный состав альдегидов, или такую формулу, как CnH2n+1CHO.
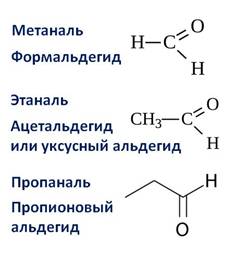
Первым представителем альдегидов является метаналь – HCHO или формальдегид, вторым альдегидом является этаналь – CH3 – CHO, или ацетальдегид, третьим представителем – пропаналь, или пропионовый альдегид – CH3 – CH2 – CHO.
Названия альдегидов образуются от названий соответствующих алканов с добавлением суффикса –аль.
Метаналь при н.у. является бесцветным газом.
Альдегиды, у который от двух до двенадцати атомов углерода – жидкости, у которых больше атомов углерода – твёрдые вещества. Низшие альдегиды имеют резкий запах, у альдегидов, которые имеют от четырех до шести атомов углерода, неприятный запах, высшие альдегиды обладают цветочными запахами. Низшие альдегиды хорошо растворяются в воде. Сорока процентный раствор метаналя называют формалином. С увеличением молярной массы альдегидов их растворимость в воде уменьшается. Температуры кипения и плавления альдегидов с увеличением молярной массы возрастают.
Альдегиды – химически активные соединения, для которых характерны реакции присоединения по связи С=О и окисления по связи С–Н в альдегидной группе.
Например, при пропускании паров этаналя вместе с водородом над катализатором происходит присоединение водорода и образуется спирт этанол
Если к аммиачному раствору оксида серебра (I) прилить раствор этаналя и смесь нагреть, то происходит окисление альдегида с образованием кислоты. Внутренняя поверхность пробирки, в которой нагревается смесь, покрывается при этом тонким слоем серебра. Это так называемая реакция «серебряного зеркала», которая может служить качественной реакцией на альдегиды.
Если приготовить гидроксид меди (II) смешением растворов гидроксида натрия и сульфата меди (II), а затем к этому свежеприготовленному осадку гидроксида меди (II) прилить раствор этаналя и смесь нагреть, то происходит окисление альдегида до кислоты, а гидроксид меди (II) превращается в оксид меди (I) красного цвета. Эта реакция также используется для качественного обнаружения альдегидов.
В лаборатории альдегиды получают окислением спиртов, в качестве окислителя используют оксид меди (II).
В промышленности метаналь получают окислением метанола кислородом воздуха в присутствии медного или серебряного катализатора:
Этаналь был выделен в лаборатории немецким химиком Ю. Либихом в 1835 году, а метаналь был получен в лаборатории немецким химиком А. Гофманом в 1868 году.
Основное количество получаемого в промышленности метаналя расходуется на производство фенолформальдегидных смол и пластмасс, полиформальдегид используют для изготовления плёнок и волокон, метаналь применяют при производстве некоторых лекарственных веществ, в частности уротропина. Метаналь используется для получения формалина, который обладает сильными дезинфицирующими свойствами, поэтому его применяют для дезинфекции и дубления кож, хранения анатомических препаратов, в сельском хозяйстве – для протравливания семян. Этаналь используют в промышленных масштабах для получения уксусной кислоты и её производных.
Таким образом, альдегиды – производные углеводородов, у которых атом водорода замещён на альдегидную группу. Общая формула альдегидов – CnH2n+1CHO. Для альдегидов характерны реакции присоединения по двойной связи и окисления по связи С–Н в альдегидной группе. К основным промышленным способам получения альдегидов относят окисление спиртов. Метаналь и этаналь используют во многих отраслях производства.
Источник