Способы культивирования
Для выращивания бактерий используют следующие способы их культивирования: стационарный, глубинный с аэрацией и с использованием проточных питательных сред.
Стационарный способ: питательные среды сохраняются постоянными, с ними никаких дополнительных манипуляций не производят. Однако при таком способе культивирования в жидких питательных средах, где преобладают анаэробные энергетические процессы, выход биомассы незначителен. Поэтому в связи с развитием микробиологической промышленности были разработаны принципиально новые способы культивирования, позволяющие получать гораздо больший выход биомассы или биологически активных соединений. К их числу относятся метод глубинного культивирования с аэрацией и метод использования проточных сред.
Метод глубинного культивирования с аэрацией. Для выращивания с помощью этого способа применяют специальные устройства – реакторы. Они представляют собой герметические котлы (приспособленные автоклавы), в которые заливается жидкая питательная среда. Реакторы снабжены автоматическими приспособлениями, позволяющими поддерживать постоянную температуру, оптимальные рН иrН, дозированное поступление необходимых дополнительных питательных вещест 2 в. Однако главная особенность таких реакторов в том, что они постоянно продуваются стерильным воздухом и в них установлены мешалки, с помощью которых среда постоянно перемешивается. Поэтому во всей питательной среде создается такая концентрация свободного кислорода, при которой энергетические процессы происходят в аэробных условиях, т. е. достигается максимальное использование энергии, заключенной в глюкозе, а следовательно, и максимальный выход биомассы. Для примера: выход биомассы при стационарном методе культивирования E. coli в МПБ через 18 – 20 ч составляет 1 – 2 млрд клеток на 1 мл среды, а при глубинном методе через 12 – 14 ч – 50 – 60 млрд клеток/мл среды.
Использование проточных питательных сред позволяет создать условия, при которых клетки имеют возможность длительное время находиться в определенной фазе роста (экспоненциальной) при постоянной концентрации питательных веществ и в одних и тех же условиях, обеспечивающих непрерывный рост культуры. Методы получения непрерывных культур основаны на том, что в аппарат, где растут клетки, непрерывно добавляют свежую питательную среду и одновременно из него удаляют соответствующее количество бактерий.
Различают два типа таких аппаратов: хемостаты и турбидостаты. Хемостат – аппарат, в который постоянно из особого резервуара добавляется свежая питательная среда. Благодаря механическому перемешиванию и аэрации среды в ней создаются оптимальные условия для снабжения бактерий кислородом и вновь добавляемыми питательными веществами, по мере поступления которых часть популяции бактерий из аппарата удаляется.
Принцип работы турбидостата основан на поддержании постоянной плотности (мутности) бактериальной популяции в аппарате. Степень мутности контролируется с помощью фотоэлементов, которые через систему реле регулируют поступление питательных веществ в аппарат. Все питательные вещества в ней содержатся в избытке, и скорость роста приближается к максимальной. В таких аппаратах непрерывного культивирования микроорганизмов (АНКМ) все необходимые параметры для роста соответствующего вида микроорганизма задаются и поддерживаются с помощью специальных автоматических приборов. Благодаря сохранению неизменных условий среды непрерывная культура постоянно находится в наиболее желательной фазе роста, при которой обеспечивается максимальный выход биологически важных соединений (антибиотики, витамины, аминокислоты и т. п.) либо биомассы. Таким образом, в соответствии со способами культивирования различают периодические (при стационарном и глубинном методах культивирования) и непрерывные (при проточном способе) культуры микроорганизмов. Кроме того, при определенных условиях получают синхронные культуры, т. е. культуры, в которых все клетки одновременно (синхронно) делятся. Однако такая синхронность сохраняется, как правило, в течение 2 – 3 циклов деления, а затем она нарушается. Синхронные культуры используют в основном для изучения тех или иных стадий клеточного цикла бактерий и роли отдельных генов (и их продуктов) в их осуществлении.
Данный текст является ознакомительным фрагментом.
Источник
Методы культивирования микроорганизмов



Для культивирования микроорганизмов применяют поверхностный или глубинный способы.
При поверхностном способе микроорганизмы выращивают чаще всего на твердых (рыхлых, увлажненных до 30-80%, например, отрубях) или жидких (реже) питательных средах. В первом случае рост идет на поверхности твердых частиц и в порах, заполненных водой или воздухом, перемешивание отсутствует. Если среда жидкая, то кюветы с ней помещают в вентилируемые воздухом камеры. Культура микроорганизмов потребляет кислород непосредственно из газовой фазы __ воздуха.
Поверхностным способом выращивают аэробные микроорганизмы (например, плесневые грибы).
Глубинный способ характеризуется тем, что микроорганизмы развиваются во всей толще жидкой питательной среды в специальных аппаратах (ферментаторах). Метод применим как для выращивания аэробных (аэрация среды обязательна), так и анаэробных микроорганизмов. Во всех случаях проводят перемешивание питательной среды мешалками.
Культивирование глубинным способом может быть периодическим или непрерывным.
Сущность периодического способа заключается в том, что весь объем питательной среды загружают в аппарат сразу, добавляют культуру микроорганизмов и при оптимальных условиях ведут процесс до тех пор, пока не накопится нужное количество биомассы (например, при выращивании чистой культуры дрожжей, бактерий; в производстве хлебопекарных дрожжей) или продуктов жизнедеятельности микроорганизмов — метаболитов (например, спирта).
При периодическом культивировании изменяется состав среды (уменьшается концентрация питательных веществ и увеличивается количество метаболитов); скорость роста; морфологические и физиологические свойства культуры. К тому же возникают технологические трудности __ циклический ход операций, сменные технологические режимы, что затрудняет контроль и автоматизацию процесса. Эффективность данного способа низкая (70% времени приходится на непроизводительные стадии __ лаг-фазу и фазу отмирания).
Эти недостатки устраняются применением непрерывных способов культивирования.
Данные методы характеризуются непрерывным поступлением в ферментатор свежей питательной среды и непрерывным оттоком готовой культуральной жидкости вместе с клетками введенной культуры микроорганизма.
При непрерывном культивировании можно задержать культуру на логарифмической стадии роста (или любой другой), установки могут длительно работать без остановки на дезинфекцию, время производства сокращается, процесс легче автоматизировать.
Различают гомогенно- и гетерогенно-непрерывное культивирование.
Гомогенно-непрерывный способ отличается интенсивным перемешиванием содержимого в ферментаторе, благодаря этому все параметры в любой точке аппарата и в вытекающей из него среде одинаковы.
Гетерогенно-непрерывный способ характеризуется незначительным перемешиванием среды или полным его отсутствием. При этом состав среды в любой точке аппарата различен, однако показатели системы в целом не изменяются во времени.
Гомогенные методы культивирования чаще всего используют для накопления биомассы микроорганизмов, гетерогенные __ для проведения собственно процесса брожения.
Все непрерывные процессы осуществляют в одном аппарате или в батарее, соединенных последовательно между собой ферментаторов.
Источник
8.2. Методы культивирования бактерий
Для успешного культивирования бактерий, кроме правильно подобранных сред и проведенного посева, необходимы оптимальные условия: температура, влажность, аэрация. В среднем температура для культивирования большинства микробов должна быть в пределах 37-38 °С.
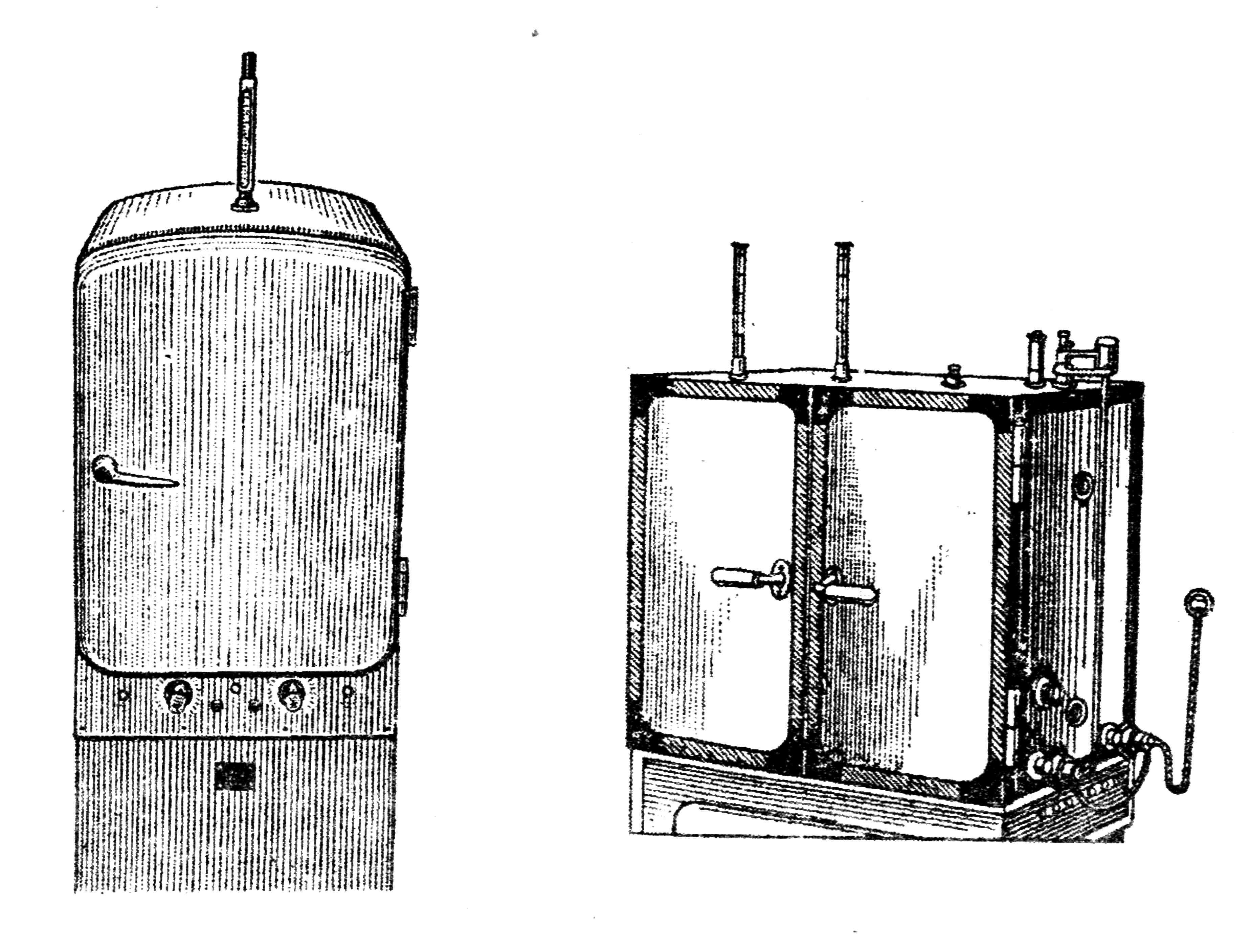
Для выращивания микробов в лабораторных условиях используют специальный аппарат — термостат, в котором поддерживается постоянная и определенная температура (рис. 26).
Термостаты бывают различного устройства и размера. Термостат представляет собой шкаф с полками внутри и открывающейся дверцей, сделанные из теплоизолирующих материалов. Источником нагрева в современных термостатах являются электронагревательные элементы, которые прогревают воздух или воду.
Существенной частью любого термостата является система терморегуляции, которая обеспечивает поддержание температуры на оптимальном уровне. Датчиком температуры в большинстве термостатов является ртутный контактный термометр с магнитной головкой. Такой термометр имеет два контакта, один из которых представляет собой платиновую подвижную проволоку, заключенную в канал термометра, другой присоединяется к ртути. Уровень температуры по положению подвижного контакта регулируется магнитной головкой. При нагревании термостата выше 37° замыкаются контакты термометра, и сигнал поступает в электронное устройство, которое с помощью реле отключает источники нагрева. При снижении температуры контакты размыкаются и подается сигнал для включения источников нагрева. Таким образом, в термостатах постоянно поддерживается нужная температура.
В больших лабораториях по такому же принципу создаются комнаты-термостаты.
Рис. 26. Различные системы термостатов: сухо-воздушный (А), с водяной рубашкой (Б)
Свет подавляющему большинству патогенных микробов не нужен: их культивируют в темноте. Однако для изучения пигментообразования, которое происходит активнее на рассеянном свету, бактериальные культуры после термостата выдерживают 2-3 дня при комнатном освещении.
Для успешного культивирования бактерий необходимо применять свежие питательные среды, содержащие определенное количество влаги. Особенно это касается использования плотных питательных сред, которые разливают в чашки и скашивают в пробирках в день посева.
При выращивании аэробов и факультативных анаэробов аэрация происходит в естественных условиях без применения каких-либо дополнительных приспособлений.
Сроки культивирования большинства патогенных микроорганизмов составляют 18-24 часа, но есть и культуры, растущие медленно – до 4-6 недель.
8.3. Методы выделения чистых культур бактерий
Морфологические, культуральные и биохимические особенности микроорганизмов, необходимые для определения вида с целью постановки бактериологического диагноза, изучают, используя чистые культуры бактерий.
Микробы, выделенные из внешней среды, организма животных или людей и размноженные на питательных средах, называют культурами.
В исследуемом материале патогенные микроорганизмы во многих случаях находятся в числе других, чаще сапрофитных бактерий. Выделить чистую культуру возбудителя болезни является основной задачей при проведении бактериологической диагностики.
Чистая культура микробов содержит только один вид микроорганизмов, который определяется по совокупности его свойств. Культура микроорганизмов, выделенная из определенного источника (организм животного, воздух, почва и др.) получила название штамм.
Если выделенная бактериальная культура одного вида различается по некоторым признакам, то она называется – вариант.
Методы выделения микроорганизмов из исследуемого материала можно отнести к двум группам – механические и биологические.
А. Механические методы
Они основаны на механическом разъединении одной бактериальной клетки от другой с целью получения отдельных изолированных колоний на плотной питательной среде. После культивирования посевов в термостате из отдельной нужной колонии делается пересев на питательную среду, в которой вырастают чистые культуры бактерий.
1-й день исследования
Из исследуемого материала готовят мазки и окрашивают их по Граму. При микроскопии устанавливают наличие бактерий, их морфологические особенности и отношение к окраске по Граму.
Для получения изолированных колоний исследуемый материал высевают на поверхность плотной питательной среды в чашках Петри.
Агар в чашки разливают следующим образом: флакон со стерильной питательной средой помещают в водяную баню. После расплавления агара и его охлаждения до 42°С флакон берут в правую руку, левой рукой извлекают пробку, обжигают горлышко флакона, большим и указательным пальцами левой руки слегка приподнимают крышку чашки. Вводят горлышко флакона под крышку чашки (не касаясь краев), наливают 15-20 мл питательного агара, быстро выводят горлышко флакона и закрывают чашку крышкой. Края горлышка флакона подводят к пламени и закрывают его обожженой пробкой. Слегка покачивая круговыми движениями чашку, достигают равномерного распределения среды. Чашки оставляют на месте, пока среда не застынет, а затем их переносят в термостат, поворачивая вверх дном, снимают крышку и оставляют в таком виде на 15-20 минут для подсушивания.
Существует несколько методов посева материала для выделения чистой культуры бактерий. Посев на чашки штрихом производится при помощи петли, которой набирают небольшое количество исследуемого материала и, не вынимая петлю из пробирки, стряхивают излишнее его количество. Чашку с питательной средой помещают на столе вверх дном. Левой рукой берут дно чашки, держа ее почти вертикально, и густо заштриховывают петлей небольшой участок агара в верхней части чашки. Петлю следует держать свободно большим и указательным пальцами правой руки, ближе к концу петледержателя. Освободив таким образом петлю от излишнего материала, легкими движениями, не повреждая поверхности среды, наносят, отрывая друг от друга, параллельные штрихи на расстоянии около 0,5 см.
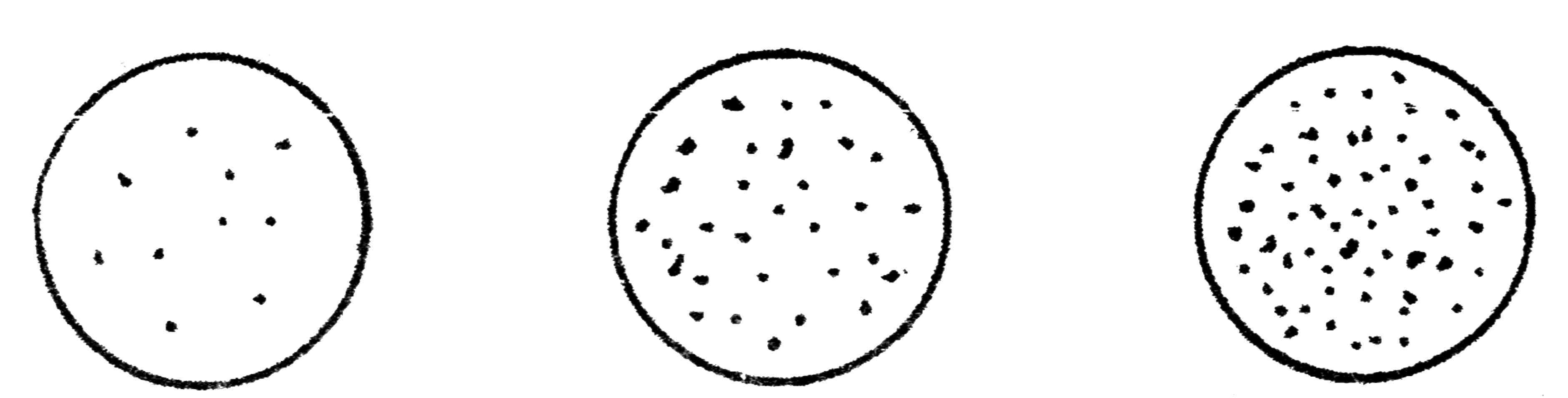
В отдельных случаях можно производить последовательный рассев материала, используя для этого несколько чашек с питательной средой. Набрав петлей материал, производят посев штрихами на первой чашке и той же петлей, не набирая материала, вновь наносят штрихи на вторую и третью чашки с питательным агаром. На первой чашке обычно получают рост в виде сплошных штрихов, на второй и, особенно на третьей бактерии развиваются в виде изолированных колоний (рис. 27).
Рис. 27. Рост бактерий на плотной питательной среде при последовательном посеве
Посев шпателем. Посев исследуемого материала нередко производят шпателем, который заранее заворачивают в бумагу и стерилизуют горячим воздухом. Исследуемый материал в количестве одной петли или капли наносится пастеровской пипеткой в центр чашки со средой, каплю шпателем распределяют на небольшом участке среды, а затем круговыми движениями по всей ее поверхности. На время посева крышка чашки, поддерживаемая левой рукой, остается слегка открытой.
Шпатель из первой чашки быстро переносят во вторую чашку, а затем в третью. По окончании посева шпатель погружают в банку с дезинфицирующим раствором. Чашку с соответствующей надписью на дне помещают в термостат вверх дном для того, чтобы конденсационная вода, скапливающаяся на внутренней поверхности крышки, не попадала на поверхность посева и не размывала выросшие колонии.
2-й день исследования
Изучают культуральные свойства чистой культуры, выросшие колонии на третьей чашке. Их изучают невооруженным глазом, с помощью лупы, при малом увеличении микроскопа и иногда под стереоскопическим микроскопом.
Нужную колонию отмечают со стороны дна чашки восковым карандашом. Из нее делают мазок и окрашивают по Граму. При микроскопии изучают морфологические особенности и отношение бактерий к окраске по Граму. Из этой колонии делают пересев на питательные среды (МПА и МПБ). Посевы помещают в термостат для культивирования.
3-й день исследования
Изучают культуральные свойства бактерий на МПА и МПБ, делают мазок, окрашивают по Граму, микроскопируют. Убедившись в том, что бактериальная культура чистая, приступают к изучению ее биохимических (ферментативных) свойств, устанавливают подвижность, определяют чувствительность к антибиотикам и др.
В научно-исследовательской работе, особенно при генетических исследованиях, необходимо получать культуры заведомо из одной клетки. Такая культура называется клон. Для его получения чаще всего пользуются микроманипулятором. Этот прибор снабжен инструментами (иглами, пипетками) микроскопических размеров. С помощью держателя под контролем микроскопа их вводят в препарат с бактериями на предметном стекле и одну нужную клетку засевают в питательную среду.
Б. Биологические методы
Они основаны на учете тех или иных биологических особенностей выделяемых бактерий в чистую культуру.
1. Выделение спорообразующих микроорганизмов
При выделении чистых культур из исследуемого материала, содержащего споровые формы микробов, его прогревают 10 мин при 80° или 2-3 мин при 100° в расчете на то, что менее стойкие неспоровые формы погибнут при этой температуре. При этом споровые формы останутся жизнеспособными.
Из прогретого материала проводится посев на питательные среды, на которых вырастают спорообразующие микроорганизмы.
2. Выделение кислоустойчивых микроорганизмов.
Для выделения чистой культуры возбудителей туберкулеза и па-ратуберкулеза из патологического материала используют химический метод. С этой целью исследуемый материал после его гомогенизации обрабатывают 6%-ным раствором серной кислоты в течение 5-7 мин, добавляя ее в равном объеме. Благодаря этому погибают микробы сопутствующей микрофлоры, а кислотоустойчивые остаются жизнеспособными.
После нейтрализации раствора кислоты проводят посев на специальные питательные среды, на которых вырастают кислотоустойчивые микробы.
3. Выделение подвижных микроорганизмов (метод Шукевича)
Исследуемый материал, из которого выделяется подвижный микроб, засевают в конденсационную воду скошенного МПА. При посеве необходимо следить, чтобы петля с материалом не коснулась поверхности среды над конденсационной водой. Бактерии, обладающие активной подвижностью, вырастут не только в конденсационной воде, но и вне ее, на поверхности МПА. Из верхней части роста производят повторно посев в конденсат свежей питательной среды. Производя таким образом несколько пересевов, в конце концов получают чистую культуру подвижных бактерий.
4. Выделение патогенных микроорганизмов
Чистые культуры патогенных бактерий выделяют путем заражения исследуемым материалом лабораторных животных, наиболее восприимчивых к тому или иному возбудителю.
После гибели животного из крови и органов трупа делают посевы на питательные среды, на которых в большинстве случаев вырастает чистая культура возбудителя (этот метод подробно представлен в разделе «Заражение лабораторных животных»).
Задания для самостоятельной работы
1. Приготовить мазки-препараты из смеси бактерий, окрасить по Граму и провести микроскопию.
2. Овладеть техникой посева на скошенный МПА и МПБ.
3. Освоить методы и приемы выделения чистой культуры бактерий (1-й день исследования);
а) из смеси бактерий произвести рассев на солевой МПА для выделения чистой культуры стафилококка;
б) из смеси бактерий произвести рассев на среде Эндо для выделения чистой культуры кишечной палочки;
в) взвесь бактерий прогреть в течение 10 мин при 80° или 2-3 мин при 100°. Прогретую взвесь микробов рассеять на МПА для выделения чистой культуры вакцинного штамма сибиреязвенной палочки.
4. Посевы поместить в термостат и ознакомиться с его устройством.
5. Сведения о проделанной работе внести в бланк экспертизы.
Вопросы для самоподготовки и контроля знаний
1. Найдите каждому определению соответствующий термин:
1. Популяция микробов, состоящая из особей одного вида.
2. Культура микроорганизмов, полученная из одной особи (одноклеточная культура).
3. Культура микробов одного вида, выделенная из определенного источника (организм животного, окружающая среда).
4. Культура микроорганизмов одного вида, различающаяся по некоторым признакам (в пределах характеристики вида).
А. Клон. В. Вариант.
Б. Штамм. Г. Чистая культура.
2. В ветеринарную лабораторию поступил исследуемый материал после убоя животного с подозрением на туберкулез. Какой обработке необходимо подвергнуть материал перед посевом для выделения возбудителей туберкулеза?
А. Прогреть при 80° 2-3 мин.
Б. Обработать 6%-ным раствором серной кислоты в соотношении 1:6.
В. Засеять без обработки.
3. В ветеринарную лабораторию поступил несвежий патологический материал (кусочки мышц) после гибели коровы с подозрением на эмфизематозный карбункул. Какой обработке необходимо подвергнуть материал перед посевом для выделения возбудителя?
А. Прогреть при 80° 15-20 мин.
Б. Обработать 6%-ным раствором серной кислоты в соотношении 1:6.
В. Засеять без обработки.
4. В ветеринарную лабораторию на экспертизу поступили пробы мяса после вынужденного убоя животного. Необходимо исключить присутствие в них вульгарного протея, который может вызвать массовые отравления людей. Какой метод используете для выделения чистой культуры этого микроба?
А. Рассев на МПА в чашках Петри.
Б. Прогрев материала с последующим посевом на МПА.
Г. Посев на скошенный МПА в конденсат.
5. В ветеринарную лабораторию поступил исследуемый материал (ухо) от павшей нетели с подозрением на сибирскую язву. Какой метод используете для выделения чистой культуры возбудителя?
Источник