- А. Эндокринное, паракринное и аутокринное действие гормонов
- Статьи раздела «Уровень и иерархия гормонов»:
- Структура:
- Списки:
- Сложность материала:
- Величины и единицы:
- Паракринный способ регуляции это
- 4.3.1. Эндокринная, паракринная и аутокринная регуляция
- 4.3.2. Митогенная «рефлекторная дуга»
- Медицинская учебная литература
- Учебная медицинская литература, онлайн-библиотека для учащихся в ВУЗах и для медицинских работников
- ПАТОФИЗИОЛОГИЯ ОПУХОЛЕВОГО РОСТА
- Молекулярные механизмы клеточного деления
- Эндокринная регуляция.
- Паракринная регуляция.
- Аутокринная регуляция.
- Ростовые факторы (регуляторы пролиферации).
- Рецепторы к ростовым факторам.
- Ras-белки..
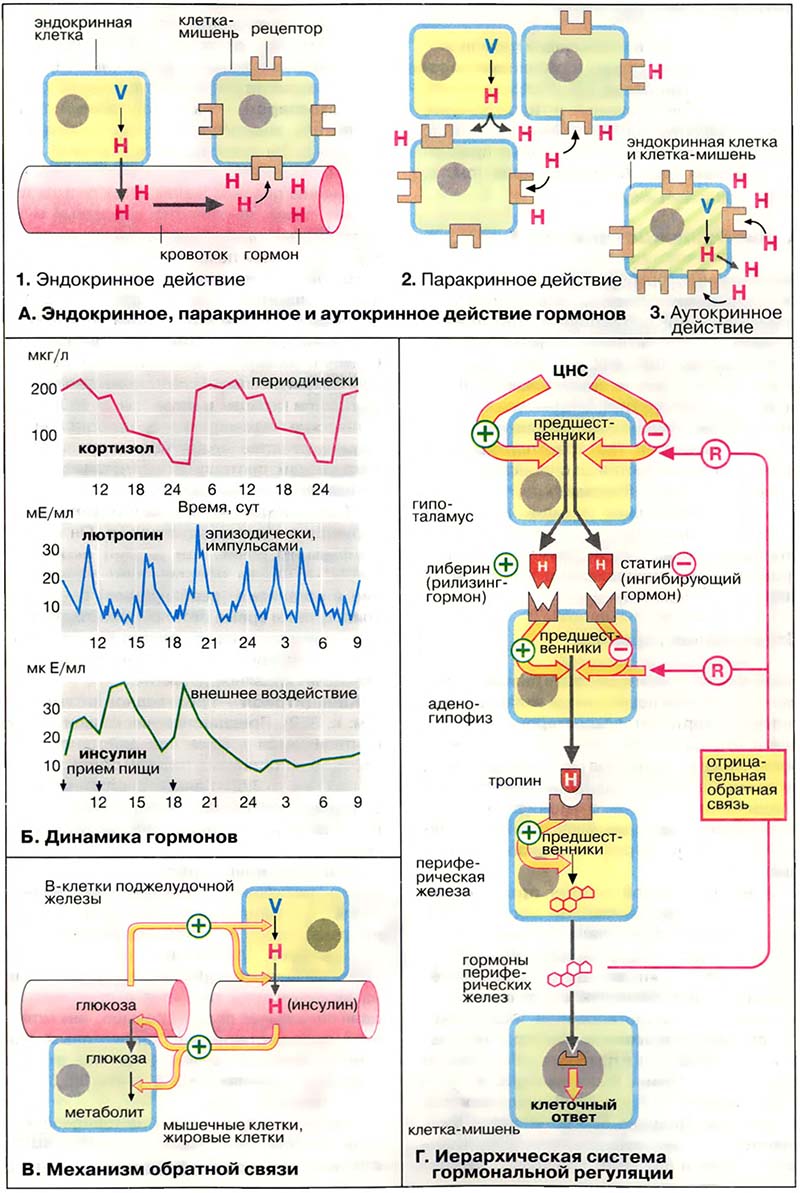
А. Эндокринное, паракринное и аутокринное действие гормонов
Главная / — Далее Разделы / А. Эндокринное, паракринное и аутокринное действие гормонов
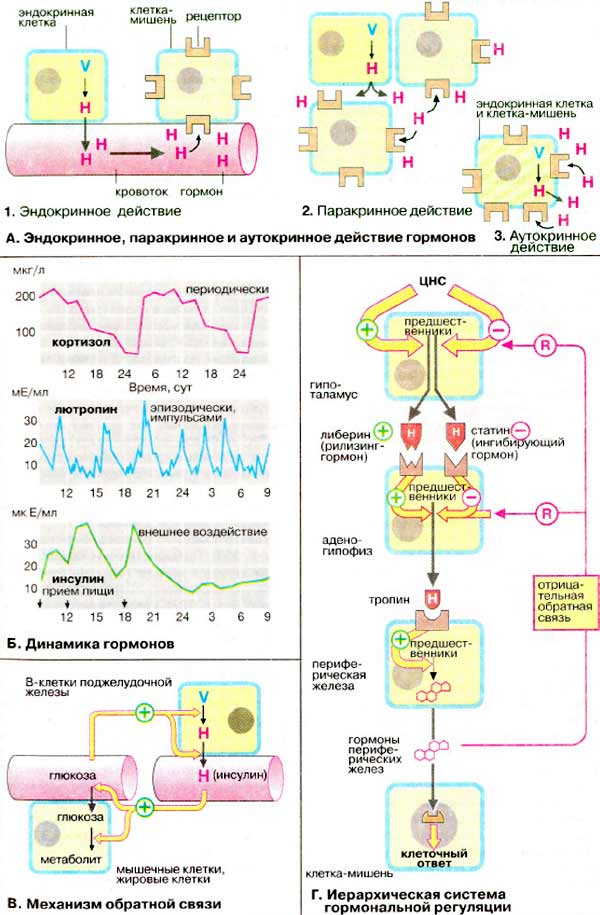
Гормоны передают сигнал путём переноса в кровотоке от места синтеза до клеток-мишеней. В этом случае говорят об эндокринном действии (1; пример: инсулин). В случае тканевых гормонов (паратгормон) локального действия, когда клетки-мишени расположены в непосредственной близости к секреторным клеткам, говорят о паракринном действии (2; пример: гормоны желудочно-кишечного тракта). Когда сигнальные вещества продуцируются и утилизируются в самих клетках, говорят об аутокринном действии (3; пример: простагландины).
Инсулин, образуемый B-клетками поджелудочной железы, оказывает как эндокринное, так и паракринное действие. Такой способ действия характерен для многих гормонов. Как гормон эндокринного действия инсулин принимает участие в регуляции обмена жиров и глюкозы. По механизму паракринного действия инсулин ингибирует образование и секрецию глюкагона A-клетками поджелудочной железы.
Статьи раздела «Уровень и иерархия гормонов»:
- А. Эндокринное, паракринное и аутокринное действие гормонов
- Б. Динамика гормонов
- В. Механизм обратной связи
- Г. Иерархическая система гормональной регуляции
Структура:
Списки:
Сложность материала:
Величины и единицы:
Справочное издание в наглядной форме — в виде цветных схем — описывает все биохимические процессы. Рассмотрены биохимически важные химические соединения, их строение и свойства, основные процессы с их участием, а также механизмы и биохимия важнейших процессов в живой природе. Для студентов и преподавателей химических, биологических и медицинских вузов, биохимиков, биологов, медиков, а также всех интересующихся процессами жизнедеятельности.
Сайт не является средством массовой информации. Аудитория — 16+.
Источник
Паракринный способ регуляции это
Гормоны. Гормональная система
Уровень и иерархия гормонов
Гормоны передают сигнал путем переноса в кровотоке от места синтеза до клеток-мишеней. В этом случае говорят об эндокринном действии ( 1 ; пример: инсулин ). В случае тканевых гормонов (паратгормон) локального действия, когда клетки-мишени расположены в непосредственной близости к секреторным клеткам, говорят о паракринном действии ( 2 ; пример: гормоны желудочно-кишечного тракта ). Когда сигнальные вещества продуцируются и утилизируются в самих клетках, говорят об аутокринном действии ( 3 ; пример: простагландины ). Инсулин, образуемый B-клетками поджелудочной железы, оказывает как эндокринное, так и паракринное действие. Такой способ действия характерен для многих гормонов. Как гормон эндокринного действия инсулин принимает участие в регуляции обмена жиров и глюкозы. По механизму паракринного действия инсулин ингибирует образование и секрецию гпюкагона А-клетками поджелудочной железы.
Б. Динамика гормонов
Гормоны циркулируют в крови в очень низких концентрациях (10 -7 -10 -12 М). Однако эти величины сильно варьируют. Концентрация гормонов подвержена периодическим колебаниям , цикл или ритм которых может зависеть от времени дня, месяца, времени года или менструального цикла. В качестве примера можно привести околосуточный (циркадианный) ритм кортизола. Многие гормоны поступают в кровь импульсами и нерегулярно. Поэтому концентрация гормона может меняться эпизодически , т. е. пульсировать . Концентрация другой группы гормонов изменяется в зависимости от внешних факторов . Выброс гормонов является ответом организма на внешнее воздействие или на изменение внутреннего состояния.
Концентрация гормонов в крови находится под строгим контролем, причем контроль осуществляется как на стадии синтеза, так и на стадии выброса. Скорость этих процессов регулируется по принципу обратной связи или системой, построенной по иерархическому принципу.
В. Механизм обратной связи
Биосинтез и выброс инсулина В-кпетками поджелудочной железы стимулируется высоким уровнем глюкозы ( >5 мМ). Инсулин индуцирует потребление глюкозы в мышечных и жировых тканях. В результате уровень глюкозы снижается до нормы (примерно 5 мМ) и выброс инсулина прекращается (см. с. 162).
Г. Иерархическая система гормональной регуляции
Гормональные системы обычно взаимосвязаны и в раде случаев образуют иерархическую лестницу. Наиболее важной из них является система гормонов гипофиза и гипоталамуса , контролируемая центральной нервной системой (ЦНС). На стимулирующее или тормозящее воздействие нервные клетки гипоталамуса отвечают выбросом стимулирующих или ингибирующих гормонов, которые носят групповое название либерины («рилизинг-факторы») и статины («ингибирующие гормоны»). Эти нейрогормоны через короткие сосуды достигают аденогипофиза, где стимулируют (либерины) или ингибируют (статины) биосинтез и секрецию так называемых тропинов. Гонадотропины , например, симулируют биосинтез стероидных гормонов в половых железах. Стероидные гормоны действуют только на клетки-мишени, а по механизму обратной связи, подавляют синтез или секрецию других гормонов регуляторного каскада.
К этой гормональной иерархической лестнице принадлежат многие важнейшие гормоны, такие, как тироксин, кортизол, эстрадиол, прогестерон и тестостерон.
Источник
4.3.1. Эндокринная, паракринная и аутокринная регуляция
В организме существует два типа физиологической регуляции клеточного размножения — эндокринная и паракринная (рис. 4.1). Эндокринная регуляция осуществляется специализированными органами (железами внутренней секреции), в
числе которых — гипофиз, надпочечники, щитовидная, пара-щитовидная, поджелудочная и половые железы. Они секрети-руют продукты своей активности в кровь и оказывают генерализованное воздействие на весь организм.
Паракринная регуляция отличается от эндокринной тем, что секретируемые клетками активные вещества распространяются диффузией и действуют на соседние клетки-мишени. Есть множество действующих таким образом митогенных стимуляторов (полипептидных ростовых факторов): эпидермаль-ный фактор роста, фактор роста тромбоцитов, интерлейкин-2 (фактор роста Т-клеток), фактор роста нервов и т.д.
Аутокринная регуляция [Sporn, Todaro, 1980] отличается от паракринной регуляции тем, что одна и та же клетка является и источником ростового фактора, и его мишенью. Результат — непрекращающееся, самоподдерживающееся митогенное «возбуждение» клетки, приводящее к нерегулируемому размножению. В данной ситуации клетка не нуждается в исходящих из организма митогенных стимулах и становится в этом отношении полностью автономной. Хотя эта модель была предложена авторами для объяснения механизма вирусного канцерогенеза, различные ее модификации применимы, по-видимому, и для многих других канцерогенных ситуаций.
4.3.2. Митогенная «рефлекторная дуга»
В регуляции сложных систем, как бы различны они ни были, обнаруживаются общие черты. Так, можно уловить
Фактор роста
ФаКТОрЫ ТраНСКрИПЦИИ Гимтпч иРЫК
Ч
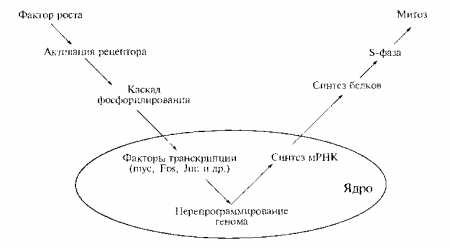
Рис. 4.2. «Рефлекторная дуга» митогенного сигнала. Пояснения в тексте.
принципиальное сходство между рефлекторной активностью животного и митотической активностью клетки (рис. 4.2).
В обеих ситуациях на периферии системы существуют различные специализированные рецепторы (глаз, ухо, тактильные и обонятельные — в первом случае; рецепторы ростовых факторов — во втором); в обеих ситуациях воспринимаемые рецепторами внешние сигналы центростремительным потоком передаются внутрь системы (в виде импульсов по чувствительным нервам или в виде каскадов реакций фосфорилирования), и, наконец, в обеих ситуациях после обработки сигнала в центре (в центральной нервной системе или в клеточном ядре) соответствующий центробежный поток (в виде импульсов по двигательным нервам или в виде молекул мРНК) поступает к исполнительным органам и индуцирует их активность (двигательную, секреторную и т.п. — в первом случае и митотическую — во втором).
Перенос митогенного сигнала от периферии клетки к ее центру (генетическому аппарату) осуществляется в виде каскада реакций фосфорилирования посредством протеинкиназ (ферментов, фосфорилирующих белки). Существует три типа протеинкиназ (тирозиновые, сериновые и треониновые) в зависимости от их способности фосфорилировать определенные аминокислоты. Фосфатные группы играют роль молекулярных переключателей: меняя конформацию определенных белковых структур (доменов), они могут «включать» или «выключать» их активность (имеются в виду ферментативная активность, ДНК-связывающая способность и способность образовывать белок-белковые комплексы).
Центростремительная волна митогенной импульсации в максимально упрощенном виде сводится к передаче фосфатной группы, наподобие эстафетной палочки, от одной протеинкиназы к другой. В конечном итоге она достигает ядерных регуляторных белков (транскрипционных факторов), активирует их (тоже посредством фосфорилирования) и тем самым индуцирует перепрограммирование генома. Необходимо отметить, что активность протеинкиназ практически на любом этапе переноса митогенного сигнала уравновешивается активностью противодействующих им ферментов — дефосфорили-рующих белки фосфатаз. Баланс позитивных и негативных эффектов — фундаментальное свойство регуляции клеточного деления, проявляемое на любом его уровне.
Противоположно направленный (центробежный, т.е. из ядра в цитоплазму) поток информации в виде молекул мРНК обусловливает специфическую реакцию клетки на митогенный сигнал — синтезируется множество новых белков, выполняющих структурные, ферментативные и регуляторные функции.
Следует отметить еще ряд характерных особенностей механизма митогенной стимуляции. Во-первых, участвующие в нем белки, как правило, не уникальны, а образуют семейства, члены которых объединены сходством структуры и функции, но различаются в деталях (в частности, субстратной специфичностью, активностью, сайтами фосфорилирования, способностью связываться со специфическими последовательностями ДНК и т.д.). Это свойство обеспечивает гибкость, пластичность и надежность всего механизма.
Во-вторых, сигнальные белки во многих случаях имеют четко выраженное доменное (или модульное) строение. Имеется в виду подразделение молекулы белка на отдельные структурно-функциональные блоки (см., в частности, строение рецепторов ростовых факторов на рис. 4.4). Другим примером может служить структурная организация регуляторных белков, в которых можно вычленить ДНК-связывающий и трансактивирующий домены (см. далее). Функционально близкие домены обладают структурным сходством даже у очень отдаленных в эволюционном отношении видов, что делает компьютерный поиск гомологий чрезвычайно эффективным средством выяснения функций новых белков (именно таким способом были сделаны многие важные открытия).
В-третьих, в структуре многих сигнальных белков существуют своеобразные «стыковочные узлы» (docking sites) разных типов, предназначенные для белок-белковых взаимодействий. Поскольку одна молекула может обладать несколькими такими участками, существует возможность самосборки очень сложных многокомпонентных конструкций, необходимых и для переноса сигнала, и для регуляции транскрипции. Присоединение к конструкции новых элементов иногда обозначают
термином «рекрутирование». Одни и те же структурные блоки могут формировать существенно разные конструкции, что наделяет систему функциональной гибкостью и свойством взаимозаменяемости отдельных ее элементов.
В-четвертых, линейные сигнальные пути не изолированы, а взаимодействуют друг с другом, что ведет к формированию сложных функциональных сетей.
В-пятых, нерегулируемое размножение трансформированной клетки можно представить, если продолжить аналогию с рефлекторной дугой как следствие возникновения очага «застойного» возбуждения в том или ином звене пути переноса митогенного сигнала. Повреждение гена и как следствие — структурный дефект какого-либо из сигнальных белков, способный зафиксировать его в постоянно активном состоянии (т.е. сделать независимым от «вышестоящих» регуляторных инстанций), — один из главных механизмов канцерогенеза. Нормальные гены, участвующие в переносе митогенного сигнала и потенциально способные на такое превращение, называются протоонкогенами.
В-шестых, баланс позитивных и негативных факторов, как уже отмечалось выше, — фундаментальное свойство любой сложной регуляторной системы, в том числе и управляющей клеточным делением. Протоонкогены — элементы позитивной регуляции; они являются акселераторами клеточного деления и в случае превращения в онкогены проявляют себя как доминантный признак. Вместе с тем в давних опытах образования ге-терокарионов (продуктов слияния клеток в культуре) установлено, что свойство туморогенности (способности образовывать опухоли при перевивке животным) ведет себя как признак рецессивный: гетерокарионы, образованные слиянием нормальных и трансформированных клеток, ведут себя как нормальные. Это указывает на присутствие в нормальных клетках неких негативных (тормозящих клеточное деление) факторов, способных при внесении в опухолевую клетку нормализовать ее. В последующем такие белковые факторы были идентифицированы; кодирующие их гены получили название генов-супрессоров. Полная трансформация клетки, таким образом, является следствием нескольких генетических событий: активации онкогена(ов) и инактивации гена(ов), осуществляющих супрессорные функции.
Источник
Медицинская учебная литература
Учебная медицинская литература, онлайн-библиотека для учащихся в ВУЗах и для медицинских работников
ПАТОФИЗИОЛОГИЯ ОПУХОЛЕВОГО РОСТА
Молекулярные механизмы клеточного деления
Опухолевый рост является следствием нарушения тканевого гомеостаза, поддерживаемого балансом клеточной пролиферации и гибели (апоптоза). Увеличение клеточной массы опухоли может быть обусловлено как усилением пролиферации, так и угнетением апоптоза. Вероятность «сбоев» в механизмах поддержания этого гомеостаза вполне реальна в условиях канцерогенного воздействия факторов внешней среды.
Наследуемые нарушения механизмов тканевого гомеостаза обусловлены теми или иными повреждениями структуры ДНК.
Нормальная делящаяся клетка с поврежденной ДНК либо прекращает деление до полной репарации повреждений, либо самоуничтожается (апоптоз). Последний вариант предпочтительней, поскольку потеря клетки может не иметь никаких последствий. Сохранение такой клетки таит для организма смертельную угрозу возникновения клона дефектных (потенциально опухолевых) клеток. Опухолевый рост возможен лишь тогда, когда дефектные клетки способны «проскальзывать» через защитный барьер апоптоза.
Ниже приведено краткое описание нарушений, обусловливающих трансформацию нормальных клеток в злокачественные.
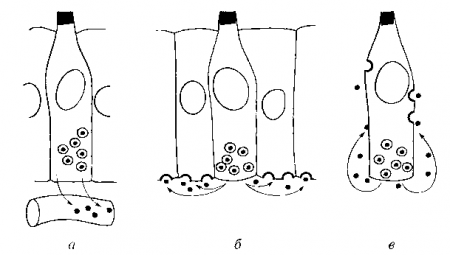
В организме существуют два типа физиологической регуляции клеточного размножения — эндокринная и паракринная (рис. 12.1). Регуляторные молекулы секретируются клеткой и действуют вовне (через кровоток, на соседние клетки или себя). Утолщенные полукружия, изображенные на поверхности клеточной мембраны, — рецепторные участки.
Эндокринная регуляция.
Она осуществляется железами внутренней секреции (гипофиз, надпочечники, щитовидная, околощитовидная, поджелудочная и половые железы). Они секретируют продукты своей активности в кровь и оказывают генерализованное воздействие на весь организм.
Паракринная регуляция.
В отличие от эндокринной паракринная регуляция заключается в том, что секретаруемые клетками активные вещества распространяются за счет диффузии и действуют на соседние клетки-мишени. Так действуют, например, митогенные стимуляторы (полипептидные ростовые факторы) — эпидермальный фактор роста, фактор роста тромбоцитов, интерлейкин-2 (фактор роста Т-клеток), фактор роста нервов и т.д.
Рис. 12.1. Схема эндокринной (а), паракринной (б) и аутокринной (в) регуляции
Аутокринная регуляция.
Она отличается от паракринной регуляции тем, что одна и та же клетка является источником ростового фактора и его мишенью. В результате может возникать феномен непрекращающегося, самоподдерживающегося митогенного «возбуждения» клетки, приводящего к нерегулируемому размножению. Клетка не нуждается во внешних митогенных стимулах и становится полностью автономной. С помощью аутокринной регуляции можно объяснить механизмы канцерогенеза. Для этого вначале разъясним понятие, называемое митогенной «рефлекторной дугой».
Рис. 12.2. «Рефлекторная дуга» митогенного сигнала
В регуляции сложных систем, как бы различны они не были, обнаруживаются общие черты. Между рефлекторной активностью организма и митотической активностью клетки есть принципиальное сходство (рис. 12.2).
Суть заключается в том, что на периферии системы (организм, клетка) существуют различные специализированные рецепторы (глаз, ух о, тактильные и обонятельные — в первом случае; рецепторы ростовых факторов — во втором); воспринимаемые ими внешние сигналы передаются внутрь системы (в виде импульсов по чувствительным нервам или в виде каскадов реакций фосфорилирования); затем происходит обработка сигнала в центре (центральной нервной системе пли в клеточном ядре) и информация центробежно (в виде импульсов по двигательным нервам или с помощью молекул мРНК) поступает к исполнительным органам и индуцирует их активность (двигательную, секреторную — в первом случае и митотическую — во втором).
Перенос митогенного сигнала от периферии клетки к ее ядру осуществляется в виде каскада реакций фосфорилирования посредством протеин-киназ (ферментов, фосфорилирующих белки). Существует три типа протеинкиназ (тирозиновые, сери новые и треониновые) по их способности фосфорилировать определенные аминокислоты. Фосфатные группы играют роль молекулярных переключателей: меняя конформацию определенных белковых структур (доменов), они могут «включать» или «выключать» их активность (имеются в виду ферментативная активность, ДНК-связывающая способность и способность образовывать белок-белковые комплексы).
Центростремительная волна митогенной импульсации в максимально упрощенном виде сводится к передаче фосфатной группы наподобие эстафетной палочки от одной протеин-киназы к другой. В конечном итоге она достигает ядерных регуляторных белков, активирует их посредством фосфорилирования и тем самым индуцирует перепрограммирование генома. Необходимо отметить, что активность протеинкиназ практически на любом этапе переноса митогенного сигнала уравновешивается активностью противодействующих им ферментов —-дефосфорилирующих белки фосфатаз. Баланс позитивных и негативных эффектов — фундаментальное свойство регуляции клеточного деления, проявляемое на любом его уровне.
Противоположно направленный (центробежный, из ядра в цитоплазму) поток информации в виде молекул мРНК обусловливает специфическую реакцию клетки на митогенный сигнал — синтезируется множество новых белков, выполняющих структурные, ферментативные и регуляторные функции.
В структуре многих сигнальных белков существуют своеобразные «стыковочные узлы» разных типов, предназначенные для белок-белковых взаимодействий. Поскольку одна молекула может обладать несколькими такими участками, то существует возможность самосборки очень сложных многокомпонентных конструкций, необходимых для переноса сигнала и для регуляции транскрипции. Присоединение к конструкции новых элементов иногда обозначают термином «рекрутирование». Одни и те же структурные блоки могут формировать существенно разные конструкции, что наделяет систему функциональной гибкостью и свойством взаимозаменяемости отдельных ее элементов.
Нерегулируемое размножение трансформированной клетки можно представить, если продолжить аналогию с рефлекторной дугой, как следствие возникновения очага «застойного» возбуждения в том или ином звене пути переноса митогенного сигнала. Повреждение гена и, как следствие, структурный дефект какого-либо из сигнальных белков, способный зафиксировать его в постоянно активном состоянии (т.е. сделать независимым от «вышестоящих» регуляторных инстанций), — один из главных механизмов канцерогенеза.
Нормальные гены, участвующие в переносе митогенного сигнала и потенциально способные на такое превращение, называются протоонкогенами.
Баланс позитивных и негативных факторов, как уже отмечалось выше, — фундаментальное свойство любой сложной регуляторной системы, в том числе и управляющей клеточным делением. Протоонкогены — элементы позитивной регуляции; они являются акселераторами клеточного деления и в случае превращения в онкогены проявляют себя как доминантный признак.
Вместе с тем в давних опытах по образованию гетерокарионов (продуктов слияния клеток в культуре) установлено, что свойство туморогенности (способности образовывать опухоли при перевивке животным) ведет себя как признак рецессивный — гетерокарионы. образованные слиянием нормальных и трансформированных (опухолевых) клеток, ведут себя как нормальные. Таким образом, в нормальных клетках явно присутствуют факторы, тормозящие клеточное деление и способные при внесении в опухолевую клетку нормализовать ее. Многие из этих белковых факторов идентифицированы; кодирующие их гены получили название генов-супрессоров.
Рис. 12.3. Схема клеточного цикла (пояснения в тексте)
Итак, полная трансформация клетки является следствием нескольких генетических событий — активации онкогена(ов) и инактивации гена(ов), осуществляющих супрессорные функции.
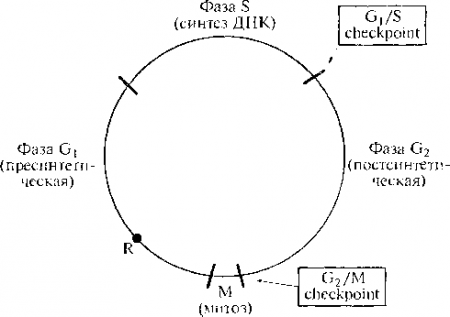
В основе канцерогенеза лежит нарушение цикла деления. Клетки организма находятся в одном из трех возможных состояний (рис. 12.3):
- в цикле;
- в стадии покоя с сохранением возможности вернуться в цикл;
- в стадии окончательной дифференцировки, при которой способность делиться полностью утрачена (таковы, например, нейроны головного мозга). Образовывать опухоли могут, естественно, только клетки, способные делиться.
Цикл удвоения разных клеток человека существенно варьирует: от 18 ч у клеток костного мозга до 50 ч у клеток крипт толстой кишки. Основными его периодами являются митоз (М) и синтез ДНК (фаза S), между которыми выделяют два промежуточных периода — G, и G2. Вовремя интерфазы (период между двумя делениями) клетка растет и готовится к митозу.
На протяжении фазы G1 существует ответственный момент (так называемая точка рестрикции R), когда решается, войдет ли клетка в следующий цикл деления или предпочтет стадию покоя G0, в которой она может находиться неопределенно долго. Как уже упоминалось, окончательно дифференцированные клетки постоянно находятся в стадии покоя, тогда как сохранившие способность к делению могут вернуться в цикл при соответствующей стимуляции внешними факторами, причем последующие этапы совершаются автоматически.
В отличие от «асоциальной» опухолевой клетки нормальная клетка подчиняется исходящим из организма сигналам (митогенный стимул). Если в определенный момент у нормальной клетки есть необходимые условия (достаточная масса и содержание белков, концентрация кальция, обеспеченность питательными веществами) и она к тому же получает митогенный стимул, то она вступает в очередной цикл деления. В отсутствие внешнего сигнала нормальная клетка выходит из цикла и в этом заключается ее коренное отличие от клетки опухолевой, которая побуждается к делению эндогенными стимулами.
При делении клетки есть два критически важных момента: фаза синтеза ДНК и вхождение в митоз, когда действуют своеобразные «контрольно-пропускные пункты» ( checkpoints ). В этих «пунктах» проверяется готовность к удвоению (репликации) ДНК (в первом случае) и завершенность репликации (во втором случае). Если в клетке ДНК повреждена, то ее удвоение блокируется перед началом деления. Следовательно, блокируется этап, способный закрепить повреждения ДНК и передать их потомству. Аналогичная цель достигается апоптозом, причем какой путь выберет клетка (блокировку деления или апоптоз) зависит от многих условий.
Процесс репликации ДНК продолжается несколько часов. За это время весь генетический материал должен быть воспроизведен абсолютно точно. В случае каких-либо отклонений продвижение клетки в цикле блокируется или она может подвергнуться апоптозу. Если же дефектны сами «контрольно-пропускные пункты», то дефекты генома не устраняются, передаются потомству и возникает опасность злокачественной трансформации клетки.
Как говорилось ранее, для деления клетки необходим митогенный сигнал, перенос которого — процесс многоэтапный.
В зависимости от типа клетки и конкретного митогенного стимула реализуется один из множества сигнальных путей. Например, ростовые факторы действуют путем, опосредованным тирозинпротеинкиназными рецепторами и MAP (mitogen activated protein) — киназным каскадом, т.е. каскадом реакций фосфорирования, возникающим как следствие митогенной активации клетки.
Ростовые факторы (регуляторы пролиферации).
Ростовые факторы секретируются одними клетками и действуют паракринным образом на других. Это небольшие белки; полипептидная цепь EGF (epidermal growth factor) состоит, например, из 53 аминокислот. Существует несколько семейств ростовых факторов, члены каждого из которых объединены структурной гомологией и функциональным сходством. Одни из них стимулируют пролиферацию (например, EGF и PDGF — platelet-derived growth factor, тромбоцитарный фактор роста), а другие (TGF-p, TNF, интерфероны) — подавляют ее.
Рецепторы к ростовым факторам.
Рецепторы расположены на клеточной поверхности. Каждая клетка обладает своим особым набором рецепторов и соответственно — набором ответных реакций. Тирозинкиназные рецепторы состоят из нескольких доменов: внеклеточного (взаимодействующего с лигандом), трансмембранного и подмембранного, обладающего тирозин-протеинкиназной активностью.
При связывании с ростовыми факторами (например EGF) молекулы рецепторов инициируют реакции, вследствие чего возникает трансмембранный перенос сигнала — зарождение той волны «возбуждения», которая распространяется затем в виде каскада реакций фосфорилирования внутрь клетки и благодаря которой митогенный стимул достигает в конце концов генетического аппарата ядра.
Ras-белки..
Одним из наиболее важных является сигнальный путь с участием Ras-белков (это подсемейство так называемых G-белков, образующих комплексы с гуаниловыми нуклеотидами; Ras-GTP — активная форма, Ras-GDP — неактивная). Этот путь один из основных в регуляции клеточного деления у высших эукариот — настолько консервативен, что его компоненты способны заменить соответствующие гомологи в клетках дрозофилы, дрожжей и нематод. Он опосредует разнообразные сигналы, исходящие из внешней среды, и функционирует, по всей вероятности, в каждой клетке организма. Ras-белки играют роль своеобразного турникета, через который должен пройти почти любой из поступающих в клетку сигналов. Критическая роль этого белка в регуляции клеточного деления известна с середины 80-х г. XX в., когда активированная форма соответствующего гена (онкоген Ras) была обнаружена во многих опухолях человека.
Ras-опосредованный сигнальный путь контролирует так называемый МАР-киназный каскад. Активность ферментов, участвующих в киназных каскадах, уравновешивается активностью противодействующих им и находящихся под столь же строгим контролем фосфатаз. Результатом активации МАР-киназ является индукция ряда факторов транскрипции и, как следствие, стимуляция активности ряда генов.
Таким образом, если в нормальной клетке активная конформация сигнального белка формируется лишь под воздействием внешнего стимула и имеет транзиторный характер, то в клетке трансформированной (и ее клонах) она закреплена постоянно.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник