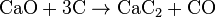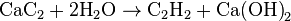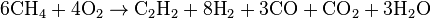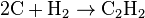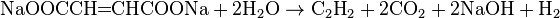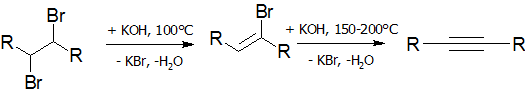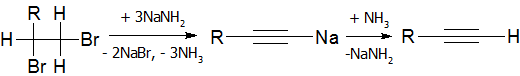- Методы получения алкинов. Получение ацетилена
- Основной способ получения ацетилена
- Применение ацетилена
- Способы получения ацетилена
- Промышленный способ получения ацетилена отражает уравнение реакции
- Ацетилен, получение, свойства, химические реакции
- Ацетилен, получение, свойства, химические реакции.
- Ацетилен, формула, газ, характеристики:
- Физические свойства ацетилена:
- Химические свойства ацетилена:
- Получение ацетилена в промышленности и лаборатории. Химические реакции – уравнения получения ацетилена:
- Применение и использование ацетилена:
- Взрывоопасность ацетилена и безопасность при обращении с ним:
Методы получения алкинов. Получение ацетилена



Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
Карбидный метод (промышленный способ)
Прокаливанием в электрических печах смеси оксида кальция с коксом при 1800—2000°С получают карбид кальция:
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
Пиролиз углеводородов (промышленный способ)
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который сгорая поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана:
Крекинг природного газа (промышленный способ)
Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением.
В этом методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании:
Метод прямого синтеза
Углерод напрямую взаимодействует с водородом при очень высоких температурах:
Этот метод имеет чисто историческое значение (получение ацетилена в 1863 году М. Бертло).
Электролиз солей непредельных карбоновых кислот
В 1864 году Кекуле получил ацетилен электролизом фумарата и малеата натрия:
Аналогично получается ацетилен и из акрилата натрия.
Этот метод носит чисто историческое значение.
Дегидрогалогенирование галогеналканов и галогеналкенов (лабораторный способ)
Реакция дегидрогалогенирования проводят действием сильного основания на дигалогеналканы:
В качестве дегидрогалогенирующего агента удобно использовать амид натрия в жидком аммиаке:
Получение Ацетилена
В лаборатории ацетилен получают действием воды на карбид кальция.
CaC2+ 2 Н2О = С2Н2↑ + Са(ОН)2
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Источник
Основной способ получения ацетилена
Применение ацетилена
Ацетилен, как промышленный газ, применяется при производстве многих продуктов оргсинтеза. С его помощью получают:
- синтетический каучук;
- пластмассы;
- растворители;
- уксусную кислоту и т.д.
Способы получения ацетилена
Применяются три варианта получения ацетилена:
- химический способ использует генератор – устройство, в которое загружают кусковый карбид кальция и заливают его водой. Химическая реакция выделяет горючий газ, который сразу используется. Один килограмм карбида дает 380 дм3 газа, а в генератор его загружают до 5 кГ;
- электропиролиз, реализующий разложение нефти или керосина в электродуговом разряде. Расход электроэнергии при таком способе очень большой, поэтому его применяют редко;
- термоокислительный пиролиз метана — готовый продукт дешевле “карбидного” на 30-40%.
Пиролизный ацетилен закачивают в заполненный пористой массой баллон. Для снижения его взрывоопасности, наполнитель (кизельгур, асбест, активированный уголь) пропитывают ацетоном. Растворенный в нем ацетилен удерживается в порах наполнителя. Отсюда и название — растворенный. Баллон на 40 литров вмещает 6 кГ ацетилена и всегда готов к работе, чего не скажешь про карбидный генератор: его надо загрузить реагентом, заправить водой, отрегулировать подачу газа всякий раз, когда начинается рабочий день. Для чистки бака от накипи применяется кислота сульфаминовая. Больших отличий продукта при любом варианте технологий нет, но более дешевый и безопасный в эксплуатации – пиролизный, почему он признан основным для производства ацетилена.
Источник
Промышленный способ получения ацетилена отражает уравнение реакции
Промышленный способ получения ацетилена отражает уравнение реакции: ?
АЦЕТИЛЕН (от лат. acetum-уксус и греч. hyle — лес, дерево; вещество) (этин) СНСН, мол. м. 26,04; бесцв. газ; т. пл. -81°С/1277мм рт. ст. , т. возг. -84,1°С; т. кип. -83,8°С; плотн. 1,0896 г/л (газ; 20°С; 101 кПа) ; Н°о6р -227,400 кДж/моль (газ; 298,15 К), Н°сгор — 1307 кДж/моль; Сpo 44,036 Дж/(моль*К) ; давление пара жидкого А. (МПа) : 1,1 (-30°С) , 2,6 (0°С) , 5,4 (30°С) ; tкрит 35,2°С, pкрит 6,4 МПа; макс. т-ра кислородно-ацетиленового пламени 3150°С (при содержании А. 45% по объему) , воздушно-ацетиленовой смеси 2350 °С. Р-римость (объемы А. ) в 1 объеме р-рителя при 15°С и 101 кПа: в воде-1,15; ацетоне-25 (при 1,2 МПа-300; при -80°С и 0,1 МПа-2000); спирте-6; бензоле-4; уксусной к-те-6 (18°С) ; ДМФА -33,5 (25 °С) .
Атомы углерода в А. sp-гибридизованы. Они связаны однойи двумясвязями, макс. плотности к-рых расположены в двух взаимно перпендикулярных областях, образуя цилиндрич. облакоэлектронной плотности; за его пределами находятся атомы Н (см. рис.) .
Получение ацетилена и его горение
Ацетилен в лаборатории получают действием воды на карбид кальция. Карбид кальция очень энергично взаимодействует с водой. Для замедления реакции на практике можно использовать насыщенный раствор поваренной соли. В этом случае реакция протекает более спокойно.
Прильем из капельной воронки раствор хлорида натрия в колбу с карбидом кальция. Наблюдаем выделение газа. Это — ацетилен. Вторым продуктом реакции является гидроксид кальция.
СаС2 + 2 Н2О = С2Н2 + Са (ОН) 2
Оборудование: колба Вюрца, капельная воронка, газоотводная трубка, штатив.
Техника безопасности. Соблюдать правила работы с горючими газами, поджигать ацетилен можно только после проверки на чистоту
Источник
Ацетилен, получение, свойства, химические реакции
Ацетилен, получение, свойства, химические реакции.
Ацетилен, C2H2 – органическое вещество класса алкинов, непредельный углеводород.
Ацетилен, формула, газ, характеристики:
Ацетилен (также – этин) – органическое вещество класса алкинов, непредельный углеводород , состоящий из двух атомов углерода и двух атомов водорода.
Химическая формула ацетилена C2H2. Структурная формула ацетилена СH≡CH. Изомеров не имеет.
Строение молекулы ацетилена:
Ацетилен имеет тройную связь между атомами углерода .
Ацетилен – бесцветный газ, без вкуса и запаха. Однако технический ацетилен содержит примеси – фосфористый водород , сероводород и пр., которые придают ему резкий запах.
Легче воздуха . Плотность по сравнению с плотностью воздуха 0,9.
Очень горючий газ . Пожаро- и взрывоопасен.
Ацетилен относится к числу немногих соединений, горение и взрыв которых возможны в отсутствии кислорода или других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом , метаном или пропаном .
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух , может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны , заполненные пористым материалом, пропитанным ацетоном. В них ацетилен хранится в виде раствора с ацетоном.
Малорастворим в воде . Очень хорошо растворяется в ацетоне. Хорошо растворяется в других органических веществах (бензине, бензоле и пр.)
Ацетилен обладает незначительным токсическим действием.
Физические свойства ацетилена:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,0896 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,173 |
| Температура плавления, °C | -80,8 |
| Температура кипения, °C | -80,55 |
| Тройная точка, °C | 335 |
| Температура самовоспламенения, °C | 335 |
| Давление самовоспламенения, МПа | 0,14-0,16 |
| Критическая температура*, °C | 35,94 |
| Критическое давление, МПа | 6,26 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,1 до 100 |
| Удельная теплота сгорания, МДж/кг | 56,9 |
| Температура пламени, °C | 3150-3200 |
| Молярная масса, г/моль | 26,038 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства ацетилена:
Химические свойства ацетилена аналогичны свойствам других представителей ряда алкинов. Поэтому для него характерны следующие химические реакции:
- 1. галогенирование ацетилена:
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен);
Реакция протекает стадийно с образованием производных алканов .
В ходе данной реакции ацетилен обесцвечивает бромную воду .
- 2. гидрогалогенирование ацетилена:
- 3. гидратация ацетилена (реакция Михаила Григорьевича Кучерова, 1881 г.):
- 4. тримеризация ацетилена (реакция Николая Дмитриевича Зелинского, 1927 г.):
3СH≡CH → C6H6 (бензол) (kat = активированный уголь, t o = 450-500 о С).
Реакция тримеризации ацетилена является частным случаем реакции полимеризации ацетилена и происходит при пропускании ацетилена над активированным углем при температуре 450-500 о С.
- 5. димеризация ацетилена:
СH≡CH + СH≡CH → CH2=CH-С≡CH (винилацетилен) (kat = водный раствор CuCl и NH4Cl).
Реакция димеризации ацетилена является частным случаем реакции полимеризации ацетилена.
- 6. горение ацетилена:
Ацетилен горит белым ярким пламенем.
- 7. окисление ацетилена.
Протекание реакции и её продукты определяются средой, в которой она протекает.
- 8. восстановления ацетилена:
СH≡CH + Н2 → C2H4 ( этилен ) (kat = Ni, Pd или Pt, повышенная t o );
СH≡CH + 2Н2 → C2H6 ( этан ) (kat = Ni, Pd или Pt, повышенная t o ).
Получение ацетилена в промышленности и лаборатории. Химические реакции – уравнения получения ацетилена:
Ацетилен в лабораторных условиях получается в результате следующих химических реакций:
- 1. действия воды на карбид кальция:
- 2. дегидрирования метана:
- 3. дегидрирования этилена:
Ацетилен в промышленности получают следующими способами и методами:
- 4. карбидным методом:
Сначала получают известь из карбоната кальция.
CаСО3 → CаО + CO2. (t o = 900-1200 о С).
Затем получают карбид кальция , сплавляя оксид кальция и кокс в электро печах при температуре 2500-3000 °С.
CаО + 3С → CаС2 + CO. (t o = 2500-3000 о С).
Далее карбид кальция обрабатывают водой по известной реакции.
В итоге получается ацетилен высокой чистоты – 99,9 %.
- 5. высокотемпературным крекингом метана:
Высокотемпературный крекинг метана осуществляется по известной реакции дегидирования метана в электродуговых печах при температуре 2000-3000 °С и напряжении между электродами 1000 В. Выход ацетилена составляет 50 %.
- 6. различными способами пиролиза метана:
Разновидностью высокотемпературного крекинга метана являются регенеративный пиролиз (Вульф-процесс), окислительный пиролиз (Заксе-процесс или BASF-процесс), гомогенный пиролиз, пиролиз в среде низкотемпературной плазмы .
Так, в ходе регенеративного пиролиза сначала сжигают метан и разогревают насадку печи до 1350-1400 °С. Затем через разогретую насадку на доли секунды пропускают метан, в результате образуется ацетилен.
В ходе окислительного пиролиза метан смешивают с кислородом и сжигают. Образующееся тепло служит для нагрева остатка метана до 1600 °С, который дегидрирует в ацетилен. Выход ацетилена составляет 30-32 %.
В ходе гомогенного пиролиза метан и кислород сжигают в печи при температуре 2000 °С. Затем предварительно нагретый до 600 °С остаток метана пропускают через печь , в результате образуется ацетилен.
При пиролизе в среде низкотемпературной плазмы метан нагревают струей ионизированного газа ( аргона или водорода ).
Применение и использование ацетилена:
– как сырье в химической промышленности для производства уксусной кислоты, этилового спирта, растворителей , пластических масс, синтетических каучуков , ароматических углеводородов,
– для газовой сварки и резки металлов,
– для получения технического углерода ,
– как источник очень яркого, белого света в автономных светильниках , где он получается реакцией карбида кальция и воды.
Взрывоопасность ацетилена и безопасность при обращении с ним:
Ацетилен обладает взрывоопасными свойствами.
Поэтому обращение с ацетиленом требует строгого соблюдения правил техники безопасности.
Ацетилен горит и взрывается даже в отсутствии кислорода и других окислителей.
Смеси ацетилена с воздухом взрывоопасны в очень широком диапазоне концентраций.
Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Взрываемость ацетилена зависит от множества факторов: давления, температуры, чистоты ацетилена, содержания в нем влаги, наличия катализаторов и пр. веществ и ряда других причин.
Температура самовоспламенения ацетилена при нормальном – атмосферном давлении колеблется в пределах 500-600 °C. При повышении давления существенно уменьшается температура самовоспламенения ацетилена. Так, при давлении 2 кгс/см 2 (0,2 МПа, 1,935682 атм.) температура самовоспламенения ацетилена равна 630 °C. А при давлении 22 кгс/см 2 (2,2 МПа, 21,292502 атм.) температура самовоспламенения ацетилена равна 350 °С.
Присутствие в ацетилене частиц различных веществ увеличивают поверхность его контакта и тем самым снижает температуру самовоспламенения при атмосферном давлении. Например, активированный уголь снижает температуру самовоспламенения ацетилена до 400 °С, гидрат оксида железа (ржавчина) – до 280-300 °С, железная стружка – до 520 °С, латунная стружка – до 500-520 °С, карбид кальция – до 500 °С, оксид алюминия – до 490 °С, медная стружка – 460 °С, оксид железа – 280 °С, оксид меди – до 250 °С.
Взрывоопасность ацетилена уменьшается при разбавлении ацетилена другими газами , например азотом, метаном или пропаном.
При определенных условиях ацетилен реагирует с медью , серебром и ртутью образуя взрывоопасные соединения. Поэтому при изготовлении ацетиленового оборудования (например, вентилей баллонов) запрещается применять сплавы , содержащие более 70 % Cu.
Для хранения и перевозки ацетилена используются специальные стальные баллоны белого цвета (с красной надписью «А»), заполненные инертным пористым материалом (например, древесным углём). При этом ацетилен хранится и перевозится в указанных баллонах в виде раствора ацетилена в ацетоне под давлением 1,5-2,5 МПа.
Источник