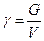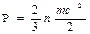Термодинамические параметры
Что такое термодинамические параметры
Термодинамические параметры — явления, описывающие макроскопические движения системы. С греческого слово «parametron» переводится как «отмеривающий» или «соразмеряющий». Таким образом, термодинамические параметры это то, что измеряет систему.
- намагниченность;
- электрическая поляризация;
- масса;
- химический состав компонентов;
- энтропия.
Для описания обычно достаточно трех величин. К примеру, чтобы определить состояние газа, необходимо знать его давление, температуру и удельный объём. Параметры состояния термодинамической системы не зависят от того, каким образом она пришла в данное положение.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Если оно равновесное, то это описывается строго определенным набором величин. Зависимость между ними определяется уравнением состояния, которое и позволяет классифицировать системы.
Классификация величин
Явления, которые характеризируют всю систему целиком, называют макроскопическими. В разных источниках классификация величин отличается, но основные группы все же можно выделить.
- Переменных состояний: экстенсивные и интенсивные величины.
- Фазовые или химические реакции.
- Термо- механические, химические и физические.
- Функционалов процессов: энергия переноса массы, теплота, работа.
В некоторых случаях в литературе используются также такие определения, как внешние и внутренние величины. К первым относят экстенсивные свойства, а ко вторым — внутреннюю энергию, температуру или химсостав.
Термодинамическими параметрами называют и величины, которые поддаются и не поддаются измерению приборами. Давление, температура и объем легко измеряется, а внутреннюю энергию уже нужно вычислять по формулам.
Наряду с термическими параметрами свойств в термодинамике также широко используются и калорические. К ним относятся, в частности энтальпия и энтропия.
Основные величины
К основным термодинамическим параметрам относятся: удельный объем, давление и температура. Если меняется хотя бы одна из этих величин, происходит процесс. Совокупность генеральных свойств системы соответственно определяет ее состояние.
Основные термодинамические параметры состояния:
- Удельный объем. Речь идет о массе вещества, которая обратна плотности. Измеряется в кубических метрах (м3), а масса — в килограммах. Затем рассчитывается удельный объем как объем, деленный на массу.
- Давление. Представляет собой количество силы, прилагаемой к площади. Д ля измерения используют разные единицы (например, Паскаль). Чтобы создать большое давление, прикладывают большую силу либо применяют ее к небольшой площади.
- Температура. Показатель теплоты по температурной шкале Цельсия, Фаренгейта, Кельвина. Мера средней кинетической энергии атомов или молекул в системе. Нулевой закон термодинамики гласит, что тепло не передается между двумя объектами в тепловом равновесии. Следовательно они одинаковой температуры.
- Плотность. Отношение массы вещества к объему. Физическое свойство материи (каждый элемент и соединение имеет уникальную плотность). Плотность определяется как мера относительной тяжести предметов с постоянным объемом.
Основным термодинамическим параметром являются также удельная теплоемкость вещества (объем теплоты, поглощаемой в процессе нагревания на 1 кельвин).
Интенсивные и экстенсивные параметры
Термодинамические параметры состояния делятся на две группы: экстенсивные (суммирующиеся) и интенсивные (выравнивающиеся). В первом случае свойство прямо пропорционально массе системы и обладает аддитивностью. Во втором: параметры таким свойством не обладают и не зависят от массы.
Экстенсивные или аддитививные параметры при фиксированных значениях интенсивных параметров пропорциональны числу частиц в системе (или ее массе). Интенсивные параметры принимают одинаковые значения для любой части равновесной системы, даже когда она не является пространственно однородной.
Экстенсивные величины — величины, значения которых для всей системы равны аналогичному показателю для отдельных ее частей.
К ним относится:
- внутренняя энергия;
- масса;
- энтропия и энтальпия;
- объём.
Интенсивные величины — величины, которые не изменяются при разделении системы на части.
В отличие от них экстенсивные величины зависят от размеров системы и ее массы.
Интенсивные термодинамические параметры:
- температура;
- плотность;
- объем на массу;
- молярный объем (который является объемом на моль);
- средняя молекулярная масса (или молекулярная масса);
- магнитная индукция.
Разновидности по свойствам веществ, вступающих в реакцию
Любая химическая реакция сопровождается изменениями функций состояния системы, определяющихся переменными состояниями системы (объемом, давлением и температурой, количеством молей химических компонентов). Реакция возможна, если вещества имеют более низкую свободную энергию, чем реагенты.
- Внутренняя энергия. Под этим термином понимают совокупность изменяемых составных частей полной энергии системы. Внутренняя энергия уменьшится, если система будет выделять тепло. Следовательно, она растет при увеличении тепла. Поскольку энергия никогда не создается и не разрушается (первый закон термодинамики), изменение внутренней энергии всегда равно нулю.
- Энтропия. Эта мера энергии в системе, которую нельзя использовать для выполнения работы. Генерация энтропии в обратимом процессе равна нулю.
- Энтальпия . Сумма внутренней энергии и произведения давления и объема термодинамической системы. Единицей измерения в Международной системе единиц является джоуль. Иногда также используются британскую тепловую единицу (БТЕ) и калорию.
К характеристикам параметров состояния термодинамической системы относятся разные величины (в том числе температура, состав или плотность и многое другое). Именно они описывают ее в определенный момент времени в зависимости от набора состояний.
Источник
ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ
Каждое равновесное состояние термодинамической системы характеризуется определенными физическими величинами — равновесными параметрами состояния. Внутренние параметры характеризуют внутреннее состояние системы. К ним относятся давление, температура, объем и др. Внешние параметры характеризуют положение системы (координаты) во внешних силовых полях и ее скорость.
В термодинамике существует также деление параметров на термические (давление, температура, объем) и калорические (удельная энергия, удельная теплоемкость, удельные скрытые теплоты фазовых переходов).
Для характеристики конкретных условий, в которых находится данная система, или процесса, идущего в системе, необходимо прежде всего знать такие внутренние параметры состояния, как удельный объем, абсолютное давление, абсолютная температура.
Удельный объем (v, м 3 /кг) — это объем единицы массы или величина, определяемая отношением объема к его массе другими словами Удельный объем v есть объем единицы веса, т. е. объем в кубических метрах, занимаемый одним килограммом газа.
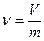
где V — объем произвольного количества вещества, м 3 ; m — масса этого вещества, кг.
Величина, обратная удельному объему, называется плотностью (ρ, кг/м 3 );
Плотность это масса вещества, содержащаяся в единице объема или другими словами, масса единицы объема жидкости называется плотностью
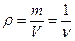
Удельный вес— вес единицы объема жидкости называется удельным весом (кгс, кгс/м 3 , Н/м 3 )
Масса и вес связаны между собой отношением
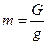
с учетом [3] получим соотношение между удельным весом и плотностью
Давление — величина, определяемая отношением силы (нормальной составляющей силы), действующей на поверхность, к площади этой поверхности (р, Па = Н/м 2 )
Р = 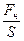
где Fн — нормальная составляющая силы, [Н]; S — площадь поверхности, нормальной к действующей силе [м 2 ]
В соответствии с молекулярно-кинетической теорией давление газа рассматривается как результат ударов молекул о стенки сосуда и определяется соотношением [5]
где n — число молекул в единице объема; m — масса молекулы; с 2 — средняя квадратичная скорость поступательного движения молекул.
Согласно Международной системе единиц (СИ) удельное давление замеряют в Ньютонах на один квадратный метр (Н/м 2 ). Эта единица измерения давления называется Паскалем (Па). Один мегапаскаль равен 10 6 Па (1 МПа = 10 6 Па).
До настоящего времени в технике используется также старая единица измерения удельного давления — техническая атмосфера (ат), представляющая собой силу в 1 кгс, действующую на 1 см 2 площади. 1 ат = 1 кгс/см 2 = 10 4 кгс/м 2 = 9,8 . 10 4 Н/м 2 =9,8 . 10 4 Па = 0,981 бар; 1 бар = 1,01972 кгс/см 2 = 10 5 Па. 1кПа = 10 3 Па.
Различают давления атмосферное, избыточное и разрежение (вакуум). Атмосферным называется давление атмосферного воздуха на уровне моря. За величину атмосферного давления принимается давление столба ртути высотой 760 мм (одна физическая атмосфера — обозначается атм.). Таким образом, 1атм = 760 миллиметров ртутного столба (мм рт. ст.). 1 мм рт.ст. = 133 Па, 1 атм = 10 5 Па
Давление больше атмосферного, называется избыточным, а меньше атмосферного — разрежением. Для измерения давления применяют манометры, атмосферного давления — барометры, разрежения — вакуумметры.
Термодинамическим параметром состояния является только абсолютное давление, которое отсчитывается от абсолютного нуля давления или абсолютного вакуума.
Для измерения давления в технике применяют приборы, измеряющие не абсолютное (полное) давление (Рабс), а разность между абсолютным и атмосферным (барометрическим) давлением Ратм.
Приборы, применяемые для измерения давлений, больших атмосферного, называются манометрами. Они показывают избыток давления измеряемой среды над атмосферным (манометрическое давление). Для измерения давлений меньших атмосферного, применяют вакуумметры, которые показывают, насколько абсолютное давление окружающей среды меньше атмосферного. Эту недостачу давления до атмосферного называют вакуумом.
При замере давлений жидкостными приборами вследствие расширения жидкости при нагревании ее объем увеличивается и, следовательно, увеличивается столб жидкости, что приводит к неправильным показаниям приборов. При таких замерах необходимо высоту столба жидкости приводить к 0 °С. Это приведение производится по формуле
где h0— показания барометра (манометра), приведенные к 0 °С; h— высота столба жидкости, наблюдаемая при t °С; α — объемный коэффициент расширения жидкости (для ртути α — 0,000172).
В технике применяется достаточно большое число единиц измерения давления. Соотношения между ними приведены в таблице [5].
| Единица измерения | Бар | Паскаль, Па (Н/м 2 ) | Физическая атмосфера, атм | Техническая атмосфера, ат (кГ/см 2 ) | Миллиметры ртутного столба, мм рт. ст. | Миллиметры водяного столба, мм вод. ст. |
| 1 бар | 10 5 | 0,987 | 1,02 | |||
| 1 Н/м 2 | 10 -5 | — | — | — | — | |
| 1 атм | 1,013 | 1,033 | ||||
| 1 ат | 0,981 | 0,968 | 735,6 | |||
| 1 мм. рт. ст. | 0,00133 | 0,001316 | 0,00136 | 13,6 | ||
| 1 мм. вод.ст. (1 кГ/м 2 ) | 9,81 10 -5 | 9,81 | 9,68- 10 -5 | 10 -4 | 0,0736 |
Температура.Температура любого тела — величина, характеризующая степень нагретости тела, и представляет собой меру интенсивности «теплового движения» молекул. Таким образом, температура представляет собой меру средней кинетической энергии поступательного движения его молекул, т. е. температура характеризует среднюю интенсивность движения молекул, и чем больше средняя скорость движения молекул, тем выше температура тела. Понятие температуры не может быть применено к одной или нескольким молекулам. Если два тела с различными средними кинетическими энергиями движения молекул привести в соприкосновение, то тело с большей средней кинетической энергией молекул (с большей температурой) будет отдавать энергию телу с меньшей средней кинетической энергией молекул (с меньшей температурой), и этот процесс будет протекать до тех пор пока температуры средних кинетических энергии молекул обоих тел не сравняются, т.е. не выровняются температуры обоих тел. Такое состояние двух тел называется тепловым равновесием
Другими словами если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениться теплотой друг с другом, если же их температуры равны, то теплообмена не будет.
С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул. Ее численное значение связано величиной средней кинетической энергии молекул вещества:
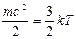
где k — постоянная Больцмана, равная 1,3800662-10 -23 Дж/К. Температура Т, определенная таким образом, называется абсолютной.
В РФ для измерения температур принята стоградусная шкала и абсолютная термодинамическая шкала Кельвина. В стоградусной шкале при Рбаром.= 760 мм. рт. ст., что в системе СИ равно 101 325 н/м 2 , за 0° принимается температура таяния льда, а за 100° температура кипения воды. Градус этой шкалы обозначается через °С. Термометры стоградусной шкалы имеют неравномерные деления, чем учитываются некоторые изменения в зависимости коэффициента расширения жидкости от нагревания.
В отличие от стоградусной шкалы, применявшаяся ранее шкала Цельсия имела те же постоянные точки, соответствующие таянию льда при 0° и кипению воды при 100°, но равномерные деления.
В абсолютной термодинамической шкале Кельвина за нуль принято состояние тела, при котором тепловое движение молекул теоретически отсутствует. Из физики известно, что такое состояние наступает при температуре на 273° С (273,16°) ниже 0° С. Абсолютная температура всегда величина положительна.
Величина градуса по шкале Кельвина принимается равной градусу по стоградусной шкале: 1° К= 1°С; следовательно, ΔT = Δ t.
Соотношение между температурой, измеренной по абсолютной и стоградусной шкале:
0°К = —273° C; 0°С = + 273°К; Т° К = t° С + 273°; Т = —20 0 С = 253 0 К
Параметром состояния газа является абсолютная температура Т° К.
Абсолютная температура — величина всегда положительная. При температуре абсолютного нуля (Т = 0 0 К = — 273,15° С) прекращается тепловое движение молекул.
Источник